高中化学《影响盐类水解的因素》优质课教学设计与反思
- 格式:docx
- 大小:15.29 KB
- 文档页数:5
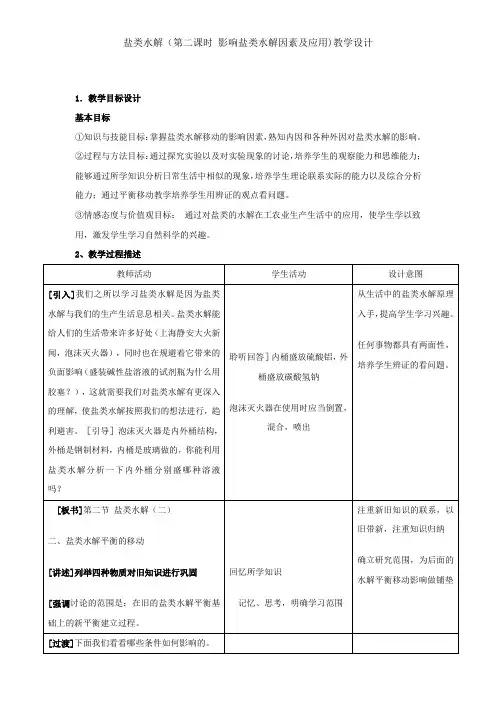
盐类水解(第二课时影响盐类水解因素及应用)教学设计
1.教学目标设计
基本目标
①知识与技能目标:掌握盐类水解移动的影响因素,熟知内因和各种外因对盐类水解的影响。
②过程与方法目标:通过探究实验以及对实验现象的讨论,培养学生的观察能力和思维能力;能够通过所学知识分析日常生活中相似的现象,培养学生理论联系实际的能力以及综合分析能力;通过平衡移动教学培养学生用辨证的观点看问题。
③情感态度与价值观目标:通过对盐类的水解在工农业生产生活中的应用,使学生学以致用,激发学生学习自然科学的兴趣。
2、教学过程描述。

《影响盐类水解的因素》教学设计学习目标1.了解盐类水解的影响因素2.应用盐类水解解决实际问题教学过程一、问题的提出在配制FeCl3溶液时,若将FeCl3晶体直接溶于蒸馏水中,制得的溶液会出现丁达尔效应,放置一段时间后溶液中还会出现浑浊。
二、任务一探究盐类水解的影响因素内因:盐的性质——主要因素①不同弱酸对应的盐②不同弱碱对应的盐③同一弱酸对应的盐【活动1】预测反应条件对FeCl3水解平衡的影响外因:温度升高,平衡向吸热方向移动增大反应物浓度,平衡正向移动增大生成物浓度,平衡逆向移动【活动2】探究温度对水解平衡的影响理论验证:盐类水解是中和反应的逆反应,所以盐类水解是吸热反应实验验证:分别对FeCl3溶液冷水浴和热水浴,观察颜色深浅结论:【活动3】验证反应物浓度对水解平衡的影响数据论证:比较浓度熵与平衡常数的大小关系,进行论证在同一温度下:Q=K,处于化学平衡状态Q<K,向正反应方向进行Q>K,向逆反应方向进行【活动4】验证生成物浓度对水解平衡的影响实验验证:向FeCl3溶液中加入少量浓酸或浓碱,观察溶液颜色变化结论:三、任务二应用水解平衡原理解决问题1.配制易水解的盐溶液问题1:实验室如何配制一定浓度的FeCl3溶液?2.制备某些胶体问题2:实验室如何制备Fe(OH)3胶体?3.制备某些无机化合物问题3:如何用TiCl4制备TiO2?4.泡沫灭火器原理问题4:Al2(SO4)3溶液与小苏打溶液发生水解相互促进反应,产生CO2灭火。
5.解释一些生产、生活事实问题5:为什么氯化铁可用作净水剂?总结:1.影响因素:内因和外因2.应用:配置盐溶液、制备胶体、制备无机化合物、泡沫灭火器原理、解释一些生产和生活事实。


第三节盐类的水解影响盐类水解的主要因素一、教学目标1.知识与技能:掌握盐类水解的影响因素(内因、外因)2.过程与方法:通过问题探究,实验探究等方法,总结归纳影响盐类水解的因素3.情感态度与价值观:树立理论联系实际的思想,学会用辩证的观点看问题二、教学重难点1.教学重点:影响盐类水解的因素(外因)2.教学难点:影响盐类水解的因素(外因)三、教学方法问题探究、实验探究、讨论、归纳等方法四、教学过程【复习】1、判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。
(1)NaNO3(2)Na2CO3(3)NH4Cl (4) AlCl3(5)KCl【导入】影响化学反应速率的因素有哪些?影响化学平衡移动的因素又有哪些呢?那么,这些因素是不是也影响盐类的水解平衡呢?【问题探究1】已知HClO、CH3COOH、HNO2都是弱酸,其电离平衡常数K a 分别为 3.0×10-8、1.8×10-5、4.6×10-4。
试推测等物质的量浓度的NaClO、CH3COONa、NaNO2溶液pH大小顺序。
(1)上述三种盐溶液的碱性不同,说明什么?(2)强碱弱酸盐溶液的碱性强弱与对应弱酸有何关系?(3)思考影响盐类水解的主要因素是什么?【小结1】【板书】影响盐类水解的因素1.内因(主要):盐本身的性质(越弱越水解)【练习1】现有相同物质的量浓度的三种钠盐NaX、NaY、NaZ的溶液,测得它们的PH分别为7、8、9,请将他们对应的酸(HX、HY、HZ)按酸性由强到弱的顺序排列,并说明理由【问题探究2】已知NH4Cl溶液中存在以下的水解平衡:NH4++H2O NH3·H2O+H+,若将NH4Cl溶液加水稀释,平衡移动的方向,水解程度;若加NH4Cl固体,平衡移动方向,水解程度。
总结盐的浓度与水解程度的关系_________________________________【小结2】【板书】2.外因:(1)浓度:越稀越水解【活动探究】通过实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解的因素。

《实验探究:盐类水解的影响因素》教学设计一、指导思想与理论依据在新课程改革的今天,我们应该培养的是具有创新精神和实践能力的人才。
一节好的课堂不光要给学生以知识,更要给他们在旧知识上构建新知识的探究过程。
这就需要教师改变传统教学中的“教师中心论”或“学生中心论”中不适当的思想,才能真正体现出现代教育理论中倡导的“学生的主体地位”,实现“一切为了每一位学生的发展”的教学理念。
为创建开放的学习环境并提高化学课堂教学实效性,在本节课中,我努力从教学设计、教学活动、学习手段等方面实现多样化,力争突破传统的、封闭的教学方式,使学生能够主动有效地参与到教学中来,并激发学生学习研究的兴趣,使学生的主体地位和发展需求得到充分尊重。
二.教学内容分析盐类水解平衡是动态平衡的一种,影响盐类水解因素及应用是已学过的电离平衡理论和平衡移动理论的综合应用。
在学完电离平衡的理论之后,《盐类水解》一节将利用电离平衡的理论来揭示盐类水解的实质,同时帮助学生形成水解平衡的概念。
在本节中用实验来探究影响盐类水解因素之前,教材从盐类物质入手,分析了盐类的组成与盐溶液酸碱性的对应关系,并以水的电离平衡为基础,明确不同盐溶液呈现不同酸、碱性的本质原因。
本课时探讨影响盐类水解因素,侧重于盐类水解达到平衡后,外界条件对盐类水解的影响,尤其是温度、浓度和溶液酸碱性等外因的影响。
本课时是对电离平衡理论、盐类水解知识和平衡移动的综合应用。
三、教学目标设计(1)知识与技能目标:①通过实验一,学会分析影响盐类水解的内因;②通过合作探究,学会分析温度、浓度、酸碱度等外界因素对盐类水解的影响. (2)过程与方法目标:①通过探究实验以及对实验现象的讨论,培养学生的观察能力和思维能力;②用不同思路设计温度、浓度、溶液酸碱性对盐类水解影响的探究实验,并对实验现象进行讨论,使学生掌握外因对盐类水解的影响,并从中使学生从不同方面理解盐类水解平衡,培养学生用辨证的观点看问题。

化学《盐类的水解》教案化学《盐类的水解》教案1教学重点:1.影响盐类水解的因素,与水解平衡移动。
2.盐类水解的应用。
教学难点:盐类水解的应用。
教学设计:师生共同稳固第一课时相关。
(1)依据盐类水解规律分析醋酸钾溶液呈性,缘由;氯化铝溶液呈性,缘由;【设疑】影响盐类水解的内在因素有哪些?【讲解】主要因素是盐本身的性质。
组成盐的酸根对应的酸越弱,水解程度也越大,碱性就越强,越高。
组成盐的阳离子对应的碱越弱,水解程度也越大,酸性就越强,越低。
【设疑】影响盐类水解的外界因素主要有哪些?【讲解】(1)温度:盐的水解是吸热反响,因此上升温度水解程度增大。
(2)浓度:盐浓度越小,水解程度越大;盐浓度越大,水解程度越小。
(3)外加酸碱能促进或抑制盐的”水解。
例如水解呈酸性的盐溶液参加碱,就会中和溶液中的,使平衡向水解方向移动而促使水解,若加酸则抑制水解。
【设疑】如何推断盐溶液的酸碱性?【讲解】依据盐的组成及水解规律分析。
“谁弱谁水解,谁强显谁性”作为常规推断依据。
分析:溶液是显酸性?还是显碱性?为什么? 溶液是显酸性?还是显碱性?为什么?【设疑】如何比拟溶液中酸碱性的相对强弱?【讲解】“越弱越水解”例题:分析溶液与溶液的碱性强弱?∵的酸性比酸性强。
∴水解程度大于水解程度。
∴溶液碱性强于溶液碱性。
【设疑】如何比拟溶液中离子浓度的大小?【讲解】电解质水溶液K存在着离子和分子,它们之间存在着一些定量关系,也存在量的大小关系。
(1)大小比拟:①多元弱酸溶液,依据多元酸分步电离,且越来越难电离分析。
如:在溶液中,②多元弱酸正盐溶液,依据弱酸根分步水解分析。
如:在溶液中,③不同溶液中同一离子浓度的比拟要看溶液中其他离子对其影响因素。
④混合溶液中各离子浓度比拟,要进展综合分析,要考虑电离、水解等因素。
(2)定量关系(恒等式关系)①应用“电荷守恒”分析:电解质溶液呈电中性,即溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。

《影响盐类水解的因素》教学设计【教学目标】1、知识与技能目标:了解影响盐类水解的主要因素。
2、过程与方法目标:实验探究温度、浓度、外加酸或碱对水解平衡的影响。
3、情感态度与价值观目标:学会用盐类水解的原理解释生产、生活中某些应用,体会化学知识与人类生产、生活的密切关系。
【板书设计】:影响盐类水解的因素:1、内因:2、外因:温度浓度酸或碱水解相互促进的盐【设计理念】以实验合作小组为单位,采取实验探究与理论探究结合的形式,使学生体验知识的生成过程。
让学生真正“动”起来,积极参与到“自主、合作、探究”的学习活动中去,实现本节课的“三维教学目标”。
【教学过程】1、课堂引入设计:【问题引入】1、什么是盐类的水解?2、盐类水解的本质是什么?【学生活动】思考后回答。
【设计意图】从复习盐类水解的定义、本质着手,创设探究问题的情境,达到以情激情,激发学生学习兴趣的目的。
2、探究活动一:【思考】 1、是否所有盐类都能水解呢2、水解程度是否都一样呢?【实验探究1】写出下列水解离子方程式,并测定0.1mol·L-1的下列溶液的pH:盐溶液水解的离子方程式pH(0.1mol·L-1 )①NaCl②CH3COONa③NaHCO3【学生活动】分组实验、思考讨论,小组交流后回答。
【设计意图】通过学生的交流研讨及实验探究活动,使学生认识到:⑴原来盐溶液并不都能水解。
“那么什么样的盐能水解呢?”(2)不同盐溶液水解程度也不相同,“那么如何从盐组成上判断不同盐溶液水解程度大小呢?”从而进一步激发学生求知的欲望。
)3、【实验探究二】思考:1、哪些外界条件能对CH3COONa水解平衡产生影响呢?2、你能利用下列试剂设计实验方案验证这些预测吗?试剂:0.1mol·L-1CH3COONa溶液、酚酞试液、CH3COONa固体、蒸馏水、0.5mol·L-1HCl溶液、0.5mol·L-1NaOH溶液【学生活动】分组预测,并讨论实验方案。

《影响盐类水解的因素》名师教案教学目标①识与技能目标:掌握盐类水解移动的影响因素,熟知内因和各种外因对盐类水解的影响。
②过程与方法目标:通过探究实验以及对实验现象的讨论,培养学生的观察能力和思维能力;能够通过所学知识分析日常生活中相似的现象,培养学生理论联系实际的能力以及综合分析能力;通过平衡移动教学培养学生用辨证的观点看问题。
③情感态度与价值观目标:通过对盐类的水解在工农业生产生活中的应用,使学生学以致用,激发学生学习自然科学的兴趣。
学情分析⑴知识基础在学完《盐类水解》第一课时以及《化学平衡》后,学生已有知识①平衡移动理论②盐类水解和盐结构的关系,强酸弱碱盐和强碱弱酸盐水解的规则③盐类水解实质④盐类水解反应离子方程式学生对电离平衡理论、盐类水解知识和平衡移动原理的综合应用方面存在较大差距,课堂上应注重新、旧知识的联系,从学生现有的认知水平出发,同时从生活中提炼出的知识更能激发他们的兴趣,注重学习方法的传授和兴趣引导,切实做到“授之以渔”。
2实验技能基础通过一年多的化学学习和实验,学生掌握了试管实验等基本实验技能。
但对实验设计不是很熟悉,虽然在化学平衡教学中渗透了控制变量的方法,但在实验设计中没有运用过控制变量的方法。
重点难点教学重点:本课时是对电离平衡理论、盐类水解知识和平衡移动理论的综合应用,对学生综合运用知识的能力要求较大,而学生在这方面存在很大差距。
本课时教学内容是在平衡移动原理的基础上、利用内外因分析等方法,并结合电离平衡理论、盐类水解知识对影响盐类水解平衡的因素进行讨论并实际应用。
影响盐类水解平衡因素,盐类的水解的利用即是本课时的重点。
教学难点:在以往学习中学生接触探究实验的机会有限,尤其是本节课知识难度大,需要学生辨证的从同一影响因素的不同方面去理解盐类水解平衡移动,从同一影响因素的不同方面设计实验是本节课的难点。
教学过程【导入】通过油条的图片引入新课,使学生认识到盐类水解能给我们生活带来好处,同时,盐类水解也有它的负面影响,比如说农业谚语,灰粪为什么不能想混所以我们有必要对盐类水解做进一步的探究。
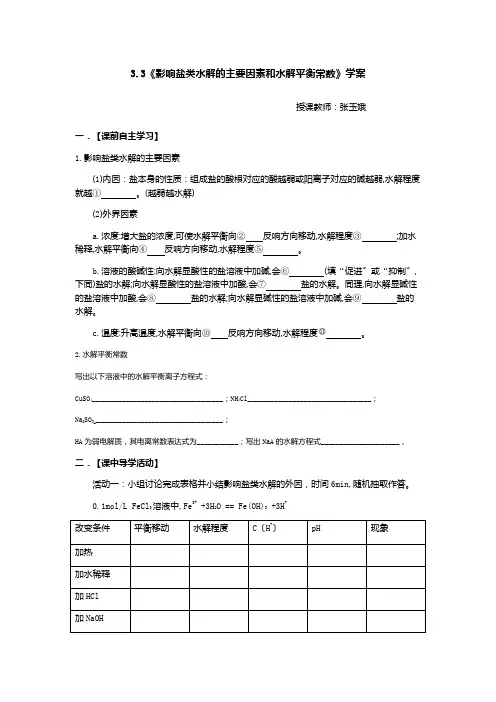
3.3《影响盐类水解的主要因素和水解平衡常数》学案授课教师:张玉娥一.【课前自主学习】1.影响盐类水解的主要因素(1)内因:盐本身的性质:组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度就越①。
(越弱越水解)(2)外界因素a.浓度:增大盐的浓度,可使水解平衡向②反响方向移动,水解程度③;加水稀释,水解平衡向④反响方向移动,水解程度⑤。
b.溶液的酸碱性:向水解显酸性的盐溶液中加碱,会⑥(填“促进〞或“抑制〞,下同)盐的水解;向水解显酸性的盐溶液中加酸,会⑦盐的水解。
同理,向水解显碱性的盐溶液中加酸,会⑧盐的水解;向水解显碱性的盐溶液中加碱,会⑨盐的水解。
c.温度:升高温度,水解平衡向⑩反响方向移动,水解程度。
2.水解平衡常数写出以下溶液中的水解平衡离子方程式:CuSO4___________________________________;NH4Cl_________________________________;Na2SO3___________________________________;HA为弱电解质,其电离常数表达式为___________;写出NaA的水解方程式_____________________,二.【课中导学活动】活动一:小组讨论完成表格并小结影响盐类水解的外因,时间6min,随机抽取作答。
0.1mol/L FeCl3溶液中,Fe3+ +3H2O == Fe(OH)3 +3H+小结:影响盐类的水解的外因有哪些?_______________________________________________________________________________ _______________________________________________________________________________思考:如何配制 FeCl3溶液?将FeCl3溶液蒸干灼烧,最后得到的固体是什么?如果将FeCl3换成Fe2(SO4)3呢?活动二:要求:6min小组讨论完成,随机抽取小组作答,作答时要写出计算过程;其他同学可做补充或评价展示任务分配:1-3组第1题;4-6组第2题;7-9组第3题。

《影响盐类水解的因素》教学设计【教学目标】1、知识与技能目标:了解影响盐类水解的主要因素。
2、过程与方法目标:实验探究温度、浓度、外加酸或碱对水解平衡的影响。
3、情感态度与价值观目标:学会用盐类水解的原理解释生产、生活中某些应用,体会化学知识与人类生产、生活的密切关系。
【板书设计】:影响盐类水解的因素:1、内因:2、外因:温度浓度酸或碱水解相互促进的盐【设计理念】以实验合作小组为单位,采取实验探究与理论探究结合的形式,使学生体验知识的生成过程。
让学生真正“动”起来,积极参与到“自主、合作、探究”的学习活动中去,实现本节课的“三维教学目标”。
【教学过程】1、课堂引入设计:【问题引入】1、什么是盐类的水解?2、盐类水解的本质是什么?【学生活动】思考后回答。
【设计意图】从复习盐类水解的定义、本质着手,创设探究问题的情境,达到以情激情,激发学生学习兴趣的目的。
2、探究活动一:【思考】 1、是否所有盐类都能水解呢2、水解程度是否都一样呢?【实验探究1】写出下列水解离子方程式,并测定0.1mol·L-1的下列溶液的pH:【学生活动】分组实验、思考讨论,小组交流后回答。
【设计意图】通过学生的交流研讨及实验探究活动,使学生认识到:⑴原来盐溶液并不都能水解。
“那么什么样的盐能水解呢?”(2)不同盐溶液水解程度也不相同,“那么如何从盐组成上判断不同盐溶液水解程度大小呢?”从而进一步激发学生求知的欲望。
)3、【实验探究二】思考:1、哪些外界条件能对CH3COONa水解平衡产生影响呢?2、你能利用下列试剂设计实验方案验证这些预测吗?试剂:0.1mol·L-1CH3COONa溶液、酚酞试液、CH3COONa 固体、蒸馏水、0.5mol·L-1HCl溶液、0.5mol·L-1NaOH溶液【学生活动】分组预测,并讨论实验方案。
【设计意图】这是一个学生实验探究活动,可以发挥合作学习的优势,让学生在探究影响盐类水解因素的过程中体验知识的生成过程。

《盐类水解的影响因素》教学设计湖北省荆州中学毛建明一、设计思路《盐类水解的影响因素》一节课是新课标人教版高中化学选修4第三章第三节《盐类水解》第二课时的教学内容。
本课主要从改变条件入手,总结出能够影响盐类水解的主要因素。
对于本节课影响盐类水解的因素学生可以从两条途径获得:一是理论分析,利用已有知识继承迁移而得到。
二是通过实验探究的过程,认识改变条件对盐类水解的影响。
实验探究过程学生需要设计实验方案,观察、分析实验数据,最后得出实验结论。
学生在理论指导的基础上进行实验探究反而会因为有基础而使得遇到问题迎刃而解,增强学习过程的成就感。
基于以上分析,我认为本课的设计应该理论分析与实验探究并重。
二、教学目标1.知识与技能:(1)利用平衡理论,结合实验探究使学生认识影响盐类水解平衡的因素。
(2)学生能够运用规律解决影响盐类水解的实际问题。
2.过程与方法:(1)重视实验数据的分析,通过测定数据—分析数据—图形分析—得出结论,了解实验数据一般的处理方法。
(2)通过“提出问题—理论分析—方案的选择—实验验证—得出结论”的学习过程,帮助学生认识问题的本质,并掌握科学探究的方法。
3.情感态度与价值观:(1)通过对影响盐类水解因素的认识过程,养成理论分析与实验探究并重,严谨求实的科学态度。
(2)通过实验探究,认识设计方案与实验操作的对立统一关系。
树立严谨的化学理念,培养科学发展观。
(3)通过分组设计实验、完成实验,体验团结协作的团队精神。
三、教学重点与难点教学重点:盐类水解反应的平衡移动。
教学难点:浓度对盐类水解的影响教学方法:问题引导、讨论、分析、归纳、总结等。
四、教学准备1.实验用品准备:教师演示实验:酒精灯、火柴、试管、试管夹、酚酞试液、1mol/L醋酸钠溶液;学生实验:烧杯1次氯酸钠溶液0.1mol/L 20mL、烧杯2醋酸钠溶液0.1mol/L 20mL,烧杯3醋酸钠溶液1mol/L 20mL,烧杯4,装废液烧杯,装蒸馏水洗瓶,玻璃棒,50mL量筒,pH计,滤纸。
影响盐类水解的要素公然课教课目的:知识与技术: 1. 使学生理解盐类水解的影响要素。
2.盐类水解的应用。
过程与方法:1、培育学生剖析问题的能力,使学生学会透过现象看实质。
2、培育学生概括思想能力和逻辑推理能力。
b 5E2RGbCAP感情与价值:逐渐浸透现象与实质、一般与特别等对峙一致看法的教育。
经过对盐类水解规律的总结,领会自然万物变化的丰富多彩。
p1EanqFDPw教课要点:解盐类水解的影响要素。
教课难点:解盐类水解的影响要素。
教课方法:启迪式指引法课时安排: 1 课时教课过程:【复习稳固】师生共同回首第一课时有关知识1. 依据盐类水解规律剖析:醋酸钾溶液呈性,原由;氯化铝溶液呈性,原由;DXDiTa9E3d2. 在氯化铵溶液中,以下关系正确的选项是()(A) [Cl - ]>[NH 4+ ]>[H +]>[OH - ] (B) [NH 4+]>[ Cl - ]>[H + ]>[OH- ] RTCrpUDGiT(C) [ Cl - ]=[NH 4+]>[H +]>[OH - ] (D) [NH 4 +]=[ Cl - ]>[H +]>[OH - ] 5PCzVD7HxA毫升摩/升盐酸与50 毫升摩/升氨水溶液混和,在所得溶液中()(A) [Cl - + +-] (B)+ -]>[H+]>[OH-] jLBHrnAILg ]>[NH 4 ]>[H ]>[OH [NH 4 ]>[ Cl(C) [ Cl - ]=[NH 4+]>[H +]>[OH - ] (D) [NH 4 +]=[ Cl - ]>[H +]>[OH - ] xHAQX74J0X【引入新课】活动与研究一1、已知HClO、 CH3COOH、 HNO2 都是弱酸,其电离均衡常数Ka 分别为× 10-8、× 10-5、× 10-4。
影响盐类水解因素的探究教学实验用具教学过程§3.3.2 影响盐类水解的因素一、内因:盐本身的性质二、外因1. 温度2. 浓度3. 酸碱性三、应用九、教学反思本节课有明暗双线:明线是通过实验探究得出影响盐类水解的因素,暗线是学生自主提出猜想、寻找理论支撑和设计验证实验,创新点如下:1. 创新教材实验,解决思维障碍:本节课引入精确度高的数字化实验仪器,将教材定性实验改进为定量实验,利用数字化实验仪器在不影响原有化学反应体系的前提下测定出FeCl3溶液的色度、浊度及pH等定量数据。
通过上述物理量数据可以让学生从宏观上观测和分析微观粒子在水溶液中的具体行为,由感性认知上升到理性认知,完善了自身的思维过程;2. 数字化实验可以对中学平衡体系中多因素、相互矛盾因素的影响进行直观快速地判定:对比传统实验技术,数字化实验可以更加快速准确地判定在矛盾因素下平衡移动的结果,如对FeCl3溶液既加热又加酸,这种在传统实验中无法快速解决的问题,在数字化实验面前迎刃而解。
3. 在实际操作过程中,浓度影响的测定过程让我印象深刻:当时测出稀释后溶液色度RGB值反常升高,重复多次实验后仍是升高趋势,学生对数字化实验仪器表示质疑。
在请教美术教师后,从色相、纯度和明度的角度对学生进行解释,并当场根据色度计实验数据用电脑技术合成稀释后颜色,与稀释前颜色进行对比的确变淡,学生当场表示惊叹和佩服,故而让我深深体会到“闻道有先后,术业有专攻”的道理,只有不断汲取各方面知识,才能让学生信服。
4. 本节课深入落实高中化学核心素养:整堂课以实验探究为主要过程,师生通过创新教材定性实验为定量实验(实验探究与创新意识),观察宏观实验现象以及利用pH传感器等数字化实验仪器观测溶液中微观粒子的行为(宏观辨识与微观探析),利用假说演绎与逻辑推理的方式(证据推理与模型认知)得出影响盐类水解平衡的因素(变化思想与平衡思想),最后结合影响盐类水解的影响因素在生产生活中的重要应用让学生体会到化学应用于社会、服务于社会的科学精神(科学精神与社会责任)《影响盐类水解的因素》实验设计学案【学习目的】1. 猜测影响盐类水解的因素,并提出合理猜想,培养分析问题、搜集理论证据的能力;2. 通过所学知识,设计出合理的实验方案,培养分析实验、设计实验的能力;【学习重难点】影响盐类水解的因素【学习过程】1.什么是盐类的水解?盐类水解的实质是什么?2.根据之前所学知识,以FeCl3为例,写出FeCl3水解的离子方程式,推测影响盐类水解的因素有哪些?3.以FeCl3为例,任选一个影响因素,寻找合理的理论基础,阐述该因素如何影响盐类的水解。
《影响盐类水解程度的主要因素》说课稿尊敬的各位评委老师:大家好!今天我说课的内容是“影响盐类水解程度的主要因素”。
接下来,我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“影响盐类水解程度的主要因素”是高中化学选修4《化学反应原理》中第三章第三节的内容。
盐类的水解是在学生已经学习了化学平衡原理和弱电解质的电离平衡等知识的基础上展开的。
通过对盐类水解的学习,不仅可以加深学生对化学平衡移动原理的理解,还能为后续学习电解质溶液中的离子浓度大小比较、酸碱中和滴定等知识奠定基础。
本节课的重点在于引导学生理解影响盐类水解程度的因素,并能够运用这些因素来解释和解决实际问题。
通过对本节课的学习,有助于培养学生的分析问题和解决问题的能力,提高学生的科学素养。
二、学情分析学生在之前的学习中已经掌握了化学平衡的相关知识,对于平衡的建立、移动以及影响平衡的因素有了一定的认识。
但是,盐类水解的知识相对较为抽象,学生在理解和应用上可能会存在一定的困难。
因此,在教学过程中,要注重引导学生通过实验探究、分析归纳等方法来理解和掌握相关知识,同时要关注学生的思维发展,及时给予指导和帮助。
三、教学目标1、知识与技能目标(1)理解影响盐类水解程度的主要因素,包括内因和外因。
(2)能够运用化学平衡移动原理分析影响盐类水解程度的因素。
(3)掌握盐类水解程度的比较方法。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析问题的能力。
(2)通过小组讨论和交流,培养学生的合作精神和语言表达能力。
3、情感态度与价值观目标(1)让学生体验科学探究的过程,激发学生学习化学的兴趣。
(2)培养学生严谨求实的科学态度和创新精神。
四、教学重难点1、教学重点(1)影响盐类水解程度的内因和外因。
(2)运用化学平衡移动原理分析影响盐类水解程度的因素。
2、教学难点(1)盐类水解程度的比较方法。
第三章水溶液中的离子反应与平衡第三节盐类的水解第2课时影响盐类水解的因素及其应用【教学目标】1.知道水解常数与电离常数之间的关系;2.理解“越弱越水解”并能据此判断溶液的酸碱性强弱;3.知道影响水解平衡的其它外界因素;4.了解盐类水解在生产、生活中的应用。
【教学重难点】影响盐类水解的因素盐类水解的应用【辅助工具】多媒体、视频【教学过程】复习导入【师】上节课我们学习了盐类水解的相关知识点,现在做一个简单的复习:水解的实质,规律及特点。
其中特点是:可逆、微弱、吸热、存在水解平衡。
这与我们学过的化学平衡和电离平衡时一样的,那影响盐类水解平衡的因素有哪些?这就是今天我们要学习的内容。
新课讲授【师】研究弱电解质的电离平衡吋,我们从两个方面进行了考虑:一是内因(弱电解质自身的性质);二是外因(温度、浓度等)。
同样的,研究盐类水解我们也可以从这两个方面入手。
【讲解】以强碱弱酸盐(MA)为例,在水溶液中存在着强酸弱碱盐的电离和水的电离。
A结合电离出来的H+形成弱酸HA。
若HA的酸性小,说明其电离的趋势小,则A结合H+的趋势大、能力强,A的水解程度就大。
简言之:影响盐类水解的内因是盐自身的强弱越弱越水解(生成盐的弱酸越弱,越难电离,则该酸根离子结合H+的能力越强,即该盐水解程度越大;同理,生成盐的弱碱越弱,该盐的水解程度越大)。
【师】接下来我们从水解平衡常数的角度再进行分析。
首先认识一下什么是水解平衡常数。
【讲解】一定温度下,达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)的浓度之比是一个常数,该常数称为水解平衡常数,用Kh表示。
以强碱弱酸盐(MA)为例,其水解的离子方程式为--2A+H O HA+OH则强碱弱酸盐的水解常数为()()-h-c(HA)c OHK=c A⨯。
【师】引导学生进行推导【师】再尝试一下强酸弱碱盐的水解平衡常数,以MOH为例【小结】强碱弱酸盐水解,生成的弱酸酸性越弱,即K a越小,水解程度越大。
影响盐类水解的因素学案【课时目标】掌握外界条件对盐的水解的影响教学重点和难点:盐类水解影的应用【知识梳理】1、影响盐类水解的内因:盐本身的性质,组成盐的酸或碱越_____,则水解程度越大。
①不同弱酸对应的盐碱性:NaClO (aq) NaHCO3 (aq)对应的酸:HClO H2CO3②不同弱碱对应的盐酸性:MgCl2 (aq) AlCl3 (aq)对应的碱: Mg(OH)2 Al(OH)3③同一弱酸对应的盐碱性:Na2CO3 (aq) NaHCO3 (aq)对应的酸:HCO3– H2CO3∴正盐的水解程度酸式盐的水解程度④多元弱酸对应的酸式盐:一般来说,水解趋势 > 电离趋势 ( NaH2PO4和NaHSO3例外)pH值 Na2SO3 Na2SO4 NaHSO3 NaHSO4生成该盐的酸或碱越弱水解程度越大——故比较酸或碱的相对强弱。
2、影响盐类水解的外因(1)温度:因水解是_____过程,故升高温度可______水解,使水解平衡向_____移动,水解百分率_________。
(2)浓度:加水稀释,_______水解(3)酸碱度:向盐溶液中加入H+,可以促进____ 离子水解,抑制__ __离子水解;向盐溶液中加入OH-,可以促进____ 离子水解,抑制____ 离子水解。
[思考] FeCl3水解的方程式________________________________________加水加醋酸加醋酸钠(s)加HCl(g)通NaOH(s)3.盐类水解的应用(一)能水解的盐溶液的配制与保存FeCl3 FeCl2 FeSO4(二) 判断盐溶液的酸碱性:NaCl溶液_______CH3COONa溶液________ NH4Cl溶液________CH3COONH4________ (三) 判定离子能否大量共存:Al3+与 AlO2–_________________________________________________________________________________Al3+与 HCO3–_____________________________________Al3+与 CO32–_____________________________________Al3+与 S2–_____________________________________(四)盐作净化剂的原理:明矾、FeCl3 等明矾净水的原理:______________________________________(五)某些化肥的使用使土壤酸碱性变化(六)利用盐类水解除杂如: MgCl2溶液中混有FeCl3杂质。
这节课,采取实验探究和理论研究两条学习主线:理论研究是运用已有的化学平衡知识,发掘出新知识的“生长点”——盐类水解,形成科学的世界观。
实验探究其目的在于使学生体验科学研究的过程,激发学习化学的兴趣,强化科学探究的意识,促进学习方式的转变,培养学生的创新精神和实践能力。
本节课的教学设计充分体现新课改理念:①引课的情境设计贴近学生、贴近实际;②采用归纳法揭示几类盐水解的规律;③教学重、难点的突破采用自主合作探究方法;④概念的建构充分体现概念的科学价值。
感性和理性两条探究主线相辅相成,使盐类水解的概念统一在化学平衡的理论体系之中。
既达到理论完整,又培养了学生实事求是的科学态度。
教学过程:【温故知新】判断下列溶液的酸碱性,并用离子方程式表示原因:(1) CH3COONa (2) FeCl3(3) Na2CO3(4)NH4Cl (5) Al2 (SO4) 3【导入】影响化学反应速率的因素有哪些?影响化学平衡移动的因素又有哪些呢?那么,这些因素是不是也影响盐类的水解平衡呢?【问题探究1】比较CH3COONa 和Na2CO3溶液的pH大小,探究以下的问题:(1)盐溶液的碱性强弱与对应弱酸有何关系?(2)思考:影响盐类水解的主要因素是什么?【小结1】【板书】影响盐类水解的因素1.内因(主要):盐本身的性质(越弱越水解)【练习1】现有相同物质的量浓度的三种钠盐NaX、NaY、NaZ的溶液,测得它们的PH分别为7、8、9,请将他们对应的酸(HX、HY、HZ)按酸性由强到弱的顺序排列,并说明理由【板书】2.外因:【活动探究】通过探究促进或抑制FeCl3水解的条件,了解影响盐类水解的因素。
【小结3】盐类水解是中和反应的逆反应(吸热反应)【板书】2.外因:(1)温度:升温促进水解(2)加酸(3)加碱【问题探究2】还有哪些外部因素会影响Fe3+的水解?【小结4】【板书】(4)加易水解的盐:同类抑制,异类促进(5)加水:越稀越有利于水解【练习2】填表:CH3COONa溶液中存在以下水解平衡:CH3COO-+H2O CH3COOH+OH-,改变下列条件,填写变化情况:(填写左、右、不移动或增大、减小、不变)改变条件移动方向c(OH–) c(H+) pH 水解程度升温加H2O加醋酸钠固体加冰醋酸通HCl(g)加NaOH固体加NH4Cl固体加Na2CO3固体五、课堂总结:六、达标练习:1.下列物质的水溶液在加热时pH变小的是( )。
影响盐类水解的因素公开课
教学目标:
知识与技能:1.使学生理解盐类水解的影响因素。
2.盐类水解的应用。
过程与方法:1、培养学生分析问题的能力,使学生学会透过现象看本质。
2、培养学生归纳思维能力和逻辑推理能力。
b 5E2RGbCAP
情感与价值:逐步渗透现象与本质、一般与特殊等对立统一观点的教育。
通过对盐类水解规律的总结,体会自然万物变
化的丰富多彩。
plEanqFDPw
教学重点:解盐类水解的影响因素。
教学难点:解盐类水解的影响因素。
教学方法:启发式引导法
课时安排:1课时
教学过程:
【复习巩固】师生共同回顾第一课时相关知识
1. 根据盐类水解规律分析:醋酸钾溶液呈________ 性,原因__________ ;氯化铝溶液呈________ 性,原因
;
DXDiTa9E3d
2. 在氯化铵溶液中,下列关系正确的是( )
(A) [Cl -]>[NH4+]>[H+]>[0H-] (B) [NH;]>[ Cl -]>[H+]>[0H-] RTCrpUDGiT
(C) [ Cl -]=[NH 4+]>[H +]>[OH-] (D) [NH4+]=[ Cl -]>[H +]>[OH-] 5PCzVD7HxA
3.100毫升0.1摩/升盐酸与50毫升0.2摩/升氨水溶液混和,在所得溶液中( )
(A) [Cl -]>[NH4+]>[H+]>[OH-] (B) [NH4+]>[ Cl -]>[H +]>[OH-] jLBHrnAILg
(C) [ Cl -]=[NH 4+]>[H +]>[OH-] (D) [NH4+]=[ Cl -]>[H +]>[OH-] xHAQX74J0X
【引入新课】
活动与探究一
1、已知HCIO CH3COOH HNO2都是弱酸,其电离平衡常数Ka分别为3.0 X 10-8、1.8 X 10-5、4.6 X 10-4。
你从中获取了那些信息?LDAYtRyKfE
活动1、请同学们书写0.1mol/L NaCIO、CH3COONa NaNO2溶液水解的离子方程式。
活动2、如何测定0.1mol/L NaCIO、CH3COONa NaNO2溶液pH的大小。
探究1、请根据已知信息和盐溶液PH测定的测定结果,分析其内在的联系。
1、已知HCIO CH3COOH HNO2都是弱酸,其电离平衡常数Ka分别为3.0 X 10-8、1.8 X 10-5、4.6 X 10-4。
你从中获取了那些信息?Zzz6ZB2Ltk
一、盐类水解平衡影响因素
1、内因:
盐本身的性质。
4)0.1moI/L(NH4)2CO3 溶液0.1moI/LNa2CO3 溶液
(越弱越水解)
例题1
① 不同弱酸对应的盐对应的酸HClO 碱性NaClO (aq)
CH3COOH
CH3COONa (aq)
② 不同弱碱对应的盐对应的
碱Mg(OH)2Al(OH)3
酸性MgCl2 (aq) AlCl3 (aq)
4)0.1moI/L(NH4)2CO3 溶液 0.1moI/LNa2CO3 溶液
活动探究二
活动3、从FeCI3的组成分析,FeCI3溶液是否易发生水解?水解的产物是什么? FeCI3溶液的酸碱性如何?
请写出FeCI3水解的化学方程式和离子方程式。
dvzfvkwMIl
大胆猜测:既然盐类的水解也存在水解平衡,根据之前学过的化学平衡移动知识,你能联想到影响 解平衡的因素有哪些呢?
rqyn14ZNXI
板书、在一定条件下,当盐类的水解速率等于中和速率时,达到水解平衡。
活动探究二
实验探究、教材 P83 2、完成下列实验,将实验现象和对实验现象的解释记录到表 3-13 中。
思考 1、【实验 1】的目的是什么? 根据【实验 1】和 【实验 2】所得数据推测,请你用化学平衡移动的原
理解释上述实验现象。
EmxvxOtOco
思考2、【实验3】试管A 、B 、C 中,当Fe2(SO4)3达到水解平衡时,对试管 A 加热、试管B 加H2SO4溶液,
分别对水的电离有何影响?请你用化学平衡移动的原理解释上述实验现象。
SixE2yXPq5
例题 1、(1)现有的 0.1moI/L 纯碱溶液,纯碱溶液呈碱性的原因是(用离子方程式表示) : ( 2 )预测该溶液 pH 值的可能范围?
(3 )设计一个简单的实验方案验证纯碱溶液呈碱性是由 CO32吗I 起的。
取少量纯碱溶液先滴入酚酞 (变红 ),分成三等份 一份做参照,一份加入
BaCI2晶体(红色变浅)
一份加 NaCI 晶体(颜色不变)
( 4)设计一个简单的实验方案验证纯碱水解是吸热反应。
取少量纯碱溶液先滴入酚酞(变红) ,分成两等 分一份做参照,一份微热溶液颜色(变深) , 冷却后溶液又(变浅) 。
例题 2、比较下列溶液的 pH 大小(填“ >”“ <”或“ =”)
1) ___________________ 0.2moI/LNH4CI 溶液 0.1moI/LNH4CI 溶液 2) _____________________ 0.1moI/LNa2CO3 溶液 0.1moI/LNaHCO3 溶液
3) _______________________ 25 C 时 1mol/LFeCI3 溶液 80 C 时 1mol/LFeCI3 溶液
板书:三、影响盐类水解的因素: 1 •主要因素是盐本身的性质。
组成盐的酸或碱越弱,盐的水解程度越大,其盐溶液的酸性或碱性就越强。
“无弱不水解,有弱即水解,越弱越水解, 谁强显谁性” 6ewMyirQFL
2 •影响盐类水解的外界因素
(1) 温度:盐的水解是吸热反应,因此升高温度水解程度增大。
(2) 浓度:盐浓度越小,水解程度越大;盐浓度越大,水解程度越小。
(3)
外加酸碱能促进或抑制盐的水解。
例如水解呈酸性的盐溶液加入碱,就会中和溶液中的 H +,使平衡向水解方向移动
而促使水解,若加酸则抑制水解。
kavU42VRUs
FeCI3 水
动态平衡)
作业:导学教学反思:
教学设计上,教师先设计了探究问题,让学生去思考,实验验证,但是学生经过读书,就将结论拿出来了,“越弱越水解、越稀越水解”。
教师可以就结论设计探究,为什么有这样的是这样的规律。
让学生动脑、分析其内在的规律。
y6v3ALoS89教师也可以这样设计教学过程:让学生自己看书,提出自己对这节课中一些知识点的认识,也提出自己的疑问,教师利用学生的疑问设计探究问题,让学生无资料好看,只能动脑思考。
通过启发、禾U用教材等手段解决“越弱越水解、越稀越水解”的内在原理。
M2ub6vSTnP
这样的设计可以提高学生的阅读能力,归纳总结;也可以掌握学情,也可以使课堂教学中学生动起来,而不是教师一言堂。
OYujCfmUCw。