热化学方程式
- 格式:ppt
- 大小:297.00 KB
- 文档页数:25

1.概念:表示参加反应物质的量和反应热的关系的化学方程式。
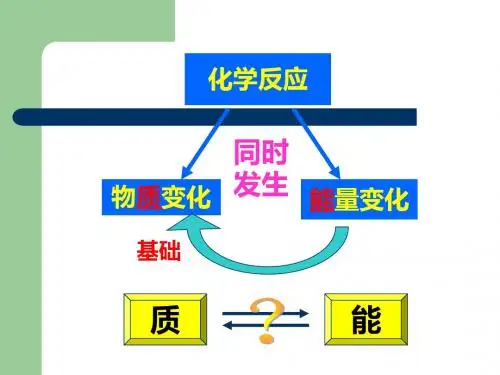
2.意义:表明了化学反应中的物质变化和能量变化。
如:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1表示2 mol氢气和1 mol氧气反应生成2 mol液态水时放出571.6 kJ的热量。
3.热化学方程式书写注意事项:(1)注明反应条件:反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
(2)注明物质状态:常用s、l、g、aq分别表示固体、液体、气体、溶液。
(3)注意符号单位:ΔH应包括“+”或“-”、数字和单位(kJ·mol-1)。
(4)注意守恒关系:原子守恒和得失电子守恒;能量守恒。
(ΔH与化学计量数相对应)(5)区别于普通方程式:一般不注“↑”、“↓”以及“点燃”、“加热”等。
(6)注意热化学方程式的化学计量数:热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
(7)同素异形体转化的热化学方程式除了注明状态外,还要注明名称。
如①S(单斜,s)+O2(g)===SO2(g)ΔH1=-297.16 kJ·mol-1②S(正交,s)+O2(g)===SO2(g)ΔH2=-296.83 kJ·mol-1。
(8)注意可逆反应中的反应热及热量变化问题:由于反应热是指反应完全时的热效应,所以对于可逆反应,其热量要小于反应完全时的热量。
4.热化学方程式的书写模板:5.热化学方程式的正误判断模板:5.热化学方程式书写或判断易出现的错误:(1)未标明反应物或生成物的状态而造成错误。
(2)反应热的符号使用不正确,即吸热反应未标出“+”号,放热反应未标出“-”号,从而导致错误。
(3)漏写ΔH 的单位,或者将ΔH 的单位写为kJ ,从而造成错误。

热化学方程式热化学方程式:理解化学反应的热效应在化学领域,热化学是一门研究化学反应中能量的转化和传递的科学。
热化学方程式则是表达化学反应中能量变化的工具。
本文将介绍热化学方程式的概念、书写规则以及在化学工程中的应用。
热化学方程式不仅表达了反应物和生成物之间的物质转化关系,还体现了化学反应中的能量变化。
反应物和生成物之间的能量差异被称为“焓变”,用符号ΔH表示。
当ΔH为正值时,反应需要吸收能量;当ΔH为负值时,反应则释放能量。
书写热化学方程式需要遵循一定的规则。
首先,需要明确反应物和生成物,并用化学式表示。
其次,需要在等号上方或下方注明反应所需的条件,如反应时的温度、压力等。
此外,反应热也要准确标注,通常以ΔH来表示。
在化学工程中,热化学方程式具有重要应用价值。
通过热化学方程式,我们可以精确地预测化学反应的能量需求或输出,从而优化反应条件,提高反应效率,降低能源消耗。
此外,热化学方程式还可以帮助我们理解和解释一些化学现象,如火山喷发、燃料燃烧等。
总之,热化学方程式是化学反应中能量转化的有效表达方式。
通过学习和掌握热化学方程式,我们可以更好地理解化学反应的本质,为化学工程实践提供有力支持。
热化学方程式书写热化学方程式的书写是化学领域中一项重要的技能,它用于描述化学反应中能量的转换和传递。
本文将向大家介绍如何正确地书写热化学方程式,并深入探讨其中的原理和概念。
首先,我们需要了解热化学方程式的类型。
常见的热化学方程式有两种形式:普通的热化学方程式和标准热化学方程式。
普通的热化学方程式主要用于描述具体温度和压力下的化学反应,而标准热化学方程式则用于描述任何温度和压力下的标准摩尔反应热。
书写热化学方程式的步骤如下:1、写出反应物和生成物的化学式。
2、在反应物和生成物之间添加箭头,表示反应方向。
3、根据反应的本质和原则,确定反应的摩尔反应热。
4、将摩尔反应热与化学方程式的系数相乘,并置于方程式的右侧。
5、在摩尔反应热后面添加适当的单位,如“kJ/mol”或“kcal/mol”。

热化学方程式的经典讲解与习题热化学方程式一、考查内容及方式1. 热化学方程式的书写一般热化学方程式书写:⑴ 必须注明各过渡态、生成物的状态(s 、l 、g 、aq ),另外不标“↑”和“↓”符号。
(2)△H 中“+”“-”运用准确;数值与系数对应;单位都用kJ/mol 如 SO3(g)+H2O(g)= H2SO 4(l) △H=-286 kJ/mol表示燃烧热或中和热的热化学方程式书写,有特殊要求. 表示某物质燃烧热的热化学方程式要求可燃物系数为1,且燃烧中间体为稳定状态. 如C 应转化为CO 2, H 2应转化为H 20(l).表示中和热的热化学方程式,应为强酸强碱生成1mol H20(l)且不伴随其他离子反应如沉淀生成。
2. 反应热的比较( 1)比较△H 大小时,要带“+”“-”比较;比较反应热大点小时,要去掉“+”“-”看绝对值.3. 反应热的简单计算 A 利用能量变化图像计算 B 利用键能计算C 利用科特定律计算D 混合物燃烧能量计算。
4. 中和热测定掌握实验装置,所需仪器,计算原理。
∆H=-cm(t1-t2)/ n H2O kJ/mol,二基础练习1、25 ℃,101 k Pa时,强酸强碱与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。
下列热化学方程式书写正确的是2-A.2H +(aq) +SO 4(aq)+Ba 2+(aq)+2OH(aq) =BaSO4(s)+2H2O(1) ; ∆H=-57.3 kJ/mol -11H 2 SO 4(aq) = K 2SO 4(aq)+H2O(l); ∆H=-57.3kJ/mol 2225C.C 8H 18 (l)+ O 2(g) = 8CO2 (g)+ 9H2O (g); ∆H=-5518 kJ/mol 2D.2C 8H 18(g)+25O2 (g) =16CO2 (g)+18H2O(1); ∆H=-5518kJ/mol B.KOH(aq)+2、已知31g 白磷变成31g 红磷放出18.39KJ 热量,下列两个反应中:4P (白磷,s )+5O2(g )=2P 2O 5(s )△H 1= -Q 1 KJ/mol4P (红磷,s )+5O2(g )=2P 2O 5(s )△H 2= -Q 2 KJ/molQ 1和Q 2的关系为△H 1 和△H 2的关系为3、已知充分燃烧a g乙炔气体时生成1mol 二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式4、确知在发射卫星时可用肼(N2H 4) 为燃料和NO 2作氧化剂, 这两者反应生成N 2和水蒸气. 又已知:①N 2(气)+2O2(气)==2NO2(气); △H=+67.7kJ/mol①②N 2H 4(气)+O2(气)=N2(气)+2H2O(气); △H =-534kJ/mol②试写出肼与NO 2反应的热化学方程式_______________________________1、下列热化学方程式中,△H 能表示对应物质的燃烧热的是A 、CO(g)+B 、C(s)+1O 2(g)=CO 2(g);△H =-283.0 kJ/mol 21O 2(g)=CO(g);△H =-110.5 kJ/mol 21C 、H 2(g)+O 2(g)=H 2O(g);△H =-241.8 kJ/mol 2D 、2C 8H 18(l)+25O 2(g)=16CO 2(g)+18H 2O(g);△H =-11036.0 kJ/mol2、已知下列热化学方程式:11-CH 4(g)+O 2(g)=CO 2(g)+H 2O(l);△H =-445.15 kJ·mol 1 223-CH 4(g)+O 2(g)=CO(g)+2H 2O(l);△H =-607.3 kJ·mol 1 2CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l);△H =-890.3 kJ·mol 1- CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-802.3 kJ·mol 1则CH 4的燃烧热为--A 、445.15 kJ·mol 1 B 、607.3 kJ·mol 1--C 、890.3 kJ·mol 1 D 、802.3 kJ·mol 13、已知:C (金刚石)=C (石墨);△H =-Q (Q >0),下列热化学方程式中反应热最大的是-A 、C (金刚石)+B 、C (石墨)+1O 2(g)=CO(g);△H =-Q 1 21O 2(g)=CO(g);△H =-Q 2 2C 、C (金刚石)+O 2(g)=CO 2(g);△H =-Q 3D 、C (石墨)+O 2(g)=CO 2(g);△H =-Q 44、发生原电池的氧化钙反应通常是生成物,在理论上可设计成原电池的化学反应是A 、C(s)+H 2O(g)=CO(g)+H 2(g);△H >0B 、Ba(OH)2·8H 2O(s)+2NH 4Cl(s)=BaCl 2(aq)+2NH 3·H2O(l)+8H 2O(l);△H >0C 、CaC 2(s)+2H 2O(l)→Ca(OH)2(s)+C 2H 2(g);△H <0D 、CH 4(g)+2O 2(g)→CO 2(g)+2H 2O(l);△H <05、前述说法或表示方法正确的是A 、等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多B 、由C (石墨)→C (金刚石);△H =+119 kJ/mol可知,金刚石比石墨持久5C 、在25℃,1.01×10Pa 时,2 g氢气完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H 2(g)+O 2(g)=2H 2O(l);△H =-571.6 kJ/mol+-D 、H (aq)+OH (aq)=H 2O(l);△H =-57.3 kJ/mol,若将含0.5 mol H2SO 4的浓硫酸与含1 mol NaOH的氢氧化钠溶液混合,放出的热量等于57.3 kJ6、已知下列热化学方程式:C(s)+O 2(g)=CO 2(g);△H =-393.5 kJ/mol;2H 2(g)+O 2(g)=2H 2O(g );△H =-483.6kJ/mol。






初三热化学方程式3篇相互支持,共同奋斗:相信自己,直到成功那一刻,笑看风云!三年磨一剑,六月试锋芒。
乘风破浪、所向披靡、金榜题名。
下面是小编给大家带来的初三热化学方程式,欢迎大家阅读参考,我们一起来看看吧!热化学方程式是什么概念热化学方程式是用以表示化学反应中的能量变化和物质变化。
热化学方程式的意义为热化学方程式不仅表明了一个反应中的反应物和生成物,还表明了一定量物质在反应中所放出或吸收的热量。
它表示化学反应中的物质变化和焓变(或能量变化;热量变化)。
例如,热化学方程式:H2(g)+ Cl2(g) = 2HCl(g)△rHm = -183 kJ/mol方程的意义是在标准态时,1mol H2(g)和1mol Cl2(g)完全反应生成2mol HCl(g),反应放热183kJ。
热化学方程式代表着一个假想的过程,实际反应中反应物的投料量比所需量要多,只是过量反应物的状态没有发生变化,即使是一个无法全部完成的反应,也不会因此影响反应的反应热。
书写事项1、反应热与温度和压强等测定条件有关,所以书写时指明反应时的温度和压强,若是标准状态下,即温度为25℃(298.15K)、气压为101kPa时,可以不注明。
2、各物质化学式右侧用圆括弧()表明物质的聚集状态。
可以用g、l、s分别代表气态、液态、固态。
固体有不同晶态(同素异形体)时,还需将晶态(形)注明,例如S(斜方),S(单斜);C(石墨),C(金刚石)等。
溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq,∞) 代表无限稀释水溶液。
3、热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。
4、△H只能写在化学方程式的右边,若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”。
其单位一般为kJ/mol,有时也用J/mol。
5、热化学方程式是表示反应已完成的数量。
由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。

注意:本练习有答案,是白色的,全选下方的强化练习,改成黑色就可看见答案热化学方程式的意义和书写规范热化学方程式与一般化学反应方程式的区别反应热通常以一定量物质(以mol 为单位)在反应中所放出或吸收的热量来衡量。
表明反应所放出或吸收的热量的化学方程式叫做热化学方程式。
书写时要注意: (1)在化学方程式右端注上热量的数值和符号。
放热用“+”表示,吸热用“-”表示,热量单位用千焦(kJ)表示。
(2)反应物和生成物要注明其聚集状态。
如:2H 2(g)+O 2(g)====2H 2O(g)+483.6kJ(3)热化学方程式中各化学式的化学计量数表示该物质的物质的量(4)当原化学反应逆向进行时,反应热数值不变,符号相反。
如:C(s)+H 2O(g) ==== CO(g)+H 2(g)-131.4kJ CO(g)+H 2(g) ==== C(s)+H 2O(g)+131.4kJ由于物质的状态改变时,必然伴随着能量的改变,反应中各物质的状态必然影响反应热的大小,即反应热与物质的聚集状态有关。
如:2H 2(g)+O 2(g)==2H 2O(g)+483.6kJ2H 2(g)+O 2(g)==2H 2O(l)+571.5kJ以上两式中热量的差值(87.9 kJ)实际上是生成的2mol 水由气态变成液态时放出的热。
热化学方程式一般不标明反应条件。
因为式中的反应热数据通常在25℃和1.01×105Pa 下测定的,该数值已隐含有一定的反应条件。
根据热化学方程式进行计算,要把握住热化学方程式中各物质的化学计量数表示该物质的物质的量,并将反应热看作化学方程式中的一项,仿照一般化学方程式的计算程序进行计算。
[要点提示]热化学方程式是学习热化学的重要工具。
化学反应所释放的能量是当今世界上重要的能源之一,国防上用的火箭燃料、高能电池等,都是利用化学反应所释放的能量的。
而化学反应中的能量变化通常表现为热能的变化。
所以从能量的角度考虑化学变化的问题,认识并掌握热化学方程式以帮助我们较全面地认识化学反应的本质。
热化学方程式和反应热的计算在化学反应中,热化学方程式和反应热是非常重要的概念。
热化学方程式描述了化学反应中热能的变化,而反应热则表示在单位摩尔物质参与反应时所释放或吸收的热量。
本文将介绍热化学方程式的表示方法,并提供一些计算反应热的具体步骤。
一、热化学方程式的表示方法热化学方程式通常以物质的化学式来表示,同时还标注了反应热的值。
下面是一个示例:2H2 + O2 → 2H2O + 483.6 kJ在这个示例中,2H2和O2是反应物,2H2O是生成物。
方程式的右侧的“483.6 kJ”表示该反应在生成2摩尔水分子时释放出483.6千焦耳的热量。
二、计算反应热的步骤要计算反应热,需要首先找到相关反应的热化学方程式。
然后,按照下面的步骤进行计算:步骤一:通过已知化学反应方程式确定需要计算的反应物和生成物的摩尔数。
在上面的示例中,反应物是2摩尔的H2和1摩尔的O2,生成物是2摩尔的H2O。
步骤二:查找反应物和生成物的标准生成焓。
标准生成焓是1摩尔物质形成时的热量变化。
通常以ΔH表示。
在化学数据手册或其他参考资料中可以找到这些值。
步骤三:计算热反应方程式中的反应热。
根据热化学方程式中的摩尔数和标准生成焓,计算反应物和生成物的热反应。
在上面的示例中,H2的标准生成焓为0 kJ/mol,O2为0 kJ/mol,H2O为-285.8 kJ/mol。
因此,通过计算可以得到反应热为:(2 x 0 kJ/mol) + (1 x 0 kJ/mol) - (2 x -285.8 kJ/mol) = 571.6 kJ最后,将计算结果的符号进行修正。
根据热化学方程式中的反应热值的符号,可以判断反应是吸热还是放热。
这里的正值意味着反应是放热的。
三、热化学方程式和反应热的应用热化学方程式和反应热的计算在化学中有着广泛的应用。
其中一项重要的应用是在化学工程中确定反应条件和优化反应热效应。
通过计算反应热,可以了解到反应过程中释放或吸收的热量大小,从而可以设计和控制反应的温度和压力等条件。
高二化学:热化学方程式知识点高二化学:热化学方程式知识点化学热化学方程式是什么1.定义表示反应所放出或吸收热量的化学方程式,叫做热化学方程式。
2.表示意义不仅表明了化学反应中的物质变化,也表明厂化学反应中的能量变化。
化学热化学反应方程式的书写热化学方程式与普通化学方程式相比,在书写时除厂要遵守书写化学方程式的要求外还应注意以下问题:1.注意△H的符号和单位△H只能写在标有反应物和生成物状态的化学方程式的右边。
若为放热反应,△H为“-”;若为吸热反应,△H为“+”。
△H的单位一般为kJ/moJ。
2.注意反应条件反衄热△H与测定条件(温度、压强等)有关。
因此书写热化学方程式时应注明△H的测定条件。
绝大多数△H是是25℃、101kPa下测定的,此条件下进行的反应可不注明温度和压强。
3.注意物质的聚集状态反应物和生成物的聚集状态不同,反应热△H不同。
因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。
气体用“g”,液体用:l“,固体用“s”,溶液用“aq”。
4.注意热化学方程式的化学计量数(1)热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此化学计量数可以是整数,也可以是分数。
(2)热化学方程式中的反应热表示反应已完成时的热量变化,由于△H与反应完成的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。
当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
化学五大反应方程式整理化学五大反应方程式整——物质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO化学五大反应方程式整理——几个分解反应:1. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑2. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑3. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑4. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑5. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑6. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑化学五大反应方程式整理——几个氧化还原反应:1. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O2. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑5. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO26. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO27. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2化学方程式整理——单质、氧化物、酸、碱、盐的相互关系1. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑2. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑3. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑4. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑5. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑6. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑7. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑8. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑化学五大反应方程式整理——其它反应:1.二氧化碳溶解于水:CO2 + H2O === H2CO32.生石灰溶于水:CaO + H2O === Ca(OH)23.氧化钠溶于水:Na2O + H2O ==== 2NaOH4.三氧化硫溶于水:SO3 + H2O ==== H2SO45.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O6.无水硫酸铜作干燥剂:CuSO4 + 5H2O ====CuSO4·5H2O。