试样中氧化锰含量的测定(精)
- 格式:doc
- 大小:13.50 KB
- 文档页数:2



钢渣氧化锰含量的测定火焰原子吸收光谱法1范围本部分规定了采用原子吸收光谱法测定氧化锰含量的方法。
本部分适用于钢渣中氧化锰含量的测定,测定范围:(质量分数)0.1~13.00%。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T2007.2钢渣氧化锰含量的测定火焰原子吸收光谱法制备GB/T6379.1测量方法与结果的准确度(正确度与精密度)第1部分:总则与定义GB/T6379.2测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法GB/T6682分析实验室用水规格和试验方法GB/T7728冶金产品化学分析,火焰原子吸收光谱法通则GB/T8170数值修约规则与极限数值的表示和判定GB/T12806实验室玻璃仪器单标线容量瓶GB/T12807实验室玻璃仪器分度吸量管GB/T12808实验室玻璃仪器单标线吸量管3术语和定义3.1本文件没有需要界定的术语和定义。
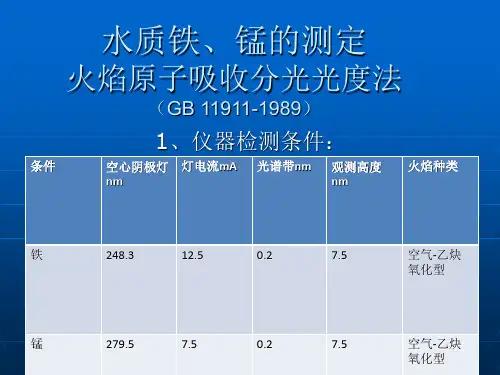
4原理4.1试样于聚四氟乙烯烧杯中,用盐酸、硝酸、氢氟酸进行分解,高氯酸冒烟驱尽氟和硅,在盐酸介质中,将试液喷入空气乙炔火焰中,用锰空心阴极灯作光源,于279.5nm处测量吸光度。
5试剂除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或与其纯度相当的水。
5.1无水碳酸钠,固体。
5.2盐酸(ρ1.19g/mL)。
5.3硝酸(ρ1.42g/mL)。
5.4盐酸(1+1)。
5.5氢氟酸(ρ1.15g/mL)。
5.6高氯酸(ρ1.67g/mL)。
5.7氧化锰标准溶液(1000ppm)氧化锰标准溶液,1000ug/mL,称取0.7745g纯金属锰(Mn>99.95%)预先用稀硝酸洗净表面氧化物,取出,立即用蒸馏水反复洗净,再放在无水乙醇中洗4次~5次,取出放在干燥器中(干燥后方便使用),置于250mL烧杯中,加20mL硝酸(1+3),加热溶解,煮沸驱尽氮氧化物,取下冷却至室温,移入1000mL 容量瓶中,用水稀释至刻度,摇匀。

水泥中氧化镁含量测定基准法与代用法差异分析薛源【摘要】水泥中氧化镁含量是影响水泥性能的品质指标之一,是造成水泥安定性不良的原因之一、是判断水泥是否合格的重要依据.氧化镁含量不合格会使水泥强度降低,水泥石变形、开裂甚至渍散、严重影响工程质量.氧化镁的测定方法很多,GB/T176-2008《水泥化学分析方法》标准中给出了两种氧化镁的测定方法(络合滴定法、火焰原子吸收光谱法).本设计对两种测定方法进行大量的试验操作,对试验结果进行了对比分析,对容易产生问题的步骤给出相应的操作要点,以提高测定的准确度.【期刊名称】《中国水泥》【年(卷),期】2017(000)009【总页数】4页(P92-95)【关键词】氧化镁;络合滴定;原子吸收;分析【作者】薛源【作者单位】山东省产品质量检验研究院,山东泰安271000【正文语种】中文【中图分类】TQ172.14水泥是重要的建筑材料,用其制成的砂浆或混凝土广泛应用于土木建筑、桥梁等工程。
水泥中的化学成分对混凝土的影响非常大。
水泥中氧化镁在水泥凝结硬化后会与水生成Mg(OH)2导致在硬化了的水泥中产生局部的膨胀压力,使水泥强度降低,水泥石变形、开裂甚至渍散,严重影响工程质量。
在国标规定,凡氧化镁,三氧化硫,初凝时间,安定性中任一项不符合要求,均判为废品。
因此准确地测定水泥中氧化镁的含量具有重要意义。
1 试验部分GB/T176-2008《水泥化学分析方法》标准中给出了两种氧化镁的测定方法,代用法:络合滴定法,基准法:原子吸收光谱法,以下简单介绍两种方法。
1.1 络合滴定法(EDTA差减滴定法)在PH10的溶液中,以三乙醇胺、酒石酸钾钠作掩蔽剂,用酸性铬蓝K-萘酚绿B 混合指示剂,以EDTA标准溶液滴定钙镁总量;扣除滴定钙时消耗的EDTA标准溶液的毫升数后,求算氧化镁的含量。
试样中氧化锰的含量重0.5%以上时,加盐酸羟胺将Mn3+还原成Mn2+,用EDTA标准溶液滴定钙镁锰总量。

光学分析练习题一、选择题1、摩尔吸光系数ε与下面因素中有关系的量是(D)A. 比色皿厚度;B. 有色物质浓度;C. 比色皿材料;D. 入射波长2、测定纯金属钴中微量锰时,在酸性溶液中用KIO4氧化Mn2+为MnO4-后进行分光光度的测定。
若用纯金属锰标准溶液在同样工作条件下作标准曲线,则参比溶液应为(D)(提示:钴溶液呈粉红色)A.含钴的溶液;B. 含钴和KIO4的溶液;C. 蒸馏水;D. 三种溶液都可以3、原子吸收分光光度法是:基于从光源辐射的待测元素的特征谱线的光,通过样品的蒸汽时,被蒸汽中待测元素的下列哪种粒子吸收,然后由辐射特征谱线光被减弱的程度,来测定样品中待测元素的含量。
(D)A. 原子;B. 激发态原子;C. 分子;D. 基态原子4、在火焰原子化过程中,下列哪一个化学反应是不可能发生的(C)A. 电离;B. 化合;C. 还原;D. 聚合5、待测元素能给出两倍于仪器噪声的读数时的浓度或量,称为(A)A. 检出限;B. 灵敏度;C. 特征浓度;D. 最小检出量6、原子吸收分析中光源的作用是(D)A. 产生紫外光;B. 提供试样蒸发和激发所需要的能量;C. 发射足够强度的连续波长的光;D. 发射待测元素的特征谱线7、紫外光谱的电磁波谱范围是(C)A:400~760nm B:0.75~2.5μm C:200~400nm D:2.5~25μm8. 原子吸收分光光度法的主要干扰来自于(B)A:空心阴极灯B:原子化系统C:分光系统D:检测系统9. 火焰原子吸收法、石墨炉原子吸收法及氢化物原子吸收法的主要区别在于(D)A:所依据的原子吸收原理不同B:所采用的光源不同C:所利用的分光系统不同D:所采用的原子化方式不同10. 原子吸收光谱是由下列哪种粒子产生的(B )A:固体物质中原子的外层电子B:气态物质中基态原子的外层电子C:气态物质中激发态原子的外层电子D:气态物质中基态原子的内层电子二、填空1、原子吸收法中常用的原子化器是_火焰原子化器,非火焰原子化器。

紫外可见分光光度法题库(计算题)1. 浓度 0.0750mol/L Co(NO3)2溶液在 550nm 处的吸光度为 0.380。
在同一比色皿,相同波长下测得另一 Co(NO3)2溶液的吸光度为 0.260,试求该溶液的浓度。
答:A1 = εbc1 A2 = εbc2A2/A1 = c2/c1c2= (A2/A1)⋅c1 = (0.260/0.380)×0.0750 = 0.0513 mol/L2. 某化合物的最大吸收波长λmax= 280nm,光线通过该化合物的 1.0×10-5mol/L溶液时,透射比为 50%(用 2cm 吸收池),求该化合物在 280nm 处的摩尔吸收系数。
答:A = εbc , 而A = -lg Tε= -lg T/bc = -lg0.50/(1.0×10-5×2 )= 1.5×1043. 苯胺的λmax=280nm时, 其摩尔吸收系数ε=1430, 若采用1.0cm吸收池, 要制备透射比为30%的苯胺水溶液100mL需要多少克苯胺? [M(苯胺)为93]答:-lg(I/I0)=εbc已知b=1.0cm, ε=1430-lg(I/I0)=-lg0.30=0.52∴c=-lg(I/I0)/εb=0.52/(1430×1.0)=3.6×10-4mol/L故 93×3.6×10-4×100/1000=0.0034(g)即制备100mL溶液需要0.0034g苯胺。
4. 据报道, Pd与4,4'-双( 二甲基氨基 )硫代二苯甲酮的配合反应是测定Pd的最灵敏显色反应之一, 其摩尔吸收系数高达2.12×105L/(moL·cm)。
假定最小可测吸光度为0.001, 所用吸收池的光程为10cm, 问用分光光度法测定Pd的最低可能浓度是多少? 如果吸收池的容积为10mL,可以测定的最小质量Pd量是多少? [A r(Pd)为106.4]答:A=εbcc=A/bε=0.001/(10×2.12×105)=4.72×10-10mol/L106.4×4.72×10-10×10/1000=5.02×10-10g=0.502ng5. 0.500g钢样溶解后, 以Ag+作催化剂, 用过硫酸铵将试样中的Mn氧化成高锰酸根, 然后将试样稀释至250.0mL, 于540nm处, 用1.00cm吸收池测得吸光度为0.393。

硫酸亚铁铵容量法测定锰一、分析原理本方法适用于测定金属锰及含锰较高的合金。
在160℃至250℃磷酸溶液中,固体硝酸铵能定量地使锰氧化为三价,反应按下式进行:MnHPO4+2NH4NO3+H3PO4 =NH4MnH2(PO4)2+NH4NO2+HNO3+H2O过量的硝酸铵立即与产生的亚硝酸盐进行反应:NH4+ + NO2- = N2 + 2H2O使反应中生成的亚硝酸盐完全分解,而使二价锰氧化至三价锰的反应进行到底,钒也定量地参与反应,1%的钒相当于1.08%的锰。
但在金属锰和锰合金中不含钒。
故可以不必进行校正。
二、分析试剂1、磷酸2、盐酸:1+13、硝酸铵:固体4、硫酸亚铁铵标准溶液:0.150 0mol/L称取硫酸亚铁铵[(NH4)2Fe(SO4)2,6H2O]58.5克溶于1000ml,硫酸(5+95)中,用0.01500mol/l重铬酸钾溶液标定。
吸取重铬酸钾标准溶液25ml,加水约20 ml,硫酸(1+1)3 ml及磷酸(1+1)3 ml,指示剂2滴,用亚铁溶液滴定至亮绿色终点。
按下式计算亚铁标准溶液的摩尔浓度0.01500×25×6CFe(2-)= -----------------------VFe(2+)V=滴定时消耗的硫酸亚铁铵标准溶液的体积(ml);5、重铬酸钾标准溶液:0.01500mol/L称取重铬酸钾2.2067克溶于500 ml水中,摇匀。
6、指示剂溶液:称取苯代邻氨基苯甲酸0.2克,碳酸钠0.2克溶于100 ml热水中。
三、分析方法称取0.5000克试样于250 ml锥形瓶中,加入磷酸18ml,硝酸(1+1)5 ml,加热至微微冒磷酸白烟,立即加入固体硝酸铵1.2克左右(用牛角勺加一勺),不断摇动并吹去(用吸耳球)黄烟,此时锰氧化为三价,冷却至温热(50-60℃),加水30 ml,冷却。
用硫酸亚铁铵标准溶液滴定至浅红色,加指示剂5滴,继续滴定至黄绿色。

目录一.锰含量的检测 2 二.火焰原子吸收分光光度法测定镍、铁、铜、钙、镁、钠5三.比浊法测定硫酸根8 四.振实密度的检测9 五.粒度的检测10 六.比表面积的检测12二氧化锰化学分析方法适用范围:二氧化锰的主元素锰含量,杂质项目,硫酸根的检测。
一.锰含量的检测1 方法提要试样经盐酸分解,在磷酸介质中,加入硝酸铵将锰氧化成二价,以二苯胺磺酸钠溶液为指示剂,用硫酸亚铁铵标准溶液滴定,测得锰量。
2 试剂2.1盐酸 (1+1)(GR ) 2.2 硝酸 (AR ) 2.3 磷酸 (AR ) 2.4 硝酸铵 (AR ) 2.5 重铬酸钾标准溶液[C(61K 2Cr 2O 7)]=0.0500 mol/L ],称取1.2258 g 基准重铬酸钾(预先在150℃干燥2小时,并在干燥器中冷却至室温),置于50ml 烧杯中,加适量水溶解,移2.6 硫-磷混酸(15%-15%):预先配制好15%硫酸1L 和15%磷酸1L ,混匀,冷却。
2.7 二苯胺磺酸钠指示剂溶液(0.5%):称取0.5 g 二苯胺磺酸钠溶于100ml 水中混匀。
2.8 硫酸亚铁铵标准滴定溶液{C [(NH 4)2FeSO 4·6H 2O ≈0.0300 mol/L ]} 2.8.1 配制称取52.94 g 硫酸亚铁铵溶于4.5 L 硫酸(5+95)溶液中,混匀,临用前标定。
2.8.2 标定移取10.00 ml 重铬酸钾标准溶液(2.5)置于250 ml 锥形瓶中,加入15 ml 硫-磷混酸(2.6),用硫酸亚铁铵标准(2.8)滴定溶液滴定至橙黄色消失,滴加4滴二苯胺磺酸钠指示剂溶液(2.7),继续小心滴加至溶液刚呈绿色并保持30秒为终点,记录所消耗的硫酸亚铁铵标准滴定溶液的体积,求出硫酸亚铁铵标准滴定溶液相当于锰的滴定度。
同时做空白试验。
按下式计算滴定度: 014938.540500.000.10V V T Mn -⨯⨯=式中:T Mn/(NH4)2FeSO4-硫酸亚铁铵标准溶液对锰的滴定度(g/ml ) 10.00-移取的重铬酸钾标准溶液体积(ml ) 0.0500-重铬酸钾标准溶液的浓度(mol/L ) 54.938-锰的摩尔质量(g/mol )V 1-滴定时消耗硫酸亚铁铵标准溶液的体积(ml ) V 0-滴定空白时消耗硫酸亚铁铵标准溶液的体积(ml ) 3 分析步骤样品处理:分别称取1.0000g 试样于2个100ml 烧杯中,加少量蒸馏水润湿,盖上表面皿,沿杯壁缓慢加入盐酸(2.1)20ml ,加热溶解,浓缩至5ml 左右,取下冷却,用蒸馏水洗净表面皿及烧杯壁于烧杯中,将溶液转入100ml 容量瓶中,并稀释至刻度,摇匀。


工业四氧化三锰主含量测定方法工业四氧化三锰(Mn3O4)是一种重要的金属氧化物,其主要用途之一是作为锰盐的原料。
因此,正确测定工业四氧化三锰的主含量对于生产过程和产品质量的控制至关重要。
本文将介绍几种常用的测定工业四氧化三锰主含量的方法。
一、重量法重量法是一种直接测定工业四氧化三锰主含量的方法。
首先,称取一定质量的样品,然后进行煅烧除杂质。
接下来,在一定条件下,使用酸、碱或氧化剂将样品中的四氧化三锰转化为可溶性的锰化合物。
最后,通过一系列化学反应,转化为可以进行定量测定的锰离子,例如使用氧化锰(VII)作为滴定剂,测定溶液中锰离子的浓度。
二、显色滴定法显色滴定法是一种间接测定工业四氧化三锰主含量的方法。
首先,将工业四氧化三锰样品溶解在适当的溶剂中,然后添加特定试剂形成显色络合物。
例如,使用酸性溴酚蓝或乙酰丙酮等试剂,与工业四氧化三锰发生反应,形成显色的络合物。
然后使用氧化锰(VII)作为滴定剂滴定溶液,直到颜色发生明显变化,记录滴定消耗的体积。
由于显色滴定的终点是根据颜色的变化来判断的,因此需要进行标准曲线法来确定工业四氧化三锰的含量。
三、光度法光度法是一种通过测量样品溶液的吸收或透射光强度来间接测定工业四氧化三锰主含量的方法。
首先,将工业四氧化三锰样品溶解在适当的溶剂中,然后使用紫外-可见分光光度计或分光光度计测定样品溶液在一定波长范围内的吸光度。
根据光强与溶液中浓度的关系,可以计算工业四氧化三锰的主含量。
光度法需要先进行工业四氧化三锰溶解度的研究,以确定测量时的最佳溶解条件和波长。
总结起来,重量法、显色滴定法和光度法是常用的用于测定工业四氧化三锰主含量的方法。
根据实际情况,选择合适的方法来进行测定,可以提高测定的准确性和可靠性。
另外,由于工业四氧化三锰的检测方法较多,不同方法之间可能会存在一定的差异,因此需要进行方法验证和对比,并参考相关标准来确保测定结果的准确性。
铝矿石中锰、磷、钾、钠等氧化物的测定方法信息来源:全球铝业网更多信息请参考一、氧化锰高碘酸钾比色法在5%~15%硫酸介质中,用高碘酸钾作氧化剂,将二价锰(Mn2+)氧化成紫红色的高锰酸。
三价铁在硫酸介质中呈浅黄色,干扰测定。
可加入磷酸掩蔽消除其影响。
二价铁、硫化物、亚硝酸盐、溴化物、碘化物、氯化物、草酸盐以及其他还原性物质均干扰测定。
可用硝酸或硝酸-硫酸混合酸蒸发冒烟除去。
此时二价铁氧化为三价铁。
砷酸盐、硼酸盐、氟离子、高氯酸盐以及焦磷酸盐均不影响测定。
本法可测定0.005%~1%的锰。
(一)试剂磷酸1∶1。
高碘酸钾固体。
氧化锰标准溶液称取0.7745克电解金属锰,溶于100毫升3%的稀硫酸中,冷至室温。
移入1000毫升容量瓶中,用水稀释至刻度,摇匀。
此溶液1毫升含1毫克氧化锰。
移取上述溶液25毫升,置于500毫升容量瓶中,用水稀释至刻度,摇匀。
此溶液1毫升含50微克氧化锰。
(二)标准曲线的绘制取0、50、100150、200、……500微克氧化锰标准溶液,分别置于150毫升烧杯中。
加入1∶1磷酸5毫升,用水稀释至40毫升。
加入高碘酸钾0.3克,煮沸3~5分钟,待显色完全再保温10分钟,冷却至室温。
移入50毫升容量瓶中,用水稀释至刻度,摇匀。
在光电比色计上,用绿色滤光片(或选用波长530毫微米)测量其吸光度,并绘制标准曲线。
(三)分析手续吸取分离二氧化硅后的滤液25~50毫升,置于150毫升烧杯中。
加入硝酸1毫升,煮沸1~2分钟并蒸发至3~5毫升。
加入1∶1硫酸5毫升,继续加热蒸发至冒三氧化硫白烟以驱除氯离子和破坏动物胶(如溶液仍带黑色,可再加入硝酸反复蒸发,至动物胶完全破坏为止),取下冷却。
加入1∶1磷酸5毫升,加入30毫升水,于电热板上加热使盐类溶解,取下,加入高碘酸钾0.3克,以下按标准曲线手续进行。
式中:A-由标准曲线查得氧化锰的微克数;G-分取试样重(克)。
二、五氧化二磷磷钒钼黄比色法在5%硝酸溶液中,加入钒钼酸铵与磷生成磷钒钼黄色络合物进行比色。
一、实验目的1. 掌握化学分析方法中锰的测定原理。
2. 学会使用滴定分析法测定样品中锰的含量。
3. 培养实验操作技能和数据处理能力。
二、实验原理锰的测定采用氧化还原滴定法。
在酸性溶液中,高锰酸钾作为氧化剂,与还原剂硫酸亚铁反应,根据反应的化学计量关系,计算出样品中锰的含量。
反应方程式如下:2KMnO4 + 10FeSO4 + 8H2SO4 = K2SO4 + 5Fe2(SO4)3 + 2MnSO4 + 8H2O三、实验仪器与试剂1. 仪器:滴定管、移液管、锥形瓶、烧杯、玻璃棒、量筒、漏斗等。
2. 试剂:高锰酸钾标准溶液(0.01mol/L)、硫酸亚铁标准溶液(0.01mol/L)、硫酸(1:1)、硫酸铁铵指示剂、待测样品等。
四、实验步骤1. 准备工作:将待测样品溶解于适量的硫酸中,稀释至一定体积,备用。
2. 标准曲线绘制:(1)取6个锥形瓶,分别加入0.5ml、1.0ml、1.5ml、2.0ml、2.5ml、3.0ml的高锰酸钾标准溶液;(2)向每个锥形瓶中加入1ml硫酸铁铵指示剂,然后用硫酸亚铁标准溶液滴定至溶液由紫色变为浅绿色;(3)记录消耗的硫酸亚铁标准溶液体积,以高锰酸钾标准溶液体积为横坐标,消耗的硫酸亚铁标准溶液体积为纵坐标,绘制标准曲线。
3. 样品测定:(1)取3个锥形瓶,分别加入3.0ml、3.0ml、3.0ml的待测样品溶液;(2)向每个锥形瓶中加入1ml硫酸铁铵指示剂,然后用硫酸亚铁标准溶液滴定至溶液由紫色变为浅绿色;(3)记录消耗的硫酸亚铁标准溶液体积,从标准曲线上查出对应的锰含量。
五、数据处理1. 计算标准曲线的线性方程;2. 根据样品测定结果,计算出样品中锰的含量;3. 求出样品中锰的平均含量和标准偏差。
六、实验结果与分析1. 标准曲线的线性方程为:y = 0.0435x + 0.0032,相关系数R² = 0.9966。
2. 样品测定结果如下:(1)第一次测定:消耗硫酸亚铁标准溶液体积为22.50ml,样品中锰含量为0.0235g;(2)第二次测定:消耗硫酸亚铁标准溶液体积为22.00ml,样品中锰含量为0.0225g;(3)第三次测定:消耗硫酸亚铁标准溶液体积为21.50ml,样品中锰含量为0.0218g。
高碘酸钾氧化光度法测定炉渣中的氧化锰倪培洋;史玉奎【摘要】采用碳酸钠-硼酸混合熔剂熔融炉渣试样,代替盐酸、硝酸、硫酸冒烟溶解试样,酸浸后溶液于硫酸、磷酸介质中,在加热条件下,用高碘酸钾氧化二价锰为紫红色的高锰酸盐,以亚硝酸钠还原的同一被测溶液为参比,在波长530 nm处,测量其吸光度.实验表明,锰质量浓度在0~ 10 mg/L范围内符合比尔定律.本方法用于测定转炉渣和高炉渣中氧化锰,相对标准偏差分别为1.3%和4.5%(n=5).【期刊名称】《山东冶金》【年(卷),期】2018(040)001【总页数】3页(P51-53)【关键词】炉渣;氧化锰;高碘酸钾;光度法【作者】倪培洋;史玉奎【作者单位】石横特钢集团有限公司,山东肥城271612;石横特钢集团有限公司,山东肥城271612【正文语种】中文【中图分类】O657.31 前言钢铁冶炼过程中会产生副产物炉渣,由于冶炼性质和工艺的不同,炉渣又分为高炉渣和转炉渣等。
不同的炉渣组分和性质有较大的差异,分析不同的炉渣组分需要分别建立不同的分析方法[1]。
炉渣中的氧化锰含量对于冶炼工艺指导有重要意义,炉渣中氧化锰的测定一般有容量法、光度法和原子吸收法。
炉渣中氧化锰的分析常采用直接酸溶试样,硫酸冒烟处理[2]。
由于炉渣成分比较复杂,单纯酸溶样品不能保证试样溶解的完全性,又因二氧化硅含量较高,酸溶过程中极易出现硅酸脱水的现象,形成不溶性盐类,给过滤洗涤带来较大的干扰,以致实验过程繁琐,操作周期长,甚至有时会影响结果的准确性。
通过实验,建立了一种适用于转炉渣和高炉渣中氧化锰测定的通用方法,高碘酸钾氧化光度法。
试样用碳酸钠-硼酸混合熔剂直接熔融,热硫酸浸取制取母液来测定锰的含量。
该方法省去酸溶、硫酸冒烟、过滤分离的时间,快捷简便,结果满意。
2 实验部分2.1 主要仪器与试剂箱式电阻炉,温度适于控制在500~1 000℃的范围;7200型可见分光光度计。
碳酸钠-硼酸固体混合熔剂(2+1);硫酸(1+5);硫酸(1+1);磷酸(1+1);高碘酸钾(固体研细);亚硝酸钠溶液2%;脲溶液2%;锰标准溶液(1 mL含100.0μg锰),配制方法参照GB/T 6730.21—1986铁矿石化学分析方法高碘酸钾光度法测定锰量。
1第十章 紫外-可见吸光光度法习题1.是非判断题1-1物质的颜色是由于选择性地吸收了白光中的某些波长所致,VitB 12溶液呈现红色是由于它吸收了白光中是红色光波。
了白光中是红色光波。
1-2因为透射光和吸收光按一定比例混合而成白光,故称这两种光为互补色光。
因为透射光和吸收光按一定比例混合而成白光,故称这两种光为互补色光。
1-3有色物质溶液只能对可见光范围内的某段波长的光有吸收。
有色物质溶液只能对可见光范围内的某段波长的光有吸收。
1-4符合朗伯符合朗伯--比耳定律的某有色溶液的浓度越低,其透光率越小。
比耳定律的某有色溶液的浓度越低,其透光率越小。
1-5符合比耳定律的有色溶液稀释时,其最大吸收峰的波长位置不移动,但吸收峰降低。
1-6朗伯朗伯--比耳定律的物理意义是:比耳定律的物理意义是:当一束平行单色光通过均匀的有色溶液时,当一束平行单色光通过均匀的有色溶液时,当一束平行单色光通过均匀的有色溶液时,溶液是吸光度与吸溶液是吸光度与吸光物质是浓度和液层厚度的乘积成正比。
光物质是浓度和液层厚度的乘积成正比。
1-7在吸光光度法中,摩尔吸光系数的值随入射光的波长增加而减小。
在吸光光度法中,摩尔吸光系数的值随入射光的波长增加而减小。
1-8吸光系数与入射光波长及溶液浓度有关。
吸光系数与入射光波长及溶液浓度有关。
1-9有色溶液的透光度随着溶液浓度的增大而减小有色溶液的透光度随着溶液浓度的增大而减小,,所以透光度与溶液的浓度成反比关系。
所以透光度与溶液的浓度成反比关系。
1-10在吸光光度测定时,在吸光光度测定时,根据在测定条件下吸光度与浓度成正比的比耳定律的结论,根据在测定条件下吸光度与浓度成正比的比耳定律的结论,根据在测定条件下吸光度与浓度成正比的比耳定律的结论,被测溶液浓被测溶液浓度越大,吸光度也越大,测定结果也就越准确。
度越大,吸光度也越大,测定结果也就越准确。
1-11进行吸光光度法测定时,必须选择最大吸收波长的光作入射光。
实验五十试样中氧化锰含量的测定
【实验目的】
掌握分光光度法测定试样中微量锰的原理和方法。
【实验原理】
在酸性溶液中将Mn2+氧化成MnO4-是一个高灵敏度的特效反应,适用于MnO
含量在0.005~1.0%范围样品的测定;大于1%的可用原子吸收分光光度法测定。
高碘酸钾(钠)比色法是在硫酸-磷酸混酸存在下,加KIO4(或NaIO4)、(NH4 2S2O8和AgNO3混合显色剂,水浴加热将Mn2+氧化成紫红色的MnO4-:
2Mn2+ + 5IO4-+ 3H2O = 2MnO4-+ 5IO3-+ 6H+
采用标准曲线法可计算试样中MnO的含量。
【仪器和试剂】
1.仪器:刻度移液管、电炉、水浴锅、比色管。
2.试剂:显色剂混合液(5mL H2SO4加5mL H3PO4,用水稀释至100mL。
称取1g NaIO4于此混合酸中,微热溶解后,加0.5g过硫酸铵和0.05g硝酸银,搅拌使其溶解及混匀。
使用前配制)、锰标准溶液(100 µg·mL-1)(准确称取0.2186g MnSO4溶于水,加10mL 3mol·L-1H2SO4硫酸,用水定容于1000mL容量瓶中。
)
【实验步骤】
1.系列标准溶液的配制及显色
分别移取0、1.00、2.00、3.00、4.00、5.00mL锰标准溶液于50mL比色管中,加10mL显色剂混合液,沸水浴中加热20分钟,冷却后用水稀释至刻度,摇匀。
2.吸收曲线的绘制
在分光光度计上,用1 cm吸收池,以试剂空白溶液为参比,在480~580 nm之间,每隔10 nm测定一次4号锰标准溶液的吸光度A,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定锰的最大吸收波长。
(最大吸收波长525nm)
3.标准曲线的测绘
以试剂空白溶液为参比,用1 cm吸收池,在选定波长下测定2~6号各显色标准溶液的吸光度。
在坐标纸上,以锰的浓度为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
4.试样测定
移取适量已分解好的试液于25mL比色管中,加10mL显色剂混合液,沸水浴中加热20分钟,冷却后用水稀释至刻度,摇匀。
在相同条件下测量其吸光度。
【数据处理与结论】
计算试样中微量锰的质量浓度。
【注意事项】
显色通常在5~10%H2SO4或3 mol·L HNO3溶液中进行,酸度高显色不完全,酸度低则显色速度慢,加热可加快显色速度,一般煮沸5~7min,时间太长反而会使颜色消褪。
但只用KIO4为显色剂时,则需煮沸20~30min,显色后可稳定4h以上。
用(NH42S2O8时,需用AgNO3作催化剂。
【思考题】
工作曲线的绘制中,锰标准溶液浓度的选定依据是什么?。