蛋白质分选的基本途径与类型剖析
- 格式:ppt
- 大小:1.05 MB
- 文档页数:23

蛋白质的分选途径蛋白质是生物体中最重要的分子之一,它们在生命活动中扮演着重要的角色,包括催化、结构支持、运输、信号传递等。
因此,对于研究蛋白质的分选途径,不仅有助于理解生命活动的本质,还可以为新药物的研发提供重要的指导。
蛋白质的分选途径主要包括离子交换层析、凝胶过滤层析、亲和层析、透析、电泳、质谱等。
下面将分别介绍这些分选途径的原理和应用。
1.离子交换层析离子交换层析是蛋白质分选中最常用的方法之一。
其原理是利用离子交换树脂的特性,将带电的蛋白质分离出来。
离子交换树脂分为阳离子交换树脂和阴离子交换树脂两种。
阳离子交换树脂能吸附带负电的蛋白质,而阴离子交换树脂则能吸附带正电的蛋白质。
离子交换层析的应用范围十分广泛,可以用于分离各种蛋白质,例如血清蛋白、酶、激素等。
此外,离子交换层析还可以用于提纯蛋白质,去除杂质和有害物质,从而提高蛋白质的纯度。
2.凝胶过滤层析凝胶过滤层析是一种基于分子大小的蛋白质分选方法。
其原理是利用分子筛的特性,将大分子蛋白质滞留在分子筛中,而小分子蛋白质则通过分子筛。
分子筛的孔径大小可以根据需要进行调整,从而实现对不同分子大小的蛋白质的分离。
凝胶过滤层析的应用范围广泛,可以用于分离各种蛋白质,例如血清蛋白、酶、激素等。
此外,凝胶过滤层析还可以用于去除杂质和有害物质,从而提高蛋白质的纯度。
3.亲和层析亲和层析是一种基于分子亲和力的蛋白质分选方法。
其原理是利用某些化合物与特定蛋白质之间的亲和力,将目标蛋白质从混合物中分离出来。
亲和层析的化合物可以是抗体、配体、金属离子等。
亲和层析的应用范围也十分广泛,可以用于分离各种蛋白质,例如酶、激素、抗体等。
此外,亲和层析还可以用于提纯蛋白质,去除杂质和有害物质,从而提高蛋白质的纯度。
4.透析透析是一种基于分子大小的蛋白质分选方法。
其原理是利用半透膜的特性,将小分子物质从大分子物质中分离出来。
透析的半透膜可以是纸膜、凝胶、膜过滤器等。
透析的应用范围也十分广泛,可以用于去除杂质和有害物质,从而提高蛋白质的纯度。

细胞内蛋白质分选的基本途径
一、翻译后转运途径
翻译后转运途径是指蛋白质在完成多肽链的合成后,再通过特定的转运途径将其输送到细胞内指定位置。
这一途径主要涉及信号识别颗粒(SRP)的识别和核糖体与内质网之间的相互作用。
通过翻译后转运途径,细胞可以精确地控制蛋白质的合成和分选过程,以满足其特定需求。
二、共翻译转运途径
共翻译转运途径是指蛋白质在合成过程中即开始进行分选转运的途径。
该途径涉及信号肽的识别和引导,以及跨膜运输过程中的信号肽切除。
共翻译转运途径的主要特点是蛋白质在合成过程中就与转运相关的分子结合,从而引导其向特定方向进行转运和定位。
三、膜泡运输途径
膜泡运输途径是指蛋白质在合成过程中被包裹在膜泡内,通过一系列膜泡的转运和融合过程,最终将蛋白质运送到指定位置。
膜泡运输途径的主要特点是能够将蛋白质从粗面内质网合成部位转运至高尔基体,进而再转运至溶酶体、分泌泡等细胞内的不同部位。
四、门控转运途径
门控转运途径是指通过核孔复合体进行的选择性转运过程。
这一途径主要涉及细胞核内外蛋白质的合成与运输,特别是一些核质穿梭蛋白在细胞核与细胞质之间的运动。
门控转运途径对于维持细胞核的正常功能具有重要意义。
五、定位与锚定途径
定位与锚定途径是指蛋白质通过与细胞骨架系统的相互作用,实现其在细胞内的准确定位和锚定。
细胞骨架系统由微管、微丝和中间纤维构成,它们共同维持了细胞的形态并参与物质运输。
通过定位与锚定途径,蛋白质能够在特定的细胞区域发挥其功能,从而维持细胞的正常生理活动。


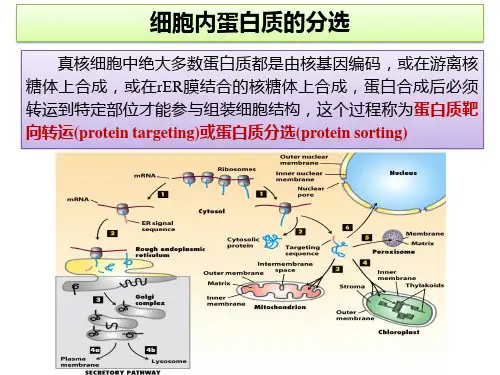
蛋⽩质分选(proteinsorting)信号、基本途径与类型学⽣的问题:核糖体合成的蛋⽩质如何转运到其它部位,特别是如何进⼊叶绿体和线粒体内?其实,这是就是蛋⽩质合成后的去路问题,属于蛋⽩质的分选。
蛋⽩质分选:依靠蛋⽩质⾃⾝信号序列,从蛋⽩质起始合成部位转运到其功能发挥部位的过程。
蛋⽩质分选不仅保证了蛋⽩质的正确定位,也保证了蛋⽩质的⽣物学活性。
与原核细胞不同的是真核细胞具有复杂的由内膜构成的功能区隔。
细胞内膜系统指在结构,功能或发⽣上相关的细胞内膜形成的细胞结构,包括核被膜、内质⽹、⾼尔基体及其形成的溶酶体和分泌泡等,以及其它细胞器如线粒体,质体和过氧化物酶体等膜包围的细胞器(膜性细胞器)。
内膜系统形成了⼀种胞内⽹络结构,其功能主要在于两个⽅⾯:其⼀是扩⼤膜的总⾯积,为酶提供附着的⽀架,如脂肪代谢、氧化磷酸化相关的酶都结合在细胞膜上。
其⼆是将细胞内部区分为不同的功能区域,保证各种⽣化反应所需的独特的环境。
细胞内合成的蛋⽩质、脂类等物质之所以能够定向的转运到特定的细胞器取决于两个⽅⾯:其⼀是蛋⽩质中包含特殊的信号序列,其⼆是细胞器上具特定的信号识别装置,因此内膜系统的发⽣具有核外遗传的特性。
⼀、蛋⽩质分选信号细胞类⾄少存在两类蛋⽩质分选的信号。
①信号序列(signal sequence):存在于蛋⽩质⼀级结构上的线性序列,通常15-60个氨基酸残基,有些信号序列在完成蛋⽩质的定向转移后被信号肽酶(signal peptidase)切除.②信号斑(signal patch):存在于完成折叠的蛋⽩质中,构成信号斑的信号序列之间可以不相邻,折叠在⼀起构成蛋⽩质分选的信号。
蛋⽩质分选信号的作⽤是引导蛋⽩质从胞质溶胶进⼊内质⽹、线粒体、叶绿体和过氧化物酶体,也可以引导蛋⽩质从细胞核进⼊细胞质或从Golgi体进⼊内质⽹。
这种分选信号的氨基酸残基有时呈线性排列,有时折叠成信号斑,如引导蛋⽩质定向运输到溶酶体的信号斑,是溶酶体酸性⽔解酶被⾼尔基体选择性加⼯的标识。



简述蛋白分选的基本途径,并具体说明蛋白分选是生物分析中被广泛应用的一种方法,旨在从一种物质中获取细胞内的蛋白质。
蛋白分选的核心技术理论在化学和生物学领域都有广泛的应用,其中包括分子生物学、蛋白质组学、心血管疾病的分析和突变基因的鉴定等,对于系统性地了解蛋白质的特性、功能及其与疾病发生发展之间的关系起到至关重要的作用。
蛋白质分选的基本途径主要有几类,包括物理法、化学法、生物识别法和仪器分析法。
一、物理法物理法一般指根据特定蛋白质在分子量、电荷等物理性质的不同,采取离心分离、电泳分离、色谱分离、光谱聚焦法等方法进行分离。
离心分离是根据蛋白质的不同分子量,利用离心力来进行分离的方法。
这种方法利用离心力分离出蛋白质,分离的结果取决于凝胶的粒径,并且能够有效地分离出分子量较大和较小的蛋白质。
电泳分离是根据蛋白质的不同电荷,利用离子膜电场将蛋白质向外移动,在长时间的电场中实现分离的方法。
这种方法利用蛋白质的电性质进行分离,分离的结果取决于离子膜的选择和电场的强度,因此能够有效地分离出电荷不同的蛋白质。
色谱分离是根据蛋白质的结构及其相对极性,利用溶剂系统和柱层析等方法进行分离的方法。
这种方法能够利用不同结构蛋白质之间的相对极性,有效地分离出各种蛋白质。
光谱聚焦法是基于蛋白质在透明介质中的吸收特性,利用蛋白质在空间上的分布状态实现分离的方法。
这种方法利用蛋白质在空间上的分布状态,有效地分离出蛋白质,并且能够获得蛋白质纯度较高的结果。
二、化学法化学法一般指利用抗原特异性的化学键,根据不同蛋白质的抗原特性,利用具有特异性的化学试剂实现分离的方法。
常用的化学分离方法有凝胶定向溶解、硫酸沉淀、抗原捕合法和核酸静电粘附法等。
凝胶定向溶解是利用不同酶将某一蛋白质从溶液中溶解出来,从而分离出其他蛋白质进行分离的方法。
这种方法利用特定的酶将某一蛋白质从溶液中溶解出来,从而分离出其他蛋白质进行分离。
硫酸沉淀是利用某种蛋白质的活性受特定酶抑制而沉淀在溶液中,并未受到其他蛋白质的影响实现分离的一种方法。

蛋白质分选转运的基本类型蛋白质分选转运是细胞内的一个重要过程,确保蛋白质能够在正确的时间和位置发挥其功能。
在这个过程中,蛋白质会通过特定的信号序列被识别并被运输到细胞的不同位置。
蛋白质分选转运的基本类型包括胞外分泌、内质网转运、线粒体转运和泛素化降解。
本文将逐步介绍这些基本类型。
首先,胞外分泌是蛋白质分选转运的一种基本类型。
在细胞合成蛋白质时,一些蛋白质会被转运到细胞膜上,并通过胞外分泌途径释放到细胞外。
胞外分泌蛋白质通常具有信号序列,这些序列可以被细胞的高尔基体识别并进行正确的转运。
一旦到达细胞膜,这些蛋白质会通过膜蛋白的介导而被释放到胞外环境中。
其次,内质网转运是蛋白质分选转运的另一种基本类型。
内质网是一个具有平滑和粗糙部分的细胞器,它在蛋白质合成和分选过程中起着重要作用。
在内质网转运中,蛋白质会被合成并传送到内质网的腔室中。
在腔室内,蛋白质会进行折叠、糖基化和修饰等过程。
然后,这些蛋白质会经过内质网的质量控制机制的筛选,检查是否出现异常结构或错误折叠的蛋白质。
如果通过筛选,蛋白质将进一步转运到细胞的其他位置。
第三,线粒体转运是蛋白质分选转运的另一个重要类型。
线粒体是细胞内的能量制造中心,需要多种蛋白质来保持其正常功能。
在线粒体转运过程中,蛋白质会具有线粒体定位信号,这些信号可以被线粒体的膜蛋白识别并将其导向正确的位置。
线粒体转运蛋白质可以穿越线粒体的外膜和内膜,并最终定位在线粒体的不同亚细胞区域。
最后,泛素化降解是蛋白质分选转运的最后一种基本类型。
泛素是一种小的蛋白质,可以与目标蛋白质结合,并通过一系列的酶反应形成泛素链。
这个泛素链会标记目标蛋白质,使其被泛素降解酶识别并降解。
泛素化降解在细胞内起着重要的质量控制作用,可以分解一些错误折叠、过期或异常蛋白质。

蛋白质分选途径蛋白质是生命体中最基本的组成部分之一,具有多种重要的功能。
为了研究和利用蛋白质,科学家们发展了多种蛋白质分选途径,以实现对蛋白质的高效分离和纯化。
本文将介绍几种常用的蛋白质分选途径,包括凝胶电泳、柱层析、亲和层析和质谱等。
一、凝胶电泳凝胶电泳是一种常见的蛋白质分选方法,主要通过蛋白质在电场中的迁移速度差异来实现分离。
凝胶电泳可以分为聚丙烯酰胺凝胶电泳(SDS-PAGE)和原位凝胶电泳两种。
在SDS-PAGE中,蛋白质被SDS(十二烷基硫酸钠)等电泳缓冲液中的阴离子表面活性剂包裹,使蛋白质带有负电荷,从而消除了蛋白质本身的电荷差异,仅依赖于蛋白质的分子量来分离。
原位凝胶电泳则是在聚丙烯酰胺凝胶中掺入SDS,使得蛋白质在电场中迁移时受到凝胶的限制,从而分离不同大小的蛋白质。
二、柱层析柱层析是一种基于蛋白质与柱填料之间的相互作用来实现分离的方法。
常见的柱填料包括离子交换层析、凝胶过滤层析、凝胶渗透层析和亲和层析等。
离子交换层析是利用蛋白质与填料上的固定离子交换作用来分离蛋白质,根据蛋白质的电荷差异进行分离。
凝胶过滤层析则是根据蛋白质的分子量差异进行分离,分子量较大的蛋白质无法进入填料的内部,从而被分离出来。
凝胶渗透层析则是基于蛋白质与填料之间的体积排斥作用来分离蛋白质。
亲和层析是利用蛋白质与填料上特定结构的亲和配体之间的结合作用来分离蛋白质。
三、质谱质谱是一种高效的蛋白质分选方法,主要基于蛋白质的质量-电荷比(m/z)来实现分析和分离。
质谱分为质谱仪和质谱分析两个步骤。
在质谱仪中,蛋白质被离子源转化为带电离子,然后进入质谱分析器,通过对离子的加速、分离和检测,得到蛋白质的质量-电荷比。
质谱分析主要包括质谱图的解析和蛋白质的鉴定。
质谱分析可以高效地分离蛋白质,且可以测定蛋白质的分子量、序列和修饰等信息。
总结蛋白质分选途径涵盖了凝胶电泳、柱层析、亲和层析和质谱等多种方法。
不同的方法适用于不同的研究目的和需求。
