离子共存的判断
- 格式:pptx
- 大小:152.04 KB
- 文档页数:6


离子能否大量共存的判断溶液中离子大量共存指离子浓度均相当大,若离子间发生反应使离子浓度有些降低,也就是离子不能大量共存。
下面是十条规律可作为离子不能大量共存的判断依据1 声称气体不能大量共存如:硫离子,硫氢根离子,亚硫酸根离子,亚硫酸氢根,碳酸根,碳酸氢根等离子都能和氢离子反应生成气体,故均不能和氢离子大量共存;而铵根和氢氧根易产生氨气,故二者也不能大量共存。
2 生成沉淀不能大量共存溶解性表中不溶或微溶物质的阴阳离子不能大量共存。
如:a 氢氧根和铁离子,亚铁离子,铜离子,锌离子,铝离子,镁离子,银离子,汞离子易发生难容的氢氧化物或氧化物而不能大量共存。
b 硫离子和亚铁离子,锌离子,铜离子,汞离子,银离子等易结合成难容的硫化物沉淀,不能共存c 银离子和氯离子,溴离子,碘离子会形成卤化银沉淀,不能共存。
d 镁离子,钙离子,钡离子,铅离子易和碳酸根,亚硫酸根,硫酸根,磷酸根生成难溶盐(硫酸镁除外)而不能共存;钙离子与氟离子,四氧化二镉不能共存;镁离子,钙离子与C17H35COO- 不能共存;镁离子,钙离子,钡离子与磷酸一氢根等不能大量共存。
e 氢离子与硅酸根,硫代硫酸根,偏铝酸易发生沉淀不能共存。
f 两种离子相遇能结合生成微溶物时,也不能大量共存。
如:钙离子与氢氧根离子,硫酸根;银离子与硫酸根;铅离子与氯离子;镁离子与碳酸根离子,亚硫酸根离子;汞离子与硫酸根离子等均不能大量共存。
3 生成难电离物质不能大量共存如:氢离子与氢氧根离子,氟离子,次氯酸根,碳酸根,硫离子,硫氢根离子,亚硫酸根离子,偏铝酸根离子,磷酸根,氢青根,硫青根,醋酸根,甲酸根,四氧化二镉等易结合成难电离弱电解质,因而不能大量共存。
4 发生双水解反应不能大量共存溶解性表中"-"符号对应的阴离子和阳离子绝大多数因发生双水解而不能大量共存。
因弱碱的阳离子水解呈酸性,弱酸阴离子水解呈碱性,两类离子在溶液中相遇因中和反应促进双水解强烈进行或不能共存。

判断溶液中离子能否大量共存方法:所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存.(1)生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-和OH-、OH-与Cu2+等不能大量共存.(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HSO3-、SO32-等不能大量共存.2.附加隐含条件的应用规律:(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等.(2)强碱性溶液中肯定不存在与OH-起反应的离子.(3)强酸性溶液中肯定不存在与H+起反应的离子.典型例题:[[例1]下列各组中的离子,能在溶液中大量共存的是:A.K+、Ag+、NO3-、Cl-B.Ba2+、Na+、CO32-、OH-C.Mg2+、Ba2+、OH-、NO3-D.H+、K+、CO32-、SO42-E.Al3+、Fe3+、SO42-、Cl-F.K+、H+、NH4+、OH-[分析]A组中:Ag++Cl-=AgCl↓B组中,Ba2++CO32-=BaCO3↓C组中,Mg2++2OH-=Mg(OH)2↓D组中,2H++CO32-=CO2↑+H2OE组中,各种离子能在溶液中大量共存。
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。
NH4++OH-=NH3·H2O或NH4++OH-=NH3↑+H2O答案:E[例2]在pH=1的无色透明溶液中,不能大量共存的离子组是:A.Al3+、Ag+、NO3-、Cl-B.Mg2+、NH4+、NO3-、Cl-C.Ba2+、K+、S2-、Cl-D.Zn2+、Na+、NO3-、SO42-[分析]题目给出两个重要条件:pH=1(即酸性和无色透明,并要求找出不能共存的离子组。

高中化学离子共存知识点总结8篇第1篇示例:高中化学离子共存知识点总结在高中化学学习过程中,离子共存是一个非常重要的知识点,涉及到化学反应的进行和产物的判断。
离子共存是指在溶液中同时存在两种或两种以上的离子。
在实际生活和实验中,离子通常是以离子固体的形式存在,通过溶解可以形成溶液。
1. 离子溶液的电导性离子是带有电荷的粒子,因此溶解在水中形成的离子固体在水中会形成带电的离子溶液。
带电的离子会导致溶液的电导性增加,其中离子的浓度越高,电导性越强。
通过电导实验可以判断离子是共存还是单独存在。
2. 离子溶液的化学反应离子在溶液中会发生各种化学反应,例如酸碱中和反应、氧化还原反应、络合反应等。
不同离子之间的反应会产生不同的化学物质,这些化学物质的性质和溶液中的离子有关。
3. 离子共存的判断在观察一种溶液时,如果存在多种离子,则需要通过化学实验鉴定其中所含的离子种类。
通常使用的方法有析出法、沉淀法、鉴定法等。
通过这些方法可以准确地判断出溶液中所含的离子种类。
4. 常见的离子共存情况常见的离子共存情况有氯离子和硫酸根离子、氯离子和硝酸根离子、氢氧化物离子和硫酸根离子等。
这些共存情况在化学实验和生活中都有一定的应用,需要我们进行仔细的观察和分析。
5. 离子溶液的应用离子共存的知识在化学实验和工业生产中有着广泛的应用。
比如在水处理中,需要判断水中离子的种类和浓度,以确定水质的好坏;在矿产资源开发中,也需要通过分析离子种类来选择合适的提取方法等。
离子共存是化学学习中的一个重要知识点,需要我们掌握好离子的性质、化学反应和鉴定方法,才能更好地进行化学实验和问题解决。
希望以上内容对大家有所帮助,希望大家能够在学习中加深对离子共存知识的理解。
【文章字数已达上限,如需更多知识请继续咨询。
】第2篇示例:高中化学离子共存知识点总结在高中化学学习中,离子共存是一个重要的知识点。
离子是带电的原子或者分子,当两种或两种以上的离子在一起时,就会形成离子共存。
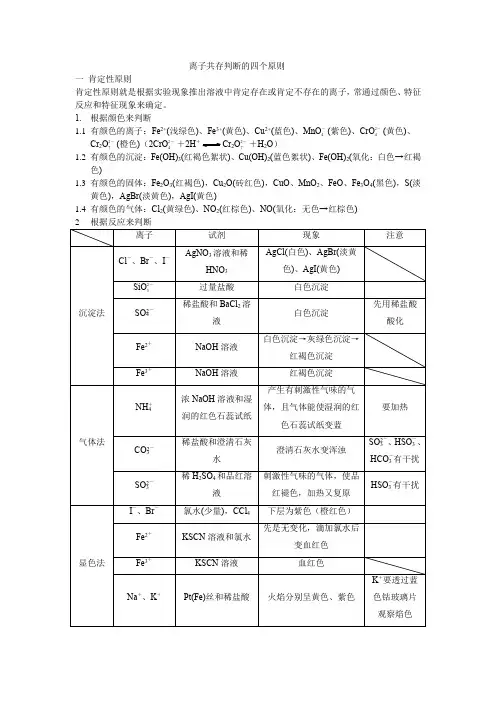
离子共存判断的四个原则一肯定性原则肯定性原则就是根据实验现象推出溶液中肯定存在或肯定不存在的离子,常通过颜色、特征反应和特征现象来确定。
1. 根据颜色来判断1.1有颜色的离子:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO-4(紫色)、CrO2-4(黄色)、Cr2O2-7(橙色)(2CrO2-4+2H+Cr2O2-7+H2O)1.2有颜色的沉淀:Fe(OH)3(红褐色絮状)、Cu(OH)2(蓝色絮状)、Fe(OH)2(氧化:白色→红褐色)1.3有颜色的固体:Fe2O3(红褐色),Cu2O(砖红色),CuO、MnO2、FeO、Fe3O4(黑色),S(淡黄色),AgBr(淡黄色),AgI(黄色)1.4有颜色的气体:Cl2(黄绿色)、NO2(红棕色)、NO(氧化:无色→红棕色)二互斥性原则互斥性原则是指在肯定某些离子的同时,结合离子共存规律(复分解反应、氧化还原反应的规律),否定一些离子的存在。
1根据溶液的酸碱性1.1强酸性溶液(非盐类水解)中不能共存:CH3COO-、F-、CO2-3/HCO-3、SO2-3/HSO-3、SiO2-3、ClO-、S2-(弱酸根)1.2强酸性溶液(非盐类水解)中不能共存:NH+4、Mg2+~Ag+、酸式根(HCO-3、HSO-3)溶液中隐含的酸碱性:①常温下,水电离产生的c(H+)= 1.0×10-12mol·L-1,则要注意溶液的pH可能为2或者12②与Al反应放出氢气的溶液,该溶液可能是酸性或强碱性③使酸碱指示剂变色,熟记常见指示剂变色范围:甲基橙:3.1~4.4(红、橙、黄)酚酞8.2~10.0(无色、粉、红)石蕊 5.0~8.2(红、紫、蓝)④常温下,c(H+)c(OH—)=10-a,若10-a>1则溶液呈酸性,若10-a<1则溶液呈碱性,当左右两边同乘以K w,c2(H+)=10-(a+14)2根据复分解反应不能大量共存K盐、Na盐和铵盐均可溶解;Fe2+、Fe3+、Cu2+、Mg2+与OH-、CO2-3、SO2-3、SiO2-3;Cl-只与Ag+不能共存;SO2-4只与Ba2+、Ag+、Ca2+不能大量共存;CO2-3、SO2-3只与K+、Na+、NH+4共存HCO-3、HSO-3不与会发生双水解的Fe2+、Fe3+、(Al3+)共存3三进出性原则进出性原则通常是在一些实验过程中应用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。

高中化学离子共存知识点总结8篇篇1一、离子共存的概念离子共存是指离子之间在一定的条件下,能够稳定地存在于同一溶液中,不会发生化学反应或沉淀现象。
在高中化学中,离子共存是一个重要的知识点,涉及到离子之间的相互作用、溶液的酸碱性、氧化还原反应等多个方面。
二、离子共存的条件1. 无毒无害:离子共存的首要条件是离子之间不会发生化学反应或产生有毒有害物质。
2. 电性中和:溶液中的正负离子应保持电性中和,即正离子的电荷总数等于负离子的电荷总数。
3. 浓度适中:离子浓度过高或过低都会影响溶液的稳定性,因此需要在合适的浓度范围内。
4. 温度适宜:温度也是影响离子共存的重要因素,过高或过低的温度都会导致溶液中的离子不稳定。
三、常见的离子共存组合1. Na+、Cl-、H2O:这是最常见的离子共存组合,氯化钠溶于水后形成氯化钠溶液,其中钠离子和氯离子可以稳定共存。
2. Ba2+、SO42-、H2O:硫酸钡是一种难溶于水的白色沉淀物,因此硫酸根离子和钡离子不能共存于同一溶液中。
3. Fe3+、OH-、H2O:铁离子和氢氧根离子在溶液中会发生反应生成氢氧化铁沉淀,因此它们不能稳定共存。
4. MnO4-、Cl-、H2O:高锰酸根离子和氯离子在酸性溶液中会发生反应生成氯气和水,因此它们不能稳定共存。
四、影响离子共存的因素1. 溶液的酸碱性:溶液的酸碱性会影响离子的存在状态,例如铁离子在酸性溶液中可以稳定存在,但在碱性溶液中则会生成氢氧化铁沉淀。
2. 氧化还原反应:有些离子之间会发生氧化还原反应,导致溶液中的离子不稳定。
例如,高锰酸根离子和氯离子在酸性溶液中会发生反应生成氯气和水。
3. 盐效应:盐效应是指盐类物质溶解后对溶液中其他离子的影响。
例如,氯化铵溶于水后会产生铵根离子和氯离子,而铵根离子和氢氧根离子会发生反应生成氨气和水,导致溶液中的氢氧根离子浓度降低。
五、总结与归纳通过以上分析可以看出,高中化学中涉及的离子共存知识点较为广泛且深入。

离子能否共存的原因与判断方法(重点,难点,常考点!!!)判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存。
下面就离子能否共存的原因与判断方法归纳如下:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+不能大量共存。
④弱酸的酸式阴离子与H+或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:① Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;② Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③ NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。

离子共存与离子反应方程式的书写判断规律离子共存:(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。
女口CO2-、HCO、S2-、HS、SO2-、HSO等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CG-+ 2H= COf + HO HS+ H= HaST 等。
2、有沉淀生成。
如Ba2+、Ca2+、Mg+等不能与SQ2-、CO2-等大量共存,主要是由于Ba2++ CO2-= BaCOj、CaT+ SQ2-= CaSOj (微溶);Mg+、Al3+、Cu2+、Fe2+、尸03+等不能与OH大量共存是因为Cu2++ 2OH = Cu(OH)2 J, Fe3++ 3OH = Fe(OH)3 J 等;SiO s2-、AIO2-、辺2〜等不能与H大量共存是因为SiO s2-+ 2H+= H SiO 3 J、AIO2 + H + H2O= AI(OH)3 J、SO2- + 2H+ = SJ+ SQ T + H2O3、有弱电解质生成。
如OH、CIO、F-、CHCOO HCOO PQ3-、HP^-、H2PQ-等与H+不能大量共存,主要是由于OH + H+= H2O CHCOO H+= CHCOOl等; —些酸式弱酸根及NH+不能与OH大量共存是因为HCO + OH=CO2-+ H2Q HPQ-+ OH = PQ3-+ H2O NH++ OH=NH ・H 2。
等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如:AIO2、S、HS、CO、HCO、SO、HSQ、CIO、F-、CHCOQ HCOO PQ3-、SQ32-、C6H5Q等必须在碱性条件下才能在溶液中大量存在;Mg+、Al3+、C U2+、Fe2+、Fe3+、NH+等必须在酸性条件下才能在溶液中大量存在。
(二)、由于发生氧化还原反应,离子不能大量共存1、一般情况下,具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如I-、、S2-、HS和Fe3+不能大量共存是由于2I -+ 2Fe3+=I 2 + 2Fe2+、2Fe3++ S2-=SJ + 2Fe2+、2Fe3++ 3S2-=SJ+ 2Fe S J。

判断离子是否共存的几种情况:(1)发生复分解反应,离子不能大量共存。
①有气体产生如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存①具有较强还原性的离子不能与具有较强氧化性的离子大量共存如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O 不能共存;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。

离子能否大量共存问题的分析与判断判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。
下面讨论离子能否共存的原因与判断方法:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+ 大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:①Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;②Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。

离子能否大量共存的判断朱如平离子共存问题历来是高考特别关注的考点,而如何判断溶液中离子能否共存也是学生学习的一个难点。
通常在水溶液中能生成沉淀、生成弱电解质、生成气体、发生氧化还原反应的离子都不能大量共存。
对于离子能否大量共存,解题时可以从以下五个方面判断: 一、发生复分解反应1、离子间发生反应生成沉淀而不能大量共存。
常见的离子组有:+H 与--OH ;SiO 23与+2Mg 、+3Al 、+2Cu 、+2Fe 、+3Fe 等;-+Cl Ag 与、-Br 、-I ;-23CO 与+2Ca 、+2Ba 等;+-224Ba SO 与、+Ag 、+2Ca 等。
2、离子间发生反应生成弱电解质而不能大量共存。
常见的离子组有:-+OH H 与、-COO CH3、F -、-ClO 、-CN 等;+-4NH OH 与等。
3、离子间发生反应生成气体而不能大量共存。
常见的离子组有:-+23CO H 与、-3HCO 、-23SO 、-3HSO 、-2S 、-HS 等;+-4NH OH 与(加热)。
例1 (2005年江苏)某溶液既能溶解3)OH (Al ,又能溶解32SiO H ,在该溶液中可以大量共存的离子组是( )。
A. +K 、+Na 、-3HCO 、-3NOB. +Na 、-24SO 、-Cl 、-ClOC. +H 、+2Mg 、-24SO 、-3NOD. +Ag 、+K 、-3NO 、+Na解析:由题意可知,原溶液呈强碱性。
A 项中的-3HCO 、C 项+H 与+2Mg 、D 项中的+Ag 在碱性条件下都不能大量共存。
答案:B二、发生氧化还原反应离子间发生氧化还原反应而不能大量共存。
常见的离子组有:在酸性条件下,-4MnO 与+2Fe 、+--23Fe NO ,Cl 与、----2322322O S ,SO S ,S 与等;-+I Fe 3与、-2S 等。
例2 (2005年全国)在1pH =的溶液中,可以大量共存的离子组是( )。
离子共存的判定方法一.三审1.溶液有没有颜色Cu2+蓝色 Fe3+棕黄色 Fe2+浅绿色 MnO4-紫红色 Cr2O72-橙(红)色CrO42-(浅)黄色 Cr3+绿色2.溶液的酸碱性(注:H3O+等同于H+)①、OH-及弱酸根离子(如F-,CO32-,SO32-,S2-,CH3COO-)不能与H+大量共存②、H+及弱碱根离子(Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+,NH4+)不能与OH-大量共存③、弱酸酸式酸根离子(如HCO3-,HSO3-,HS-,HPO3-,H2PO4-)与H+或OH-均不能大量共存3.直接结合而不共存①、生成气体:CO32-,HCO3-,SO32-,HSO3-,S2-,HS-与H+②、生成沉淀:SiO32-与H+ (生成难溶性酸)Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+与OH- (生成难溶性碱)某些酸根和某些金属阳离子生成难溶或微溶性盐③、生成弱电解质:酸式弱酸根与OH-或H+(生成水或弱酸)稳定的弱酸根离子与H+(生成弱酸)铵根离子与OH- (生成弱碱)二:看1.是否发生复分解反应(生成难溶、难电离、挥发性物质)2.是否发生氧化还原反应Fe3+与I-,S2-,SO32-(在H+环境下,可抑制Fe3+水解)NO3-(H+)与I-,S2-,SO32-,Fe2+MnO4-(H+)与I-,S2-,SO32-,Br-,Fe2+,Cl-S2-(H+)与SO32-ClO-与I-,S2-,SO32-,Br-,Fe2+歧化反应:2H++S2O32-=S↓+SO2↑+H2O(产生无色气体和淡黄色沉淀)注:①HS-视同S2-,HSO3-视同SO32-②ClO-与I-,S2-,SO32-,Br-,Fe2+Fe3+与I-,S2-,SO32-不需要在H+环境下。
3.是否发生双水解反应①Al3+与S2-,(HS-),CO32-,(HCO3-),AlO2-,SiO32-②Fe3+与CO32-,(HCO3-),AlO2-,SiO32-③NH4+与AlO2-,SiO3注:[Al(OH)4]-相当于AlO2-+2H2O助记:硅酸根、偏铝酸根与铝铁铵碳酸根、碳酸氢根与铝铁硫离子、氢硫酸根只与铝(硅酸根离子,偏铝酸根离子与铝离子,铁离子,铵根离子碳酸根离子,碳酸氢根离子与铝离子,铁离子硫离子、氢硫酸根只与铝)4.是否发生络合反应Fe3+与SCN-,C6H5O-Ag+与NH3·H2O(NH4+, OH-)二.特例(强酸制弱酸)①AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-AlO2-+ HSO3-+H2O=Al(OH)3↓+SO32-②PO43-+H2PO4-=2HPO42-三.溶解性①碱:K+,Na+,Ba2+,NH4+碱可溶,Ca(OH)2只微溶,其它碱均不溶②盐钾、钠、铵、硝酸盐及所有磷酸二氢盐均可溶氯化物不溶氯化银硫酸盐不溶硫酸钡、铅(CaSO4,Ag2SO4微溶)碳酸盐、磷酸盐、硅酸盐、亚硫酸盐,只有钾、钠、铵才可溶(MgCO3微溶)硫化物(S2-)钾钠铵钙镁可溶③AgCl↓白色AgBr↓淡黄色 AgI↓黄色 Ag2S↓黑色FeS、CuS、 Cu2S均为黑色沉淀。
离子能否大量共存的判断1、离子是一种具有电荷的粒子,它们会互相吸引,因此共存可能是有限的。
2、当离子处于溶液中时,由于其空间分布的限制,电场中的离子难以持久存在,从而限制了它们的共存数量。
3、影响离子共存数量的重要因素是溶液中存在的其他物质。
离子受到溶液中其他离子的影响,它们可能会由于相互作用而形成聚合物,限制其共存的数量。
此外,一些复合物如蛋白质也可以与离子结合,从而降低溶液中离子的浓度。
4、共存的离子数量还受溶液pH值的影响。
当pH值变化时,它可能会改变离子间相互作用方式,从而减少离子共存的能力。
例如,当酸性溶液中的碳酸钙(CaCO3)和碳酸氢钠(NaHCO3)缓慢溶解时,它们会形成一种稳定的溶液,使溶液中离子的共存能力降低。
5、与离子共存的另一个主要因素是离子间可能存在的竞争关系。
由于离子的吸引力,它们之间存在一种竞争攻击的关系。
因此,当两种离子的浓度足够高时,就可能建立这种竞争关系,从而限制离子共存的数量。
6、温度也可能影响离子共存的数量。
高温下,溶液中离子的移动性较高,从而降低了它们在电场中的共存能力。
7、另一个控制离子共存数量的重要因素是溶液中的电导率。
由于相互作用,溶液中的离子可以构建一个紧密的电场结构,从而限制它们的共存数量。
当电场的力越强,离子的共存越少。
8、最后,溶质的物理性质也可能会影响离子共存的数量。
有些溶质会被吸附到离子的表面,增加离子间的表面张力,从而限制离子共存的数量。
总之,离子共存的数量取决于溶液中存在的其他物质、温度、pH值和电导率等多种因素,离子大量共存的可能性可能很有限。
溶液中离子大量共存问题巧判断几种离子在同一溶液中可以大量共存,是指离子之间不发生任何反应,若离子之间能发生反应,则不能共存。
本文就溶液中离子能否大量共存的判断方法作一简单的总结归纳.1.同一溶液中若离子符合以下任意一个条件就会发生离子反应,离子之间便不能大量共存⑴复分解反应①离子之间发生沉淀反应的不能大量共存.如Ba2+与SO42-、Ag+与I-、Ca2+与SO42-等.②离子之间可结合生成挥发性物质的不能大量共存.如CO32-与H+、S2-与H+、NH4+与OH-等.③离子之间可结合成弱电解质的不能大量共存。
如H+与OH-、H+与F-、稀溶液中的NH4+与OH-等.另外需要注意的是,弱酸的酸式酸根离子既不能与H+共存,也不能与OH-共存:HCO3- + H+ = H2O + CO2 ↑HCO3- + OH- = CO32-+ H2O⑵氧化还原反应有较强氧化性的离子和有较强还原性的离子不能大量共存于同一溶液中.如Fe3+ 与I- 、S2- , MnO4- 、ClO-、Cr2O72-、NO3-(H+)与I- 、S2-、SO32-、Fe2+等;又如在酸性条件下S2O32-、SO32-与S2-,ClO-、ClO3-与Cl-,MnO4-与Cl-也都不能大量共存.⑶双水解反应某些弱酸的酸根离子(包括酸式酸根离子)和弱碱的阳离子因会发生双水解反应而不能大量共存.如Al3+和CO32- 、HCO3- 、S2-、HS-、AlO2-、F-、SiO32-,Fe3+ 与ClO-、CO32- 、HCO3- 、AlO2-,AlO2-和Ag+、Al3+、Fe3+、NH4+等.⑷络合反应如Fe3+和SCN-,Fe3+和C6H5O- 等因会结合成络合物而不能大量共存.这里需注意的是,络离子与能破坏络离子的离子同样不能大量共存.如:Ag(NH3)2+ + 2H+ = Ag+ + 2NH4+Ag(NH3)2+ + I-=AgI↓ +2NH32.题设中有限制条件及隐含条件时,离子大量共存问题的判断方法⑴一色即溶液颜色.若限定无色溶液,则Fe3+ 、Fe2+、MnO4- 、Cu2+ 等有色离子不能存在.⑵二性即溶液的酸性和碱性.强酸性溶液中下列离子不能大量共存:OH-、SO32-、HSO3-、S2-、HS-、ClO-、CO32-、HCO3-、PO43-、HPO42-、H2PO4-、CH3COO-、F-、SiO32-、AlO2-等;强碱性溶液中下列离子不能大量共存:H+、Al3+、Ag+、NH4+、Fe3+ 、Fe2+、Cu2+、Mg2+、Zn2+、HCO3-、HS-、HPO42-、HSO3-、H2PO4-等.⑶三特殊即三种特殊的关系.①Al3+ 与HCO3- 不能大量共存:AlO2- + HCO3-+ H2O=Al(OH)3 ↓ + CO32-②“NO3- + H+ ”的组合有强氧化性,能与I- 、S2-、Fe2+等离子发生反应,且这一组合常常较为隐蔽,不易察觉.③NH4+与CO32-、CH3COO- ,Mg2+ 与HCO3- 等组合中,虽然两种离子都能通过水解相互促进,但总的水解程度却很小,因此它们在溶液中可以大量共存,不过需注意加热情况.⑷六隐含即指六种隐含情况.①题干中出现pH值.②加某指示剂时的颜色变化.③可与Al反应放出H2的溶液.④在水电离的C(H+)=1×10-13 mol·L-1的溶液中.⑤题干中有“可能”或“一定”等设问方式.⑥题设限定条件,如因发生氧化还原反应而不能共存.。
判断溶液中离子能否大量共存的规律离子共存问题历来是高考特别关注的考点,而如何判断溶液中离子能否共存也是学生学习的一个难点。
通常在水溶液中能生成沉淀、生成弱电解质、生成气体、发生氧化还原反应的离子都不能大量共存。
小编为大家整理了高中化学必修:判断溶液中离子能否大量共存的规律,希望同学们牢牢掌握。
多种离子能否大量共存于同一溶液中,归纳起来就是:一色,二性,三特殊,四反应。
1.一色--溶液颜色若限定无色溶液,则Cu2+,Fe2+,Fe3+,MnO4-等有色离子不能存在。
2.二性--溶液的酸,碱性⑴在强酸性溶液中,OH-及弱酸根阴离子(如CO32-,SO32-,S2-,CH3COO-等)不能大量存在。
⑵在强碱性溶液中,弱碱阳离子(如NH4+,Al3+,Mg2+,Fe3+等)不能大量存在。
⑶酸式弱酸根离子(如HCO3-,HSO3-,HS-)在强酸性或强碱性溶液中均不能大量存在。
3.三特殊--三种特殊情况⑴AlO2-与HCO3-不能大量共存:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-⑵“NO3-+H+”组合具有强氧化性,能与S2-,Fe2+,I-,SO32-等因发生氧化还原反应而不能大量共存⑶NH4+与CH3COO-,CO32-,Mg2+与HCO3-等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度很小,它们在溶液中能大量共存(加热就不同了)。
4.四反应--四种反应类型指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
⑴复分解反应如Ba2+与SO42-,NH4+与OH-,H+与CH3COO-等⑵氧化还原反应如Fe3+与I-,NO3-(H+)与Fe2+,MnO4-(H+)与Br-等⑶相互促进的水解反应如Al3+与HCO3-,Al3+与AlO2-等⑷络合反应如Fe3+与SCN-等。