有机化学第九章要点全解
- 格式:doc
- 大小:3.28 MB
- 文档页数:54

RCOOH..第九章 羧酸及其衍生物和取代酸(一COOH )官能团的化合物,一元饱和脂肪羧酸的通式为C n H 2n O 2 。
羧基中的羟基被其它原子或基团取代的产物称为羧酸衍生物(如酰卤、酸酐、酯、酰胺等),羧酸烃基上的氢原子被其他原子或基团取代的产物称为取代酸(如卤代酸、羟基酸、羰基酸、氨基酸等)。
羧酸是许多有机化合物氧化的最终产物,常以盐和酯的形式广泛存在于自然界,许多羧酸在生物体的代谢过程中起着重要作用。
羧酸对于人们的日常生活非常重要,也是重要的化工原料和有机合成中间体。
§9-1 羧酸一、羧酸的结构、分类和命名 1、羧酸的结构在羧酸分子中,羧基碳原子是sp 2杂化的,其未参与杂化的p 轨道与一个氧原子的p 轨道形成C=O 中的π键,而羧基中羟基氧原子上的未共用电子对与羧基中的C=O 形成p -π共轭体系,从而使羟基氧原子上的电子向C=O 转移,结果使C=O 和C —O 的键长趋于平均化。
X 光衍射测定结果表明:甲酸分子中C=O 的键长(0.123 nm )比醛、酮分子中C=O 的键长(0.120nm )略长,而C —O 的键长(0.136nm )比醇分子中C —O 的键长(0.143nm )稍短。
RCOOH羧基上的p -π共轭示意图2、羧酸的分类和命名 2.1.羧酸的分类根据分子中烃基的结构,可把羧酸分为脂肪羧酸(饱和脂肪羧酸和不饱和脂肪羧酸)、脂环羧酸(饱和脂环羧酸和不饱和脂环羧酸)、芳香羧酸等;根据分子中羧基的数目,又可把羧酸分为一元羧酸、二元羧酸、多元羧酸等。
例如:或OOCOOcCOOHHOOC HOOC CH 2COOHCH 2COOHCH 2HOOC CH 3CH C H C OOHCOOH HOOC脂肪羧酸 一元羧酸 脂环羧酸 芳香羧酸二元羧酸多元羧酸2.2.羧酸的命名羧酸的命名方法有俗名和系统命名两种。
俗名是根据羧酸的最初来源的命名。
在下面的举例中,括号中的名称即为该羧酸的俗名。







第9章 重要的有机化合物第1节 认识有机化合物石油和煤 重要的烃考纲 考情三年20考 高考指数:★★★★★1.了解有机化合物中碳的成键特征,了解有机化合物的同分异构现象。
2.了解甲烷、乙烯、苯等有机化合物的主要性质。
【知识梳理】一、有机化合物、甲烷及烷烃的结构和性质。
1.有机化合物:有机化合物是指含_______的化合物,仅含有_____两种元素的有机物称为烃。
2.甲烷的结构和性质: (1)组成和结构。
分子式电子式结构式空间构型CH 4(2)物理性质。
颜色 状态 溶解性 密度 _____气态___溶于水比空气 (3)化学性质。
①稳定性:与强酸、强碱和强氧化剂等一般不发生化学反应。
②燃烧反应:化学方程式为_____________________。
③取代反应:在光照条件下与Cl2发生取代反应,第一步反应的方程式为_________________________,继续反应依次又生成了二氯甲烷、三氯甲烷和四氯甲烷。
3.取代反应的概念:取代反应是指有机物分子里的某些原子或原子团被其他原子或原子团所_____的反应。
4.烷烃:(1)通式:______(n ≥1)。
(2)结构特点:每个碳原子都达到价键饱和。
①碳原子之间以碳碳_____结合成链状。
②剩余价键全部与_______结合。
(3)物理性质:随分子中碳原子数的增加,呈规律性的变化。
①常温下的状态由气态到液态到固态。
②熔沸点逐渐_____。
③密度逐渐_____。
(4)化学性质:类似甲烷,通常较稳定,在空气中能燃烧, 光照下与氯气发生取代反应。
如烷烃完全燃烧的通式为 ____________________________________。
【微点拨】(1)甲烷与氯气的取代反应是逐步进行的,反应过程中往往4步反应同时进行,得到的有机产物是混合物;所有有机产物都不溶于水,常温下,一氯甲烷是气体,其他三种均为液体。
(2)烷烃与Cl2的取代反应,每取代1 mol氢原子,需要消耗1 mol Cl2。




第九章有机化合物第一讲认识有机化合物——主要的烃考点1主要烃的结构和性质一、有机化合物1.有机化合物:是指含碳元素的化合物,但含碳化合物CO、CO2、碳酸及碳酸盐属于无机物。
2.烃:仅含有碳、氢两种元素的有机物。
3.烷烃:碳原子与碳原子以单键构成链状,碳的其余价键全部被氢原子饱和,这种烃称为饱和链烃,也称为烷烃。
二、甲烷、乙烯和苯的结构与物理性质比较三、甲烷、乙烯和苯的化学性质比较下面从几种常见的有机反应类型角度认识三种主要烃:1.取代反应有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
(1)甲烷与Cl2的取代反应(2)苯的取代反应(填化学方程式)2.加成反应有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(1)乙烯的加成反应(填化学方程式)(2)苯的加成反应苯与H2发生加成反应的化学方程式3.加聚反应乙烯合成聚乙烯塑料的化学方程式为四、烷烃1.烷烃的结构与性质2.烷烃的习惯命名法(1)当碳原子数n≤10时,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示;当n>10时,用汉字数字表示。
(2)当碳原子数n相同时,用正、异、新来区别。
例如:CH3CH2CH2CH2CH3称为正戊烷,(CH3)2CHCH2CH3称为异戊烷,C(CH3)4称为新戊烷。
考点2同系物与同分异构体一、有机物中碳原子的成键特征1.碳原子的最外层有4个电子,可与其他原子形成4个共价键,而且碳碳原子之间也能相互形成共价键。
2.碳原子不仅可以形成单键,还可以形成双键或三键。
3.多个碳原子可以相互结合形成碳链,也可以形成碳环,碳链或碳环上还可以连有支链。
二、同系物1.定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。
2.烷烃同系物:分子式都符合C n H2n+2(n≥1),如CH4、CH3CH3、互为同系物。
3.同系物的化学性质相似,物理性质呈现一定的递变规律。
三、同分异构体1.概念:具有相同的分子式,不同结构的化合物互称为同分异构体。

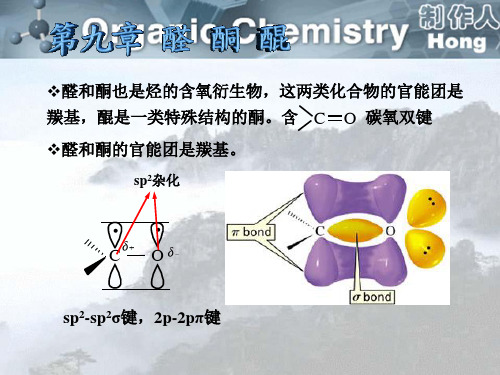
第九章醇、酚、醚的结构与性质前言(1) 醇的结构与性质醇分子可以看成是水分子中氢原子被烃基取代的产物或烃分子中氢原子被羟基(﹣OH)取代的产物。
和水分子一样,醇分子中氧原子也是sp3杂化的,sp3杂化的氧原子分别与烃基和氢形成2个σ键,还有两对孤电子对,在两个sp3杂化轨道上,因此醇分子不是直线型,而是角型的,所以醇分子是极性分子。
由于醇中含有羟基,分子间可以形成氢键,因此低级醇的熔点和沸点比分子量相近的碳氢化合物的熔点和沸点高得多。
随着分子量的增加,羟基在醇分子中比例减小,羟基对醇的影响减小,从而使高级醇的物理性质与烷烃近似。
低分子量的醇可以与水形成氢键而互溶。
羟基是醇的官能团,醇的化学性质也是由羟基引起的,主要是羟基的活性;羟基被取代的反应;羟基的氧化反应以及β﹣H的活性等。
(2) 酚的结构与性质酚羟基与芳羟基直接相连,羟基氧原子是sp2杂化的,还有一对孤电子在未杂化的p轨道上,p电子云正好能与苯环的大π键电子云发生侧面重叠,形成p-π共轭效应,其结果p电子云向苯环转移,而羟基氧氢之间的电子云向氧原子转移,使氢容易以离子形式离去,具有部分双键的性质,难以被取代,当氧原子电子云向苯环转移,使苯环电子云密度升高,因此苯环上发生亲电取代反应速度加快。
(3) 醚的结构与性质醚可以看作是水的两个氢原子被烃基取代所得的化合物。
氧原子也是 sp 3 杂化的,因此醚不是直线型结构,而是角形结构,醚是极性分子。
与醇相比,醚分子间不能形成氢键,沸点比同组分醇的沸点低得多,如乙醚沸点是34.6℃ ,而丁醇的沸点为117.8℃ 。
但是醚比分子量相近的烷烃分子的沸点高。
醚分子中的氧可与水形成氢键,所以醚在水中有一定溶解度,乙醚在水中溶解度为 8g/100ml ,对于环状醚,由于成环缘故,氧原子外突,形成氢键的能力较强,因此四氢呋喃, 1,4 ﹣二氧六环与水能混溶。
醚是一类相当不活泼的化合物(环醚除外),醚链对于碱,氧化物,还原剂都是十分稳定。



2598 含氮及杂环化合物内容提要本章主要讲述含C 、H 、O 、N 、X 等原子的化合物,着重阐述硝基化合物,胺类化合物以及胺的衍生物。
一些简单实用的杂环化合物也是本章学习的重点。
从结构上理解它们的性质,且掌握这些化合物的应用价值。
有机化合物除了含C 、H 外,还可含O 、N 、X 等杂原子。
前面讨论了含O ,X 的有机化合物,本章着重介绍有机含氮及杂环化合物。
前面章节中学过了腈、酰胺等含氮化合物,本章重点讨论硝基化合物、胺、季銨盐、重氮化合物、偶氮化合物和叠氮化合物。
它们的一般结构通式为:R-NO 2(Ar-NO 2) R-NH 2(Ar-NH 2) R 4N X ArN 2X(RN 2X) Ar-N=N-Ar(Ar')硝基化合物胺季銨盐类重氮化合物偶氮化合物由结构通式可知它们是不同氧化态的含氮有机物,因此,它们的性质和制备方法既有区别又有关联。
此外,本章还讨论C 与杂原子(如O 、N 、S)组成的环状化合物,即杂环化合物。
8.1 硝基化合物8.1.1 硝基化合物的命名和结构特征分子中含有硝基-NO 2的化合物称为硝基化合物,结构通式为:R-NO 2(Ar-NO 2)。
硝基化合物从结构上可看作烃的一个或多个氢原子被硝基取代的产物,可分为脂肪族硝基化合物和芳香族硝基化合物,脂肪族硝基化合物又可分为伯、仲、叔硝基化合物。
硝基化合物的命名类似于卤代烃,即以硝基为取代基命名,例如:CH 3NO 2CH 3CHCH 3NO 2CH 3O 2N硝基甲烷 2-硝基丙烷 对硝基甲苯在硝基化合物中,N 原子为sp 2杂化态,形成三个共平面的σ键,未参加杂化的具有一孤对电子的p 轨道与两个氧原子的p 轨道形成π43共轭体系。
两个N=O 键是等价的。
但习惯上写成R NO, 也有的写成R NO O 。
硝基甲烷分子的键长和键角为:H 3C N OC -N 147pm ,N -O 122pm ,∠ONO 为 127°两个N -O 键的键长相等,说明它们没有区别。
因此,硝基的结构可用共振结构式表示如下:N+OO N+O O硝基化合物的硝基中N 原子带正电荷,且N 原子的电负性(3.0)大于C 原子(2.5),故硝基的吸电子诱导效应(-I)大于羰基,因此,硝基化合物的α-H 的酸性强于羰基化合物的α-H 。
且硝基化合物α-H 以质子形式离去后形成的碳负离子由于硝基的强吸电子诱导效应(-I)和共轭效应(-C)稳定性明显提高,故能发生碳负离子的系列反应。
硝基中存在N=O双键,且N的氧化态在含氮有机化合物中最高,因此,硝基化合物能发生还原反应。
若硝基与芳环相连,则硝基的强吸电子-I和-C效应使芳环上电子云密度大大降低,不利于芳环上亲核取代反应。
应该注意的是,在硝基化合物中,C原子与N原子相连,它有一个异构体亚硝酸酯,其中C原子与O原子相连:R-NO2硝基化合物亚硝酸酯R O N O它们的结构不同导致化学性质不同,后者具有酯的性质。
例如,硝基化合物不能水解,而亚硝酸酯能被水解成醇(或酚)和亚硝酸(HONO):R ONO H2OROH + HONO硝基化合物还原成胺,而亚硝酸酯还原成醇:R-NO2 R ONO [H]R-NH2[H]ROH8.1.2 硝基化合物的物理性质脂肪族硝基化合物是无色而具有香味的液体,大部分芳香族硝基化合物都是淡黄色固体,有些一硝基化合物是液体,它们具有苦杏仁味。
硝基化合物的相对密度都大于1,不溶于水,而溶于有机溶剂。
多硝基化合物在受热时一般易分解而发生爆炸。
芳香族硝基化合物都有毒性。
在硝基化合物的红外光谱中,硝基的N-O不对称和对称伸缩振动吸收峰分别出现在1660~1500cm-1和1390~1260cm-1区域。
这是硝基化合物的特征谱带。
脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545cm-1和1385~1360cm-1,叔硝基化合物的N-O伸缩振动在1545~1530cm-1和1360~1340cm-1。
芳香族硝基化合物的N-O伸缩振动在1550~1510cm-1和1365~1335cm-1。
在1HNMR谱中,硝基的吸电子作用使邻近的质子的化学位移向低场移动。
芳香族硝基化合物中硝基使邻位氢的化学位移值增加0.95ppm,间位氢增加0.17ppm,对位氢增加约0.33ppm。
脂肪族硝基化合物中,α-H的化学位移值为4.3 ~ 4.6ppm,β-H的化学位移值为1.3~1.4ppm。
在质谱图中,芳香族硝基化合物有较强的分子离子峰,且出现有判断价值的[M - NO]+和[M – NO2]+离子峰。
脂肪族硝基化合物的分子离子峰很弱,主要碎片离子峰是烃基碎片引起的。
最大碎片峰为[M –NO2]+离子峰。
8.1.3 硝基化合物的化学性质伯、仲硝基化合物由于硝基强吸电子作用α-H较易离去形成较稳定的碳负离子,进而发生碳负离子的一些反应。
芳香族硝基化合物的硝基使其邻、对位电子云密度大大降低,使其邻、对位上取代基(例如卤原子)被其它亲核试剂取代。
硝基化合物是氮的氧化态最高的有机含氮化合物,能被还原为氮氧化态较低的化合物。
8.1.3.1α-H的酸性具有α-H的硝基化合物重要的化学性质之一是它的酸性。
例如CH3NO2(pKa=10.2),CH3CH2NO2(pKa=8.5),CH3CH2CH2NO2(pKa=7.8)都显示出足够的酸性,原因是α-H受到硝基的吸电子效应的影响。
硝基烷烃能跟NaOH作用生成盐:RCH2NO2 + NaOH[RCHNO2]Na+ + H2ORHC-NO2存在下列异构现象:RC-HN OORHC NOO-260261硝基烷烃的盐酸化后,生成一种不稳定的硝基烷烃异构体,具有强的酸性,称为氮酸(nitronic acid)。
硝基化合物在溶液中与氮酸存在动态平衡,故硝基化合物称为假酸式:RC -HNOORHC NOOH +RH 2CNOO 酸式 假酸式(硝基化合物)硝基化合物的酸式-假酸式互变显然与羰基化合物的酮式-烯醇式互变异构现象相似,不同的是,酸式氮酸存在的时间比烯醇式存在的时间要长一些。
8.1.3.2 还原硝基化合物是氮的氧化态最高的有机含氮化合物,能被多种还原剂还原。
硝基化合物被催化氢化(H 2/Ni)或在强酸性系统中被金属(如Fe ,Zn ,Sn)还原可生成伯胺。
例如:RNH 2H 2, NiRNO 2+ H 2ONO 2Fe/HClNH 2硝基苯在强酸性溶液中的还原反应中,金属的作用是提供电子,反应经过许多中间体,最后得到苯胺。
其还原过程如下:NOOPh+ H+NOHOPh +Ph 2N OPhH , 2eNOHPhH+NHPh HNOHHH 2e H 2OPhNH 2N HPh H +在弱酸性、中性或碱性溶液中,还原剂的还原能力降低,硝基苯还原为中间产物,如氧化偶氮苯,偶氮苯,氢化偶氮苯,N -苯基羟胺,亚硝基苯。
这些中间产物在一定条件下互相转化。
它们均被强还原剂(如Na + C 2H 5OH 或Fe + HCl 等)还原为苯胺:262NO2NaOH , As 2O 3, H 2ONH 2二硝基化合物可以被碱金属硫化物或多硫化物,NH 4HS 、(NH 4)2S 或多硫化铵选择性地还原一个硝基为氨基。
NO 2NO 242NH 2NO 28.1.3.3 与羰基化合物的缩合 第一和第二硝基化合物(都含有α-H 原子)在碱催化下,能与某些羰基化合物起缩合反应:O 2N CH 2CH 2OHOHCH 3NO 2CH 2NO 2HCHOOH 2 HCHOO 2N C(CH 2OH)3硝基烷烃负离子是一种亲核试剂,发生跟其它碳负离子一样的反应。
例如:CHO + CH 3NO 2CH NaOHCHNO 2(75%)(CH 3)2CHNO 2 + CH 2=CHCO 2CH (CH 3)2CCH 2CH 2CO 2CH 3PhCH 2N(CH 3)3OHNO 2(80~86%)8.1.3.4 和亚硝酸的反应第一硝基烷烃与亚硝酸作用,生成结晶的硝基肟酸:RCH 2NO 2 + HONOCNNO 2R OH硝基肟酸 红色NaOHCNNO 2R ONa产物硝基肟酸溶于NaOH 溶液中,得到红色的硝基肟酸钠盐溶液。
第二硝基烷烃与亚硝酸作用,生成结晶的N -亚硝基取代的硝基化合物:263R 2CHNO 2 + HONOR 2CNNO 2O产物溶于NaOH 溶液中,生成蓝色溶液。
第三硝基烷烃不与亚硝酸作用。
此反应可用来区别伯、仲、叔这三种硝基化合物。
8.1.3.5 硝基对芳香环上取代反应的影响 芳环上的氢原子被硝基取代后,由于硝基是强吸电子基,使苯环上的电子云密度降低,钝化苯环,不利于亲电试剂的进攻。
同时,硝基对苯环上的其它取代基也发生极大的影响。
(1) 硝基对卤素活泼性的影响氯苯在通常情况下,氯原子不能被-OH 取代,即使将氯苯与KOH 溶液煮沸数天也没有发现苯酚的生成。
但是,当氯苯的邻位和对位被硝基取代后,由于硝基的吸电子作用使与Cl 原子相连的C 原子上电子云密度大大降低,有利于亲核试剂的进攻,而容易发生苯环上的亲核取代反应:ClNO 23℃OHNO 2+ OHClNO 23OHNO 2+ OH22Cl23℃OHNO 2+ OH2O 2NO 2N2硝基越多,亲核取代反应越容易。
卤代硝基苯与其它亲核试剂(NH 3,RONa ,ROH 等)也易起亲核取代反应得到相应的取代产物,收率大于65%。
例如:FCl O 2NH NO 2NN(94%)O 2N OH KOHOO 2N(80~82%)NO 2ClN CCH 2CO 2C 2H 5O 2NNO 2HC O 2NCNC 2H 5OCO+++氟代苯不容易起亲核取代反应,但对硝基氟苯中的氟容易被亲核试剂所取代。
2643325℃, 93%FNO 2OCH 3NO 2一些其它的强吸电子基也能起到硝基的作用,例如:F (96%)C(CH 3)2NHO CH 3N(CH 3)2CO CH 3+离去基团不只限于卤原子,也可以是-OR ,-NO 2,-CN 等离去基团。
因此,这类反应可用下列反应式表示:NO 2NuLNO 2NuL++式中 -L ,-Nu 在硝基的邻对位;-L 为-X ,-OR ,-NO 2等;-Nu 为-OH ,-SH ,ROH ,RONa ,胺,碳负离子等。
较详细的机理研究表明这类反应的速度与底物的浓度和亲核试剂的浓度成正比,可能是双分子反应,与亲核取代反应相似,是芳香环上的亲核取代反应。
1902年Meisenhemer 分离出了下列反应的中间产物,说明反应是分步进行的。
OEtNO 2O 2NNO 22,4,6-三硝基苯乙醚 深紫红色 2,4,6-三硝基苯甲醚OCH 3NO 2O 2NNO 2EtO OCH 3N -OO-NO 2O 2NEtOK这类深紫红色的盐称为Meisenhemer 络合物,其结构已被晶体结构分析和1HNMR 分析所证实。