氧化还原反应 非氧化还原反应
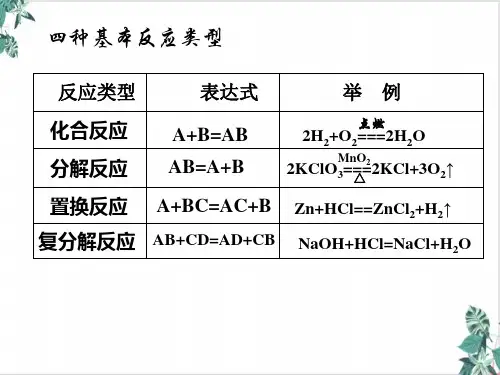
化学反应按照不同的分类方法可以分为不同 的反应,四大基本反应类型与氧化还原反应 什么关系?
随堂检测
1. 回答下列问题:
① CO2+C 高温 2CO ③ C+H2O(g) 高温 CO+H2 ⑤ CaCO3 高温 CaO+CO2↑
② CaO+H2O===Ca(OH)2 ④ 2H2O 电解 2H2↑+O2↑
00
2Na+Cl2
+1 -1
2NaCl
化合价降低,还原反应
化合价升降的原因:电子的得失
三、从电子转移的角度认识氧化还原反应
微观探析:以H2与Cl2反应为例
H +1 1
都可得1个e-
Cl +17 2 8 7
化合价升高,氧化反应
共用电子对
00
H2+Cl2
点燃
+1 -1
2HCl
化合价降低,还反应
化合价升降的原因:共用电 子对的偏移(偏离或偏向)
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2Cu+O2
2CuO
➢ 铜: 得__到__氧变成了氧化铜,发生 氧___化_反应,被氧气_氧___化。
一、从得失氧的角度认识氧化还原反应
根据初中学过的氧化反应和还原反应的知识,分析以下反应:
得到氧
2CuO+H2
还原反应
化合价升高
0 +2
Fe+ CuSO4
+2
0
FeSO4+Cu
化合价降低 ➢ Fe元素:化合价升高,发生氧化反应,被氧化。
➢ Cu元素:化合价降低,发生还原反应,被还原。 虽没有物质得氧、失氧,但反应前后却有元素化合价的变化。