恩利生产工艺及药代动力学
- 格式:pptx
- 大小:6.11 MB
- 文档页数:55

单抗药生产流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!单抗是一种能够识别特定抗原并与之结合的单克隆抗体。
它们被广泛应用于医学领域,特别是在治疗疾病方面取得了显著成就。

注射用依那西普说明书注射用依那西普用于类风湿关节炎(RA):中度至重度活动性类风湿关节炎的成年患者对包括甲氨蝶呤(如果不禁忌使用)在内的DMARD(改善病情的抗风湿药)无效时,可用依那西普与甲氨蝶呤联用治疗。
下面是店铺整理的注射用依那西普说明书,欢迎阅读。
注射用依那西普商品介绍通用名:注射用依那西普生产厂家: 德国Boehringer Ingelheim Pharma批准文号:国药准字H20080557药品规格:25mg/瓶×2瓶/盒药品价格:¥0元注射用依那西普说明书【药品名称】通用名称:注射用依那西普商品名称:恩利英文名称:Enbrel (Etanercept for Injection)【成份】主要成份:依那西普辅料:甘露醇、蔗糖和氨丁三醇(Tris)。
【性状】白色冻干粉。
溶剂为澄清、无色液体。
【适应症】类风湿关节炎(RA):中度至重度活动性类风湿关节炎的成年患者对包括甲氨蝶呤(如果不禁忌使用)在内的DMARD(改善病情的抗风湿药)无效时,可用依那西普与甲氨蝶呤联用治疗。
已证实依那西普单独使用或与甲氨蝶呤联用时,可降低X线检测相的关节损害进展率,并改善关节功能。
强直性脊柱炎(AS):重度活动性强直性脊柱炎的成年患者对常规治疗无效时可使用依那西普治疗。
【用法用量】恩利需在有诊断和治疗类风湿关节炎和强直性脊柱炎经验的专科医生的指导下使用。
尚未进行药物相容性研究,禁止将依那西普与其他药物混合使用。
成人(18-64岁):类风湿关节炎:推荐剂量为25mg每周二次(间隔72-96小时)或50mg每周一次,已证实50mg每周一次的给药方案是安全有效的(参见药理毒理部分)。
强直性脊柱炎:推荐剂量为25mg每周二次(间隔72-96小时)或50mg每周一次。
老年患者(>65岁):无需进行剂量调整。
用法用量与18-64岁的成人相同。
肝肾功能损害的患者:无需进行剂量调整。
注射部位:恩利的注射部位为大腿、腹部和上臂,注射方式为皮下注射。

X医学院药学院20XX届药学本科学位开题报告奥昔布宁透皮贴剂单次给药人体药代动力学研究学生:年级:专业:药学指导教师:实习单位:1、研究背景:1.1药物背景本品中主药成分为奥昔布宁,结构式:分子式:C22H31NO3分子量:357.49本试验用药品通用名为奥昔布宁透皮贴剂,英文名Oxybutynin Transdermal Patch,汉语拼音Aoxibuning Toupi Tieji,本品的规格为36mg/39cm2。
一周两贴。
临床用于治疗带有急迫性尿失禁、尿急和尿频症状的膀胱过度活动症。
奥昔布宁透皮贴剂由美国Watson Pharmaceuticals,Inc公司研制开发,2003年2月美国FDA 批准上市,用于治疗带有急迫性尿失禁、尿急和尿频症状的膀胱过度活动症(OAB)。
因国外已有奥昔布宁透皮贴剂上市,国内已有奥昔布宁口服制剂上市。
本品依我国《药品注册管理办法》规定,属化药新药3.3类。
奥昔布宁对平滑肌具有直接解痉作用,并能抑制乙酰胆碱对平滑肌的蕈毒碱作用。
可选择性作用于膀胱逼尿肌,降低膀胱内压,增加膀胱容量,减少不自主性的膀胱收缩而缓解尿急、尿频和尿失禁。
本品对家兔逼尿肌的抗胆碱能活性仅为阿托品的1/5,但解痉作用是阿托品的4-10倍。
对骨骼肌神经节和自主神经节无阻断作用。
奥昔布宁主要通过细胞色素P450酶系统,特别是CYP3A4代谢,它多数存在于肝中和肠壁上。
代谢物包括没有药理活性的苯基环己基乙醇酸和有药理活性的N-脱乙基奥昔布宁。
口服奥昔布宁,系统前首过代谢产生约6%的口服生物利用度和较高血药浓度的N-脱乙基奥昔布宁。
在口服5mg盐酸奥昔布宁单次给药试验中,代谢物N-脱乙基奥昔布宁的血药浓度AUC与母药血药浓度AUC的比率是11.9:1。
采用奥昔布宁经皮给药,可绕过胃肠和肝首过效应,减少N-脱乙基代谢物的生成。
由于皮肤中只有少量的CYP3A4存在,在经皮吸收中减少了系统前代谢。
结果在奥昔布宁透皮贴剂多次给药试验中,代谢物N-脱乙基奥昔布宁的血药浓度AUC与母药的血药浓度AUC比率是1.3:1。

学习II阿达木单抗注射液生物类似药临床试验设计考虑要点小编:当下,国内外生物类似药研发大热,2019年3月1日,CDE在其官网“电子刊物”项下刊发的由化药临床一部负责撰写的“阿达木单抗注射液生物类似药临床试验设计考虑要点”给处于研发热的生物类似药的企业,在制定其项目临床试验设计时,提供指导意义!我们一起来学习一下吧!阿达木单抗注射液生物类似药临床试验设计考虑要点一、概述阿达木单抗(Adalimumab)系在中国仓鼠卵巢细胞中表达的重组全人源化肿瘤坏死因子α(Tumor Necrosis Factor, TNFα)单克隆抗体注射液,由美国雅培公司研发上市,商品名为:修美乐®(Humira®)。
阿达木单抗在美国和欧盟已获批多个适应症[1,2],2010年首次获准进口中国。
目前在中国批准用于:①对改善病情抗风湿药(DMARDs),包括甲氨蝶呤疗效不佳的成年中重度活动性类风湿关节炎患者(RA);②常规治疗效果不佳的成年重度活动性强直性脊柱炎患者(AS);和③需要进行系统治疗的成年中重度慢性斑块状银屑病患者(Ps)。
[3](见表1)。
阿达木单抗注射液原研产品美国专利已于2016年到期,欧洲专利2018年即将到期[4],国内外制药企业已纷纷加入其生物类似药的研发。
Amgen研发的ABP501(Amgevita®/ Amjevita®)、BI研发的BI695501(Cyltezo®)、Samsung Bioepis研发的SB5(Imraldi®)和Sondoz研发的GP2017(Hyrimoz®)均已作为阿达木单抗的生物类似药在欧盟获批上市[5-8],其中的ABP501、BI695501和GP2017在美国也已按生物类似药获准上市[9-11]。
本文在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》[12](以下简称“指导原则”)基础上,结合阿达木单抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为国内阿达木单抗生物类似药的临床研发提供参考。

生物制药技术的步骤详解与操作指南生物制药技术是指利用生物学和生物化学原理研制和制造药品的过程。
它以微生物、动物细胞和植物细胞等作为生物反应器,通过合成、改造、提取和分离等工艺步骤,生产出各种具有药理活性的化合物。
本文将详细介绍生物制药技术的步骤以及操作指南。
1. 选择合适的生物生产系统:首先,需要根据所需药物的性质和目标产量选择适合的生物反应器。
常用的生物反应器包括细菌、酵母、真菌、植物和动物细胞等。
每种生物反应器都有其独特的生产要求和操作步骤。
2. 质粒构建和基因克隆:在生物制药技术中,常常需要将带有目标基因的质粒导入生物反应器中进行表达。
在这一步骤中,需要进行质粒的构建和基因的克隆。
通过采用PCR扩增、限制酶切、连接酶切等技术,可以将目标基因插入到合适的质粒载体中,并得到目标基因的重组质粒。
3. 选择适合的宿主细胞:在质粒构建和基因克隆完成后,需要选择适合的宿主细胞将重组质粒导入其中。
宿主细胞的选择要考虑生产能力、生长速度、易于培养和表达稳定性等因素。
常用的宿主细胞包括大肠杆菌、酵母、哺乳动物细胞等。
4. 转染和筛选:将重组质粒导入宿主细胞的过程称为转染。
转染可以通过热激、电穿孔、化学法等方式进行。
在转染完成后,还需要进行筛选来确认哪些细胞成功表达了目标基因。
常用的筛选方法包括抗生素筛选、基因标记筛选等。
5. 培养和表达:转染成功的宿主细胞需要进行培养和表达目标基因。
在培养过程中,需要提供适当的培养基和培养条件,如温度、pH值、搅拌速度等。
并且,需要监测培养过程中的生长速度、产物浓度、营养物质消耗等指标。
通过优化培养条件,可以提高产物的表达水平。
6. 收获和纯化:当目标基因的表达达到一定水平时,可以进行收获和纯化工艺。
收获过程包括细胞离心、固液分离、滤液处理等步骤。
纯化过程则包括固定相吸附、凝胶过滤、离子交换等步骤,以获得纯度较高的目标产物。
7. 制剂和质量控制:收获和纯化后的产物需要进行制剂,即将其制成适合药物使用的形式。
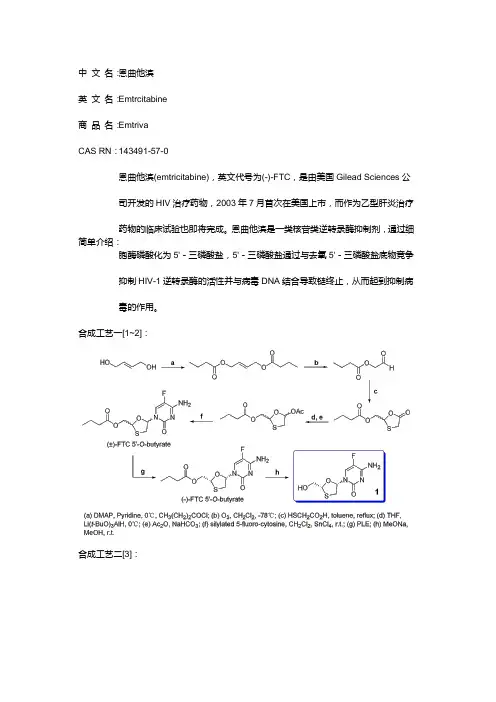
中文名:恩曲他滨英文名:E mtrcitabine商品名:E mtrivaCAS RN:143491-57-0恩曲他滨(emtricitabine),英文代号为(-)-FTC,是由美国Gilead Sciences公司开发的HIV治疗药物,2003年7月首次在美国上市,而作为乙型肝炎治疗药物的临床试验也即将完成。
恩曲他滨是一类核苷类逆转录酶抑制剂,通过细简单介绍:胞酶磷酸化为5'-三磷酸盐,5'-三磷酸盐通过与去氧5'-三磷酸盐底物竞争抑制HIV-1逆转录酶的活性并与病毒DNA结合导致链终止,从而起到抑制病毒的作用。
合成工艺一[1~2]:合成工艺二[3]:合成工艺三[4~7]:参考文献:(1) D. C. Liotta, R. F. Schinazi, W.-B. Choi. Antiviral activity and resolution of 2-hydroxymethyl-5-(5-fluorocvtosin-1-yl)-1,3-oxathioliane. WO 9214743, 1992.(2) D. C. Liotta, R. F. Schinazi, W.-B. Choi. Method of resolution and antiviral activity of 1,3-oxathiolane nucleoside enantiomers. US 6703396, 2004.(3) K. S. K. Murthy, S. E. Horne, G. V. Reddy, C. B. W. Senanayake, B. K.Radatus. 1,3-Oxathiolan-5-ones useful in the production of antiviralnucleoside analogues. US 6380388, 2002.(4) H. Jin, M. A. Siddiqui, C. A. Evans, H. L. A. Tse, T. S. Mansour.Diastereoselective synthesis of the Potent Antiviral Agent (-)-2'-Deoxy-3'-thiacytidine and Its Enantiomer. J Org Chem, 1995, 60, 2621-2623.(5) T. Mansour, H. Jin, A. H. L. Tse, M. A. Siddiqui. Intermediates in theSynthesis of 1,2-Oxathiolanyl Cytosine Nucleoside Analogues. US 5693787,1997.(6) T. Mansour, H. Jin, A. H. L. Tse, M. A. Siddiqui. Process for the Diastereoselective Synthesis of Nucleoside Analogues. US 5696254, 1997.(7) 宫平, 王立新, 吴秀静, 洪伟. (2R)-羟甲基-(5S)-(5'-氟胞嘧啶-1'-基)-1,3-氧硫杂环戊烷的合成. 中国药物化学杂志, 2002, 12, 34-36.。

化学药品注册分类及申报资料要求(试行)第一部分注册分类1、2、3、5.1类申报资料要求(试行)一、申报资料项目(一)概要1.药品名称。
2.证明性文件。
2.1注册分类1、2、3类证明性文件2.2注册分类5.1类证明性文件3.立题目的与依据。
4.自评估报告。
5.上市许可人信息。
6.原研药品信息。
7.药品说明书、起草说明及相关参考文献。
8. 包装、标签设计样稿。
(二)主要研究信息汇总表9. 药学研究信息汇总表。
10. 非临床研究信息汇总表。
11. 临床研究信息汇总表。
(三)药学研究资料12. (3.2.S)原料药(注:括号内为CTD格式的编号,以下同)。
12.1(3.2.S.1)基本信息12.2(3.2.S.2 )生产信息12.3(3.2.S.3 )特性鉴定12.4(3.2.S.4)原料药的质量控制12.5(3.2.S.5)对照品12.6(3.2.S.6)包装材料和容器12.7(3.2.S.7)稳定性13. (3.2.P)制剂。
13.1(3.2.P.1)剂型及产品组成13.2(3.2.P.2)产品开发13.3(3.2.P.3)生产13.4(3.2.P.4)原辅料的控制13.5(3.2.P.5)制剂的质量控制13.6(3.2.P.6)对照品13.7(3.2.P.7)稳定性(四)非临床研究资料14.非临床研究资料综述。
15.主要药效学试验资料及文献资料。
16.安全药理学的试验资料及文献资料。
17.单次给药毒性试验资料及文献资料。
18.重复给药毒性试验资料及文献资料。
19.遗传毒性试验资料及文献资料。
20.生殖毒性试验资料及文献资料。
21.致癌试验资料及文献资料。
22.依赖性试验资料及文献资料。
23.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料及文献资料。
24.其他安全性试验资料及文献资料。
25.非临床药代动力学试验资料及文献资料。
26.复方制剂中多种成分药效、毒性、药代动力学相互影响的试验资料及文献资料。

1 主题内容与适用范围本规程规定了104车间注射用阿洛西林钠生产过程中的工艺过程及条件,处方和依据,设备一览表及主要设备生产能力,技术安全、工艺卫生与劳动保护,技术经济指标的计算及消耗定额,包装要求与存贮管理,劳动组织与岗位定员,成品、半成品、原辅材料的质量标准和检验方法等内容。
本规程适用于104车间注射用阿洛西林钠生产操作及检查。
2 产品概述2.1 品名:注射用阿洛西林钠(Aziocillin Sodium for Injection)2.2 剂型:注射用无菌粉针剂2.3 性状:本品为白色或类白色粉末或疏松块状物2.4 规格:按C20H23N5O6S计1.0g;2.0g2.5 适应症:主要用于敏感的革兰阳性菌及阴性菌所致的各种感染以及铜绿假单胞菌感染,包括败血症、脑膜炎、心内膜炎、化脓性胸膜炎、腹膜炎及下呼吸道、胃肠道、胆道、泌尿道、骨及软组织和生殖器官等感染,妇科、产科感染,恶性外耳炎、烧伤、皮肤及手术感染等。
2.6 用法与用量:用法:加入适量5%葡萄糖氯化钠注射液或5-10%葡萄糖注射液中,静脉滴注。
用量:成人一日6-10g(1.0g:6-10支;2.0g:3-5支),严重病例可增至10-16 g(1.0g:10-16支;2.0g:5-8支),一般分2-4次滴注。
儿童按体重一次75mg/kg,婴儿及新生儿按体重一次100 mg/kg,分2-4次滴注。
2.7 贮藏:密闭,干燥处保存。
2.8 有效期:24个月2.9 生产批准文号:1.0 g:国药准字H20056300;2.0g:国药准字H20056301;3 生产工艺流程:4 工艺过程及工艺条件:4.1 西林瓶的处理4.1.1 工艺过程4.1.1.1 开车前,首先检查纯化水和注射用水质量、压力,压缩空气可见异物及压力是否符合工艺条件。
若符合准备生产。
4.1.1.2 上瓶将西林瓶上到理瓶台面,剔除废、次瓶后用推板将西林瓶推入洗瓶机转盘。
4.1.1.3 洗瓶瓶子由洗瓶机转盘送入超声波洗瓶机清洗槽,经超声波清洗西林瓶内外壁,然后进入翻瓶轨道经滤过纯化水、注射用水冲洗,压缩空气吹净后由传送带送入远红外隧道烘箱。


类风湿关节炎新药“恩利”依那西普 Infliximab 。
温馨提示: 依那西普内容仅供参考,实际诊断及用药请遵从医生指导,如为处方药请凭医生处方购买! 本店为零售药店,仅提供依那西普的零售服务! 依那西普说明书:药品名:依那西普(Etanercept)英文名:Infliximab 、Enbrel@(Amgen Inc 生产)、Remicade@(Centacor.Inc 生产).来源: 英利昔是利用重组DNA 和单克隆抗体技术制备的人源化的人鼠嵌合搞TNF α受体单抗.依那西普是完全由人Ig 生产的抗TNF α受体单抗.作用机制: 本品为二聚体融合蛋白,由人类75kD 肿瘤坏死因子(tumor necrosis factor, TNF)受体的细胞外配体结合部分和人类IgG1Fc 段连接而成.本品Fc 段含有GH2区、CH3区铰链区,但是不含有CH1区. 药品名依那西普 通用名 Infliximab 剂型 针剂规格生产厂家 Amgen Inc 生产)、Remicade@(Centacor.Inc 生产 批准文号参考价格 ¥0.00元单位 支近年来研究发现骨髓异常增生综合征(myelo-dysplastic syndrome, MDS)伴有程序化细胞死亡(凋亡)加速,并且这种细胞凋亡与过度表达TNFα有关.本品特异性地与TNFα受体结合,阻断TNFa与细胞表面TNFα受体的相互作用;此外,本品还可以调节TNFα诱导或者介导的生物学作用.药代动力学:1.吸收:单药25mg皮下注射.吸收较慢,平均69±34小时,达到血药峰浓度.每周两次,每次25mg皮下注射用药6个月后,平均血药浓度2.4±1.0 μg/ml.2.分布:无资料.3.半衰期:单药25mg皮下注射,清除率160±80ml/h.平均半衰期102±20小时.4.清除:经体内蛋白质降解途径清除.药物相互作用: 尚无相关资料.适应证: 治疗低危/中危MDS、难治性贫血(RA)期伴有TNFa升高的病例.单药有效率: 治疗MDS,有效率12.5%~30%.剂型: 无菌白色不含防腐剂的冻干粉,每支含有Enbrel25mg,D-甘露醇40mg,蔗糖10mg,氨丁三醇1.2mg.依那西普为无菌冻干粉,每支含Remicade100mg.剂量: 试验治疗MDS剂量(Remicade):3mg/kg静脉用药6次(第0、2、6、14、22、30周).Embrel,25mg皮下注射,每周2次,3个月为一疗程.给药途径: 皮下注射或者静脉点滴.配伍:本品不宜与其他药品混合使用并且不应使用注射用水以外的溶媒溶药.禁忌证:败血症患者、已知对Embrel和Remicade或者制剂中其他成分过敏的患者禁用.心衰患者、老年患者、孕妇、哺乳期妇女慎用.不良反应:1.注射部位局灶反应:红斑、痛痒、疼痛、肿胀、出血、瘀伤。

单抗药物的工艺和控制原则
单抗药物的工艺和控制原则主要包括以下几个方面:
1. 细胞培养:单抗药物的生产一般采用细胞培养技术,包括种子细胞的培养和发酵。
2. 发酵工艺控制:发酵过程中需要控制温度、pH值、氧气供应、营养物质的供应等参数,以促进细胞生长和抗体表达。
3. 细胞培养的感染和溶解:在细胞达到一定密度后,需要加入适量的病毒感染细胞,促使抗体的表达;之后进行细胞溶解,将获得的细胞提取物用于后续的纯化步骤。
4. 纯化过程:单抗药物的纯化过程一般包括离子交换、凝胶过滤、亲和层析、逆流层析等步骤,以去除杂质并获得纯净的单抗。
5. 稳定性和质量控制:单抗药物的生产过程中,需要对产品质量进行严格的控制,包括对单抗的活性、纯度、聚集态等进行检测,并进行稳定性研究,确保产品的质量和有效期。
6. 注射剂制剂工艺:对于将单抗药物作为注射剂进行使用的情况,还需要进行相应的制剂工艺开发和控制,包括溶解、稳定剂的选择和添加、灭菌等步骤。
综上所述,单抗药物的工艺和控制原则需要综合考虑细胞培养、发酵、纯化、质量控制和制剂工艺等多个方面的要素,并严格按照相关标准和规定进行操作,以确保生产出高质量的单抗药物。
生物制药的工艺流程方法及要求一、生物制药工艺流程的开端:原料获取。
1.1 原料的种类。
生物制药的原料那可真是多种多样啊。
就像从微生物里获取原料,像细菌啊、真菌啊,这些小家伙别看它们小,可都是宝贝。
还有从动植物身上取材的呢,比如说从某些植物里提取有药用价值的成分,或者从动物的脏器或者血液里找有用的东西。
这就好比在大自然这个大宝藏里“寻宝”一样,到处都是可能的财富。
1.2 原料获取的要求。
但是呢,获取这些原料可不是随随便便的。
首先得保证原料的纯净性,要是混进去了杂质,那就好比一锅好汤里掉进了一只苍蝇,全毁了。
对于微生物原料,要在合适的环境下培养,就像照顾娇嫩的小娃娃一样,温度、湿度、营养物质都得恰到好处。
从动植物获取原料的时候,也要遵循一定的伦理和法律规范,可不能乱来,那是要犯大错的。
二、生物制药的核心:生产过程。
2.1 发酵工程(微生物原料相关)如果是微生物原料,发酵工程就派上用场了。
把微生物放到专门的发酵罐里,这个发酵罐就像是微生物的“豪华公寓”。
在里面,微生物们欢快地生长繁殖,同时产生我们需要的药用成分。
这里面的条件控制那是相当严格的,差一点都不行。
比如说pH值,得像走钢丝一样小心翼翼地维持在合适的范围,不然微生物就会“闹脾气”,不好好工作了。
2.2 提取和纯化。
不管是微生物还是动植物原料,提取和纯化是很关键的步骤。
这就像从沙子里淘金一样,要把有用的东西从大量的原料里找出来并且弄干净。
要用各种物理和化学的方法,什么离心啊、过滤啊、层析啊,这些方法就像一把把神奇的梳子,把有用的成分梳理出来。
这个过程可不能粗心大意,得有“吹毛求疵”的态度,哪怕有一点点杂质没除掉,都可能影响药品的质量。
2.3 基因工程技术的应用。
现在基因工程在生物制药里也很常见。
就像给微生物或者细胞做个“基因手术”一样,让它们按照我们的要求生产特定的药物。
这个技术可高级了,但是操作起来也是困难重重。
就像在一个精密的钟表里摆弄小零件,一个不小心就可能前功尽弃。
纯化厂的生物制药工艺流程一、生物制药的开始:原料的获取。
生物制药的原料来源那可真是多种多样呢。
有些是从微生物里来的,像细菌或者真菌,这些小小的微生物可蕴含着大大的能量哦。
还有些原料是从动植物身上提取的,比如说从植物里提取一些特殊的成分,或者从动物的组织、器官或者血液里找到我们需要的东西。
不过呢,获取这些原料可不是随随便便的,要非常小心谨慎,就像照顾小宝贝一样。
要保证原料的质量和纯净度,这样才能为后面的制药流程打下良好的基础。
二、发酵或者培养。
如果原料是微生物的话,那发酵这个环节可就太重要啦。
就像是微生物们的一场盛大派对,我们把微生物放在特殊的环境里,给它们提供吃的喝的,也就是合适的营养物质和生长条件,让它们快快长大繁殖。
这个环境得控制得特别精准,温度呀、湿度呀、酸碱度呀,哪一个都不能马虎。
如果是从动植物细胞培养的话,也是类似的道理,要创造一个让细胞感觉很舒服的环境,这样它们才能茁壮成长,产生我们想要的那些生物活性物质。
三、初步分离。
等微生物或者细胞完成了它们的“使命”,接下来就是把我们想要的东西从它们的“大家庭”里分离出来啦。
这就好比从一堆宝藏里挑出最珍贵的那几颗宝石。
我们可能会用到过滤的方法,把那些大的杂质去掉,就像用筛子筛沙子一样,只留下我们需要的细细的“金沙”。
还有离心的方法呢,通过快速旋转,让不同密度的物质分层,我们要的东西就可以被初步的分离出来啦。
这个过程需要耐心和细心,要是不小心就可能把我们想要的东西给弄丢了一部分,那可就太可惜了。
四、纯化过程。
初步分离得到的东西还不够纯呢,这时候就进入到纯化的环节啦。
纯化就像是一场精细的雕琢,把我们的“璞玉”雕琢成最完美的“艺术品”。
可能会用到色谱技术,这就像是不同的小怪兽在不同的赛道上赛跑,我们想要的物质就会按照自己的速度在这个特殊的赛道上跑出来,这样就可以把它和其他杂质分开啦。
还有一些其他的纯化方法,像是离子交换之类的,通过物质的电荷特性来把杂质去除掉。