化学仿制药参比制剂目录(第三十六批)(征求意见稿)
- 格式:docx
- 大小:53.27 KB
- 文档页数:14


国家药监局关于发布仿制药参比制剂目录(第八十
批)的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2024.05.13
•【文号】国家药监局通告2024年第19号
•【施行日期】2024.05.13
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药监局通告
2024年第19号
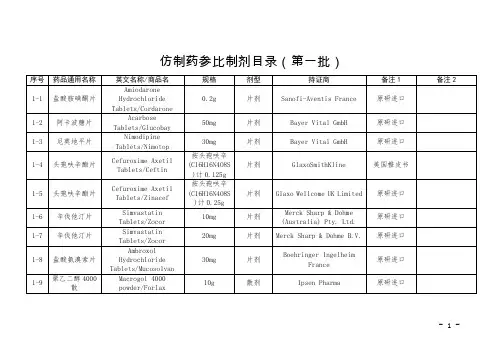
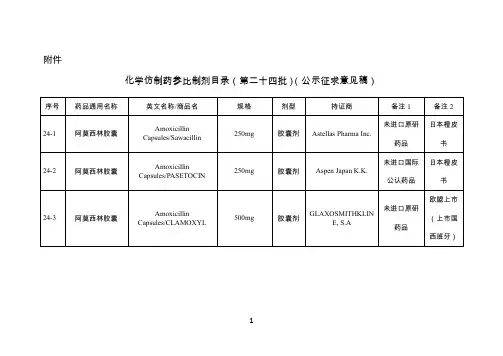
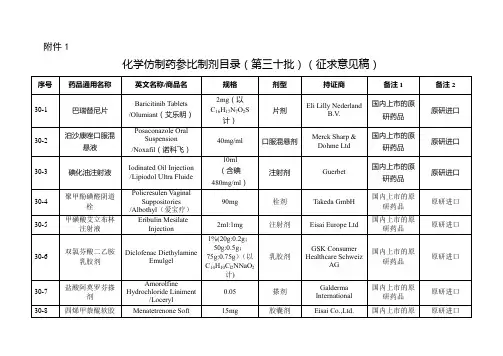
关于发布仿制药参比制剂目录(第八十批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第八十批)。
特此通告。
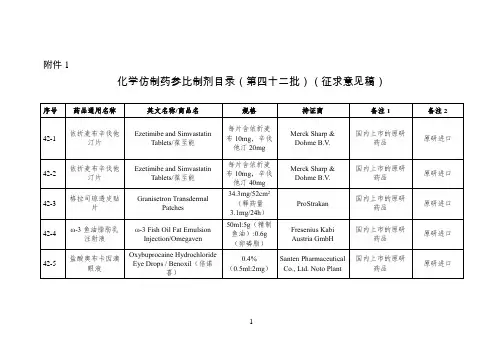
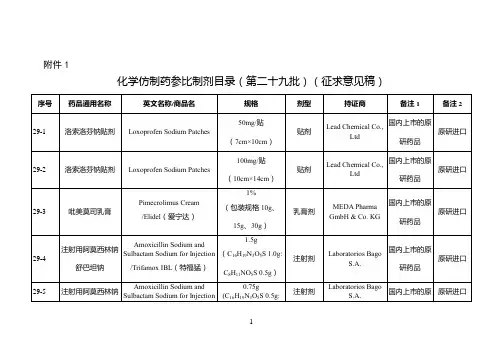
附件:化学仿制药参比制剂目录(第八十批)
国家药监局
2024年5月13日。
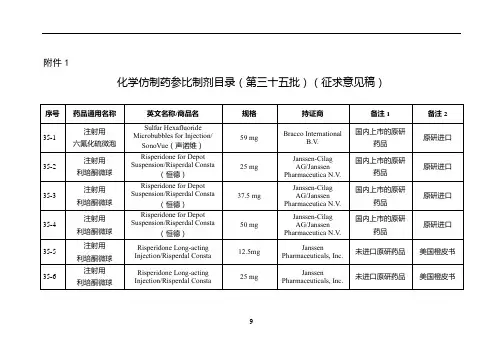
国家药监局关于发布仿制药参比制剂目录(第八十三
批)的通告
文章属性
•【制定机关】国家药品监督管理局
•【公布日期】2024.09.27
•【文号】国家药监局通告2024年第37号
•【施行日期】2024.09.27
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家药监局通告
2024年第37号
关于发布仿制药参比制剂目录(第八十三批)的通告
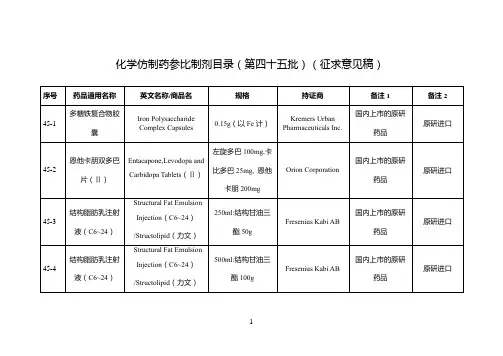
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第八十三批)。
特此通告。
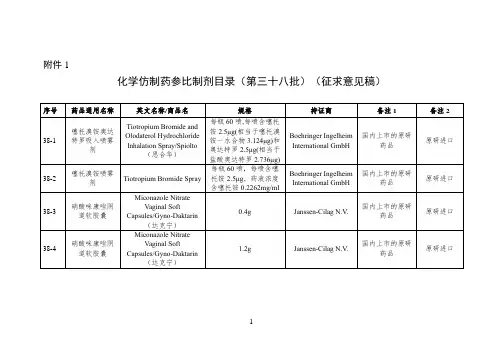
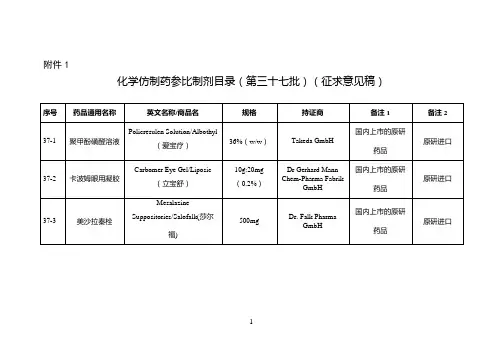
附件:化学仿制药参比制剂目录(第八十三批)
国家药监局
2024年9月27日。
食品药品监管总局办公厅公开征求仿制药质量和疗效一致性评价参比制剂备案与推荐程序的意见文章属性•【公布机关】国家食品药品监督管理总局•【公布日期】2016.04.11•【分类】征求意见稿正文食品药品监管总局办公厅公开征求仿制药质量和疗效一致性评价参比制剂备案与推荐程序的意见为落实《国务院办公厅关于开展仿制药质量和疗效一致性评价意见的通知》(国办发〔2016〕8号)的有关要求,食品药品监管总局组织起草了《仿制药质量和疗效一致性评价参比制剂备案与推荐程序(征求意见稿)》,现向社会公开征求意见。
请将修改意见于2016年4月30日前通过电子邮件反馈至国家食品药品监督管理总局仿制药质量一致性评价办公室。
电子邮件:*************.cn附件:仿制药质量和疗效一致性评价参比制剂备案与推荐程序(征求意见稿)食品药品监管总局办公厅2016年4月11日附件仿制药质量与疗效一致性评价参比制剂备案与推荐程序(征求意见稿)为贯彻落实国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)的任务要求,进一步明确参比制剂的选择流程,制定本备案与推荐程序。
一、本程序所述参比制剂备案与推荐工作,是指药品生产企业、行业协会、原研药品生产企业、国际公认的同种药物生产企业等作为申请人或推荐人,参照《普通口服固体制剂参比制剂选择和确定指导原则》,通过备案、推荐、申报等方式,选择参比制剂的过程。
二、药品生产企业可通过备案的方式选择参比制剂。
生产企业填写《参比制剂备案表》(附件1);撰写《综述资料》(附件4),详述参比制剂选择理由;提交所生产品种现行有效的批准证明文件,生产产品首次批准和上市后变更等历史沿革情况的说明。
三、行业协会可组织同品种生产企业提出参比制剂的推荐意见。
行业协会填写《参比制剂推荐表》(附件2);撰写《综述资料》(附件4),详述参比制剂选择理由;提交行业协会资质证明复印件、推荐过程记录与说明、相关同品种生产企业同意推荐的证明性文件。