胶体与表面化学-第三章 凝胶
- 格式:ppt
- 大小:6.01 MB
- 文档页数:76



第三章双电层对离子型溶质,由于电离,吸附在界面的是离子而不是中性分子。
通常液/气,液/液界面的吸附是单分子层的,因而离子型溶质的吸附导致产生一带电单层。
考虑到界面相的电中性,必有等量的相反电荷,即通常所说的反离子,存在于界面相,从而形成所谓的双电层。
双电层的存在是电动电势或ζ-电势产生的基础,而ζ-电势是分散体系的一个重要稳定因素。
因此双电层理论是胶体和界面化学的重要内容。
本章将重点介绍双电层理论,然后讨论电动现象和ζ-电势,最后简单介绍双电层的排斥效应。
3.1双电层理论有机电解质离子吸附在空气/水界面和液/液界面时,其定向排列导致形成带电的吸附单层。
等电荷的反离子分布于界面相。
双电层理论就是要讨论这些反离子的分布规律。
有关双电层模型已经提出了好几种,各模型的不同之处在于不同的反离子的分布规律。
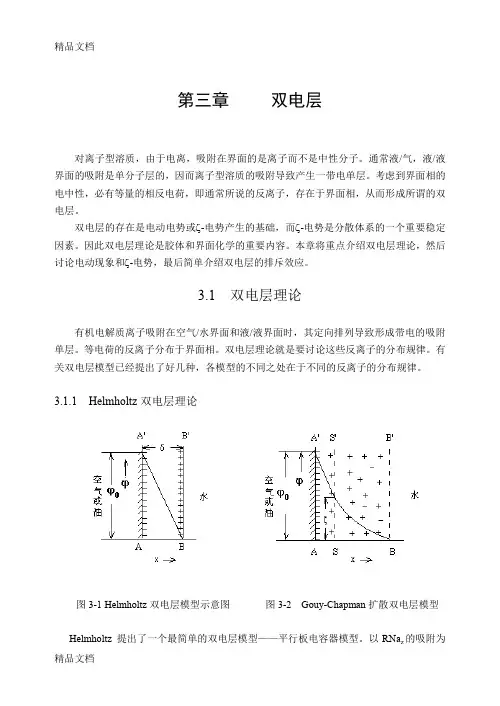
3.1.1 Helmholtz双电层理论图3-1 Helmholtz双电层模型示意图图3-2 Gouy-Chapman扩散双电层模型Helmholtz 提出了一个最简单的双电层模型——平行板电容器模型。
以RNa z的吸附为例, 该模型认为,带负电的R -z 在空气/水界面或油/水界面上定向排列于AA’面,而带相反电荷的反离子定向排列于BB’面,如图3-1所示。
AA’和BB’两平面之间的距离δ即为界面相的厚度,其大小为分子厚度级。
AA’面和BB’面上的电荷密度(单位面积上的电荷)大小相等,但符号相反,类似于平行板电容器。
界面电势ϕ0与AA’面上的电荷密度σ 之间的关系由Helmholtz 公式表达:δπσϕD40= (3-1) 式中D 为区间AA’ BB’的介质的介电常数。
沿x 方向从AA’面到BB’面,界面电势线性地急剧下降,从AA’面上的ϕ0下降到BB’面上的0。
对RNa z 自溶液中的吸附,由于RNa z 是高表面活性的,因此ΓR 和∆n R 之间的差别可忽略,即认为ΓR 等于∆n R ,并且若体系中存在电解质NaCl ,按照Helmholtz 模型,Cl -的吸附量将为零:0=Γ-cl (3-2) 于是Helmholtz 模型的电中性方程为:ΓΓ+=Na R z (3-3) 对带电固/液或液/液界面,电动试验(将在后面详细论述)或其它涉及界面电荷的试验表明,双电层的实际厚度较为宽广。




第一章绪论1.相:体系中物理化学性质完全相同的均匀部分;2.界面:相与相之间的交界面;3.表面:一相为气相的界面;4.比表面:单位体积或重量的物质所具有的总表面积;5.胶体化学:研究胶体体系的科学;6.表面化学:研究发生在物质表面或界面上的物理化学现象的一门学科;7.胶体:粒子大小1~100nm ,热力学不稳定,动力学稳定,扩散速度慢,不发生渗析,能通过滤纸,在超显微镜下可见;8.胶体分类:按分散介质可分为“气、液、固溶胶”。
第二章胶体的制备1.胶体制备的一般条件:①分散相在介质中的溶解度必须极小,反应物浓度很稀,生成难溶物晶体颗粒很小,不具备长大条件;②必须有稳定剂存在;2.胶体制备方法:(一)分散法①机械分散法:适用于脆而易碎的物质,对于柔韧性物质必须先硬化再粉碎。
②电分散法:将金属做成两个电极,浸在水中,盛水的盘子放在冷浴中。
在水中加入少量氢氧化钠做稳定剂。
制备时在两电极上施加100V 左右的直流电,调节电极间距离,使之发出电火花,这时表面金属蒸发,是分散过程,接着金属蒸汽立即被水冷却而凝聚成凝胶。
③超声波分散法:将分散相和分散介质两种不混溶的液体放在样品管中,样品管固定在变压器油浴中。
在两电极上通入高频电流,使电极中间的石英片发生机械震荡,使样品管中的两个液相均匀地混合成乳状液。
④溶胶分散法:新生成的沉淀中加入电解质或改变体系温度而形成溶胶体系。
(二)凝聚法:用物理方法或化学反应使分子、离子狙击成胶体粒子的方法。
(1)物理凝聚:将蒸汽状态或溶解状态的物质凝聚成胶体状态的方法。
①蒸汽骤冷法;②更换溶剂法;(2)化学凝聚:通过各种化学反应使生成物呈过饱和状态。
使初生成的难溶物微粒结合成胶粒,在少量稳定剂存在的条件下形成溶胶。
3.溶胶的净化方法(一)粗粒子:过滤、沉降、离心;(二)电解质:渗析、电渗析、超过滤、渗透与反渗透4.单分散溶胶定义:溶胶粒子的尺寸、形状、结构都相同的溶胶体系;5.单分散溶胶制备理论(LaMer )控制溶质的过饱和浓度,使之略高于成核浓度,爆发式成核。


胶体与表面化学第一章绪论(2学时)1.1胶体的概念什么是胶体,胶体的分类1.2胶体化学发展简史1.3胶体化学的研究对象表面现象,疏液胶体,缔合胶体,高分子溶液。
重点:胶体、分散系统、分散相、分散介质的概念。
难点:胶体与表面化学在矿物加工工程中的作用及意义。
教学方法建议:启发式教学,引导学生对胶体及表面化学的兴趣。
第二章胶体与纳米材料制备(4学时)2.1胶体的制备胶体制备的条件和方法,凝聚法原理。
2.2胶体的净化渗析、渗透和反渗透。
2.3单分散溶胶单分散溶胶的定义及制备方法。
2.4胶体晶体胶体晶体的定义及制备方法2.5纳米粒子的制备什么是纳米材料,纳米粒子的特性及制备方法重点:胶体的制备、溶胶的净化、胶体晶体的制备。
难点:胶体制备机理。
教学方法建议:用多媒体教学,注重理论联系实际。
第三章胶体系统的基本性质(8学时)3.1溶胶的运动性质扩散、布朗运动、沉降、渗透压和Donnan平衡。
3.2溶胶的光学性质丁道尔效应和溶胶的颜色。
3.3溶胶的电学性质电动现象、双电层结构模型和电动电势(。
电势)3.4溶胶系统的流变性质剪切速度越切应力,牛顿公式,层流与湍流,稀胶体溶液的黏度。
3.5胶体的稳定性溶胶的稳定性、DLVO理论、溶胶的聚沉、高聚物稳定胶体体系理论。
3.6显微镜及其对胶体粒子大小和形状的测定显微镜的类型及基本作用重点:沉降、渗透压、电泳、电渗、。
电势的计算、双电层结构模型、DLVO理论、溶胶的聚沉。
难点:双电层结构模型。
教学方法建议:多媒体教学和板书教学相结合。
第四章表面张力、毛细作用与润湿作用(6学时)4.1表面张力和表面能净吸力和表面张力的概念、影响表面张力的因素、液体表面张力和固体表面张力的测定方法。
4.2液-液界面张力Anntonff规则、Good-Girifalco公式、Fowkes理论和液-液界面张力的测定。
4.3毛细作用与Laplace公式和Kelvin公式毛细作用,Laplace公式和Kelvin公式的应用,曲界面两侧的压力差及与曲率半径的关系,毛细管上升或下降现象,弯曲液面上的饱和蒸气压。

第一章 胶体的制备和性质一、什么是胶体?1.胶体体系的重要特点之一是具有很大的外表积。
通常规定胶体颗粒的大小为1-100nm 〔直径〕2.胶体是物质以一定分散程度存在的一种特殊状态,而不是一种特殊物质,不是物质的本性。
胶体化学研究对象是溶胶〔也称憎液溶胶〕和高分子溶液〔也称亲液溶胶〕。
气溶胶:云雾,青烟、高空灰尘液溶胶:泡沫,乳状液,金溶胶、墨汁、牙膏固溶胶:泡沫塑料、沸石、冰淇淋,珍珠、水凝胶、红宝石、合金 二、溶胶的制备与净化1.溶胶制备的一般条件:〔1〕分散相在介质中的溶解度必须极小〔2〕必须有稳定剂存在2.胶体的制备方法:〔1〕分散法:①研磨法:用机械粉碎的方法将固体磨细〔产品细度1-74μm 〕②胶溶法〔解胶法〕:仅仅是将新鲜的凝聚胶粒重新分散在介质中形成溶胶,并参加 适当的稳定剂。
〔目前制备纳米材料和超微细粉的方法〕③超声波分散法:让分散介质动起来。
主要用来制备乳状液〔即分散介质是液体的体系〕。
好处是不与溶液接触。
④电弧法:用于制备金属水溶胶。
金溶胶多用于美容。
(2)凝聚法:①化学凝聚法②物理凝聚法:A 、更换溶剂法〔溶解度是减小的〕:利用物质在不同容剂中的溶解度的显著差异,制备溶胶,而且两种溶剂要能完全互溶。
〔与萃取区别〕B 、蒸汽骤冷法:制备碱金属的苯溶胶。
3.溶胶的净化:简单渗析法,电渗析,超过滤法 三.溶胶的运动性质1.扩散:胶粒从高浓度向低浓度迁移的现象,此过程为自发过程根本原因在于存在化学位。
d d d d m cDA t x =-,此为Fick 第一扩散定律,式中dm/dt 表示单位时间通过截面A 扩散的物质数量,D为扩散系数,单位为m 2/s ,D 越大,质点的扩散能力越大。
扩散系数D 与质点在介质中运动时阻力系数f 之间的关系为:A RTD N f=〔A N 为阿伏加德罗常数;R 为气体常数〕假设颗粒为球形,阻力系数f =6r πη〔式中,η为介质的黏度,r 为质点的半径〕 故16RT D NA rπη=⨯,此式即为Einstein 第一扩散公式 浓度梯度越大,质点扩散越快;就质点而言,半径越小,扩散能力越强,扩散速度越快。