《细胞转染技术》PPT课件
- 格式:ppt
- 大小:84.50 KB
- 文档页数:20


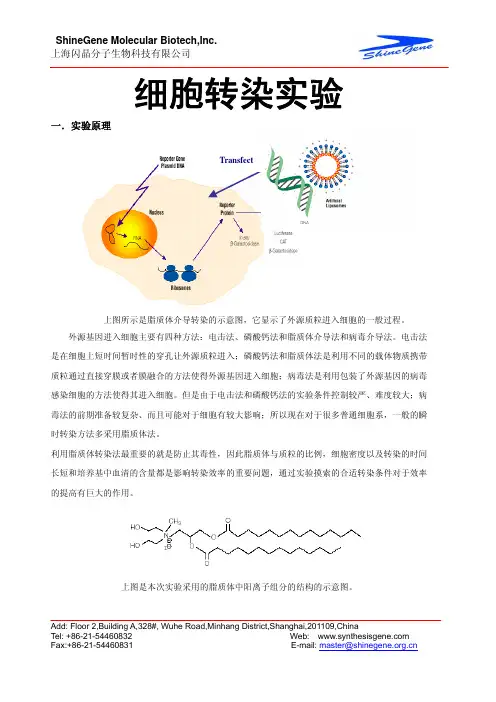
细胞转染转染技术是指将外源分子如DNA,RNA等导入真核细胞的技术。
常规的转染技术可分为两大类,一类是瞬时转染,一类是稳定转染(永久转染)。
前者外源DNA/RNA不整合到宿主的染色体中,因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其他调控元件的分析。
一般来说,超螺旋质粒DNA转染效率较高,在转染后24—72小时内(依赖于各种不同的构建)分析结果,常常用到一些报告系统如荧光蛋白,β半乳糖苷酶等来帮助检测。
后者也称稳定转染,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体存在。
尽管线性DNA比超螺旋DNA转入量低但整合率高。
外源DNA整合到染色体中的概率很小,大约1/104转染细胞能整合,通常需要通过一些选择性标记,如来氨丙基转移酶(APH:新霉素抗性基因),潮霉素B磷酸转移酶(HPH),胸苷激酶(TK)等反复筛选,得到稳定转染的同源细胞系。
转染技术的选择对转染结果影响也很大,许多转染方法需要优化DNA与转染试剂的比例、细胞数量、培基及检测时间等。
转染效率受多种因素影响,主要因素有下面几个:1、转染试剂不同细胞系转染效率通常不同,但细胞系的选择通常是根据实验的需要,因此在转染实验前根据实验要求和细胞特性选择适合的转染试剂。
每种转染试剂都会提供一些已经成功转染的细胞株列表和文献,通过这些资料可选择最合适实验设计的转染试剂。
当然,最适合的是高效、低毒、方便、廉价的转染试剂。
2、细胞状态一般低的细胞代数(<50代)能确保基因型不变。
最适合转染的细胞是经过几次传代后达到指数生长期的细胞,细胞生长旺盛,最容易转染。
细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。
这会导致和转染相关的细胞行为的变化。
也就是说同一种系的细胞株,在各实验室不同培养条件下,其生物学性状发生不同程度的改变,导致其转染特性也发生变化。
因此,如果发现转染效率降低,可以试着转染新鲜培养的细胞以恢复最佳结果。






细胞转染技术从入门到精通概念:概括地说,转染是使用非病毒感染的手段人工引入核酸(DNA或RNA)进入细胞的过程。
转染的目的是产生重组蛋白,或特异性增强或抑制转染细胞中的基因表达。
转染的类型根据导入的核酸存在于宿主细胞的时间长短,可以分为瞬转和稳转。
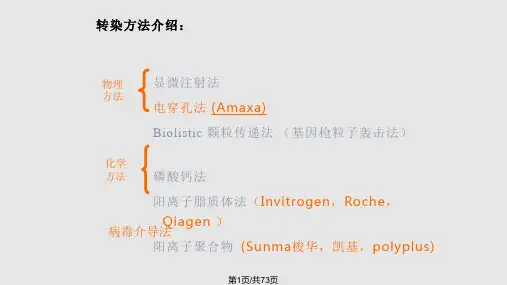
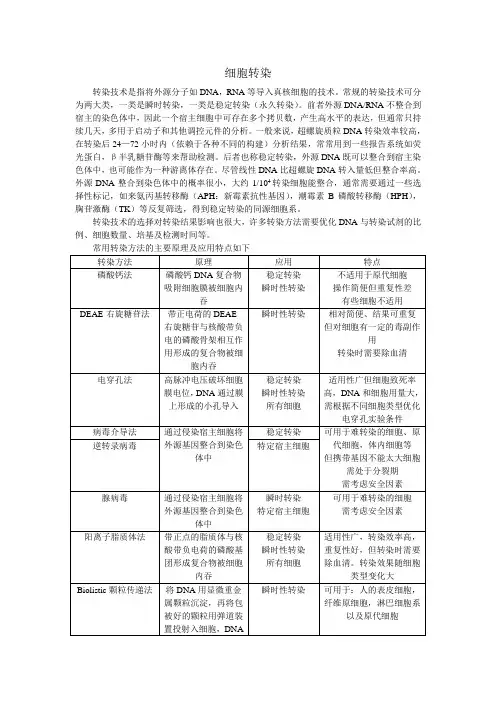
根据转染方式可以分为化学,生物,物理方法。
瞬转:因为导入的核酸没有整合到宿主细胞基因组,因此它只会短暂地存在于宿主细胞中,不会随着细胞的分裂而进入到子代细胞中。
然而,导入的遗传物质的高拷贝数导致其在细胞内的蛋白质表达水平较高。
根据所使用的载体的不同,瞬转通常可以1至7天内进行基因检测,但是瞬时转染的细胞通常在转染后24-96小时收获。
当使用超螺旋质粒DNA时,瞬时转染的效果最好,推测是由于超螺旋质粒DNA能更有效地被细胞摄取。
稳转:外源DNA整合到细胞基因组中或作为附加体质粒保留在细胞中。
与瞬时转染不同,稳定转染允许外源DNA在转染的细胞及其后代中的长期维持。
然而,通常是将单拷贝或几个拷贝的外源DNA整合到稳定转染的细胞的基因组中,因此,其表达水平一般低于瞬时转染的表达水平。
由于稳转效率较低,因此选用有效地转染策略和筛选方法很重要。
其中比较可靠地筛选方法是在DNA载体中包含选择性标记,然后在细胞转染短暂性恢复后进行适当地选择性加压。
尽管相对于超螺旋DNA,线性DNA被细胞摄取的效率较低,但其能最有效地整合到宿主基因组中。
目前,由于各种转染试剂的发明,哺乳动物细胞的瞬时转染已经用于生产具有适当折叠和翻译后修饰的重组蛋白。
但表达mg/L-g/L 的重组蛋白主要依赖于稳定细胞系的产生。
瞬转和稳转的比较瞬转稳转导入的DNA没有整合到基因组中,而是保留在细胞核上导入的DNA整合到基因组中导入的遗传物质不传递到子代;遗传改变只是暂时的导入的遗传物质能够代代相传;遗传改变是永久的不需要选择性筛选需要选择性筛选出稳定转染的细胞DNA载体和RNA都可用于瞬时转染只有DNA载体可用于稳定转染;RNA本身不能稳定地导入细胞中导入的遗传物质的高拷贝数导致高水平的蛋白质表达。