精选苏教版高中化学必修1练习:第十一讲 氮及其化合物练习 Word版含答案
- 格式:doc
- 大小:106.00 KB
- 文档页数:4


第十一讲氮及其化合物1. (2021届宿迁学测第|一次模拟)以下气体中能用排水法收集的无色气体是( )A. SO2B. Cl2C. NO2D. NO2. (2021届无锡学测第二次模拟)以下关于物质性质的说法正确的选项是( )A. 通常状况下 ,NO2是无色的气体B. SO2能漂白品红等物质 ,说明SO2有氧化性C. 氯化钙溶液和AgNO3溶液混合有白色沉淀产生D. 加热时 ,铁单质与浓硝酸不发生反响3. (2021届扬州学测第|一次模拟)关于反响3Cu+8HNO3(稀) = = =3Cu(NO3)2+2NO↑+4H2O的说法正确的选项是( )A. Cu是氧化剂B. HNO3在反响中被氧化C. 每生成1 mol NO转移3 mol e-D. HNO3仅表现出酸性4. (2021届南京一中模拟)NO2被水吸收的反响中 ,发生复原反响和氧化反响的物质的质量比为( )A. 3∶1B. 1∶3C. 1∶2D. 2∶15. (2021届江苏启东中学模拟)以下有关物质的性质或用途的表达中 ,正确的选项是( )A. 常温下 ,运输浓硫酸、浓硝酸时可用铝制或铁制槽车B. 用氯化钡溶液可区别SO2-4和CO2-3C. CO、NO、 NO2都是大气污染气体 ,在空气中都能稳定存在D. 硅晶体用于制造光导纤维6. (2021届南师附中模拟)以下关于氨的表达中 ,错误的选项是( )A. 氨易液化 ,因此可用来作制冷剂B. 氨易溶解于水 ,因此可用来作喷泉实验C. 氨极易溶解于水 ,因此氨水比较稳定(不容易分解)D. 氨溶解于水显弱碱性 ,因此可使酚酞试剂变为红色7. (2021届盐城中学模拟)人工固氮是指通过人工的方法将空气中游离的氮转变为化合态的氮的方法 .以下过程中属于人工固氮的是( )A. 氮气和氢气在一定条件下反响生成氨气B. 下雷阵雨时 ,在雷电作用下 ,空气中的氮气和氧气化合生成一氧化氮C. 豆科植物的根瘤菌把空气中的氮气变成氮的化合物D. 一氧化氮和氧气化合生成二氧化氮8. (2021届南京中华中学模拟)以下反响的离子方程式错误的选项是( )A. 铁与稀硫酸反响:Fe+2H+= = =Fe2++H2↑B. 铜与浓硝酸反响:Cu+2NO-3+4H+= = =Cu2++2NO2↑+2H2OC. 碳酸钙跟稀盐酸反响:CO2-3+2H+= = =CO2↑+H2D. 铁与氯化铁溶液反响:Fe+2Fe3+= = =3Fe2+9. (2021届金陵中学模拟)为了更简便制取枯燥氨气 ,以下方法中适宜的是 ( )A. NH4Cl和H2SO4(浓)混合加热 ,生成的气体用碱石灰枯燥B. N2+H2―→NH3 ,用烧碱枯燥C. 加热浓氨水 ,气体用碱石灰枯燥D. 加热NH4HCO3 ,气体用浓硫酸枯燥10. (2021届扬州新华中学模拟)某氮肥样品可能含有NH4HCO3、NH4Cl、NH4NO3中的一种或几种 .称取该样品0.500 0 g ,溶解配成100.00 mL溶液 ,加过量浓NaOH溶液 ,加热 ,将产生的氨气通入60.00 mL 0.100 0 mol·L-1的H2SO4溶液中(设产生的NH3全部逸出) ,剩余的H2SO4溶液能消耗20.00 mL 0.225 0 mol·L-1的NaOH溶液 .以下说法正确的选项是( )A. 吸收NH3消耗的H2SO4为6.000×10-3 molB. 上述过程共产生NH3 268.8 mLC. 该样品中NH+4的质量分数为43.2%D. 该氮肥样品必含NH4Cl11. (2021届镇江一中模拟)1.52 g铜镁合金完全溶解于50 mL 密度为1.40 g·mL-1、质量分数为63%的浓硝酸中 ,得到NO2和N2O4的混合气体1 120 mL(标准状况) ,向反响后的溶液中参加1.0 mol·L-1 NaOH溶液 ,当金属离子全部沉淀时 ,得到2.54 g沉淀 .以下说法不正确的选项是( )A. 该合金中铜与镁的物质的量之比是2∶1B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1C. NO2和N2O4的混合气体中 ,NO2的体积分数是80%D. 得到2.54 g沉淀时 ,参加NaOH溶液的体积是600 mL12. (2021届无锡一中模拟)设空气中O2 ,N2的体积分数为0.8 .在有水存在的条件下 ,某氮的氧化物(NO与NO2形成的混合物)和一定量空气混合恰好完全反响生成硝酸 ,反响后气体体积减小了一半(相同条件下) .那么该氮的氧化物中NO与NO2的体积比可能是( )A. 1∶5B. 1∶4C. 1∶3D. 任意比第十一讲氮及其化合物1. D2. C3. C4. C5. A6. C7. A8. C9. C10. D11. D12. A。

高考化学易错题专题训练-氮及其化合物练习题含详细答案一、氮及其化合物练习题(含详细答案解析)1.人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:(1)将N2转化为含氮化合物的过程称为固氮①人工固氮,将N2→NH3, N2发生_________反应②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3M−−→Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式__________、__________。
将HNO3转化为Ca(NO3)2,列举三种不同类别......的化合物M_______(写化学式)。
(2)科学合理地保存、施用氮肥① NH4HCO3需阴凉处保存,原因是__________(写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式________。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。
(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去):① X可能是______、_______。
Y是___________。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3则尿素中C 元素化合价为__________。
【答案】还原 2NO + O2= 2 NO2 3NO2 + H2O = 2HNO3 + NO CaO、Ca(OH)2、CaCO3NH4HCO3ΔNH3↑+CO2↑+ H2O NH4++ OH-= NH3↑+ H2O SO3 H2SO3 H2SO4 +4【解析】【分析】本题主要考察含N物质的化学性质,运用所学知识答题即可。
【详解】(1)①N2→NH3,N的化合价由0变为了-3,则N2作氧化剂,发生还原反应;②NO→NO2的化学方程式为:2NO+O2=2NO2;NO2→HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;HNO3M−−→Ca(NO3)2,M可以是CaO、Ca(OH)2、CaCO3;(2)①NH4HCO3需阴凉处保存,是因为该物质对热不稳定,受热易分解,相关的化学方程式为:NH4HCO3ΔNH3↑+CO2↑+H2O;②该离子方程式为:NH 4++OH -=NH 3↑+H 2O ;(3)①根据图可知,Y 为H 2SO 4;在自然环境中,SO 2变为H 2SO 4的途径有两种:2H O [O]2324SO SO H SO −−→−−−→、22H O O 22324SO H SO H SO −−−→−−→,故X 为SO 3或H 2SO 3;②尿素CO(NH 2)2缓慢与H 2O 发生非氧化还原反应释放出NH 3,说明尿素中N 呈-3价,由于O 呈-2价,H 呈+1价,故可算得C 呈+4价。

生产生活中的含氮化合物同步练习 11.下列反应中能起到固氮作用的是( ) A.NO 与O 2反应生成NO 2 B.NH 3经催化氧化生成NOC.由NH 3制碳铵和硫铵D.N 2与H 2在一定条件下合成氨2.下列用途中应用了氮气不活泼性的是()A.金属焊接时的保护气 B.用于合成氨气C.工业上以N 2为原料之一制HNO 3 D.保护粮食和水果3.NO 在人体内具有多方面的独特功能。
1998年诺贝尔医学及生理学奖即授予了研究NO 、并在医学领域取得重大进展的科学家。
以下关于NO 的叙述中不正确的是()A .NO 既可是某些含低价氮物质的氧化产物,也可是某些含高价氮物质的还原产物B .NO 具有氧化性C .通常状况下,NO 是无色气体D .NO 是亚硝酸(HNO 2)的酸酐4.下列物质存放方法正确的是()A .药品柜的同一层不可存放浓硝酸和浓氨水B .少量的钠保存在无水乙醇中C .少量白磷保存在二硫化碳中D .硅酸钠溶液保存在玻璃塞的试剂瓶中5.废切削液中含2%~5%的2NaNO ,直接排放会污染环境,下列试剂中能使其转化为不引起二次污染的2N 的是()A .22O H B .ClNH 4C .NaClD .浓42SO H 6.下列反应式表示氨既有还原性又有碱性的是()A .22232634N OH PtO NH B .2433NH NH NH NH C .2423638N Cl NH Cl NH D .2233332N OH CuCuONH 7.对下列事实的解释错误的是()A .在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性B .浓硝酸在光照下颜色变黄,说明浓硝酸不稳定C .常温下,浓硝酸可以用铝罐来贮存,说明铝与浓硝酸不反应D .反应4224SO H CuSSH CuSO 能进行,说明硫化铜既不溶于水,也不溶于稀硫酸8.判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是()A .浓盐酸B .硝酸C .王水D .稀硫酸9.把6mol 铜粉投入含8mol 硝酸和2mol 硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( ).A .2 molB .3 molC .4 molD .5mol10.已知NH 3极易溶于水,而难溶于有机溶剂——CCl 4。

高中化学学习材料生产生活中的含氮化合物 同步练习1. 下列关于自然界中氮循环(如下图)的说法不正确的是( )A .氮元素均被氧化B .工业合成氨属于人工固氮C .含氮无机物和含氮有机物可相互转化D .碳、氢、氧三种元素也参加了氮循环解析:选A A .N 2→NH 3过程中氮元素由0价变为-3价,被还原。
B.工业合成氨的过程属于人工固氮。
C.1828年,德国化学家维勒首次利用无机物氰酸铵合成了尿素;而含氮的有机物也可以直接分解为无机物。
D.雷电发生时涉及的反应有N 2+O 2=====放电2NO,2NO +O 2===2NO 2,3NO 2+H 2O===2HNO 3+NO ,HNO 3进入土壤,与矿物质结合成硝酸盐;豆科植物也可以将N 2合成氮肥,生物体内的蛋白质中含有C 元素,所以碳、氢、氧三种元素都参加了氮循环。
2.随着我国汽车年销量的大幅增加,空气环境受到了很大的污染。
汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )A .反应中NO 为氧化剂,N 2为氧化产物B .汽车尾气的主要污染成分包括CO 、NO 和N 2C .NO 和O 2必须在催化剂表面才能反应D .催化转化总化学方程式为2NO +O 2+4CO=======催化剂4CO 2+N 2 解析:选D 反应过程中NO 、O 2为氧化剂,N 2为还原产物;汽车尾气中的N 2不是污染物;NO 和O 2的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO +O 2===2NO 2,2NO 2+4CO===N 2+4CO 2,将两步反应式合并可得总化学方程式为2NO +O 2+4CO=======催化剂4CO 2+N 2。
3.下列说法不正确的是( )A .在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO 3)2固体,铜粉仍不溶解B .某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性C .铜与稀硝酸反应的离子方程式为3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2OD .HNO 3―→NO ―→NO 2,以上各步变化均能通过一步实验完成解析:选A A 项中加入Cu(NO 3)2固体后,Cu 和H +、NO -3发生反应:3Cu +8H ++2NO -3===3Cu2++2NO ↑+4H 2O ,该项不正确。
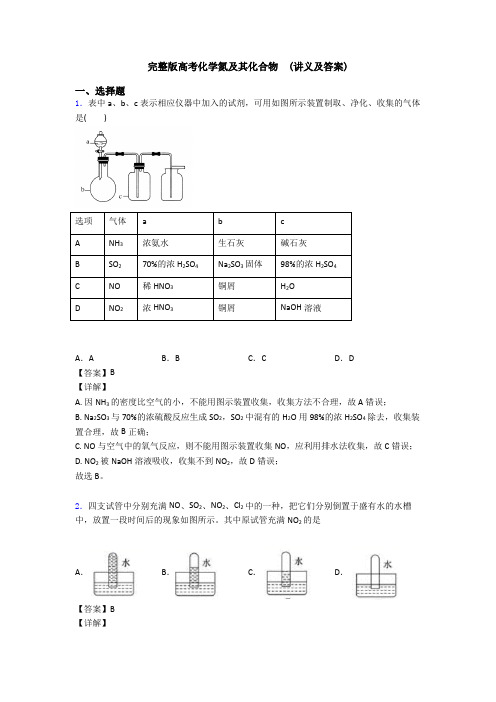
完整版高考化学氮及其化合物 (讲义及答案)一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO2的是A.B.C.D.【答案】B【详解】NO不溶于水,对应D图像,SO2在水中的溶解度为1体积水溶解40体积SO2,对应图像A,根据化学方程式3NO2+H2O=2HNO3+NO,剩余气体是反应前的1/3,对于图像B,Cl2+H2O =HCl+HClO,HClO2HCl+O2↑,对应图像C,所以其中原试管充满NO2的是B,答案选B。
3.起固定氮作用的化学反应是A.雷雨时空气中的 NO转化为NO2B.N2与H2在一定条件下反应生成NH3 C.用NaOH吸收NO2和NO D.工厂用NH3催化氧化制NO【答案】B【详解】A.NO转化为NO2不是固氮作用的反应,选项A错误;B.N2与H2在一定条件下反应生成NH3,是由单质氮气转化为氨气,符合氮的固定的定义,选项B正确;C.用NaOH吸收NO2和NO不是固氮作用的反应,选项C错误;D.用氨气转化为NO不是固氮作用的反应,选项D错误;答案选B。
专题4第二单元 生产生活中的含氮化合物(10)1、把少量2NO 体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )A.氧气B.二氧化氮C.二氧化氮和氧气D.二氧化氮和一氧化氮2、在2NO 被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为( )A.3:1B.1:3C.1:2D.2:13、如图是课外活动小组的同学设计的4个喷泉实验方案。
下列有关操作不可能引发喷泉现象的是( )A.挤压装置①的胶头滴管使CCl 4全部进入烧瓶,片刻后打开止水夹B.挤压装置②的胶头滴管使NaOH 溶液全部进入烧瓶,片刻后打开止水夹C.用鼓气装置从装置③的a 处不断鼓入空气并打开止水夹D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹4、1.52g 铜镁合金完全溶解于50mL 密度为1.401g mL -⋅、质量分数为63%的浓硝酸中,得到2NO 和24N O 的混合气体1120mL (标准状况),向反应后的溶液中加入1.01mol L -⋅ NaOH 溶液,当金属离子全部沉淀时,得到2.54g 沉淀,下列说法不正确的是( )A.该合金中铜与镁的物质的量之比是2:1B.该浓硝酸中3HNO 的物质的量浓度是14.01mol L -⋅C. 2NO 和24N O 的混合气体中, 2NO 的体积分数是80%D.得到2.54g 沉淀时,加入的NaOH 溶液的体积是600mL5、用浓氯化铵溶液处理过的舞台幕布不易着火。
其主要原因是( )①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度④氯化铵分解产生的气体隔绝了空气A.①②B.③④C.①③D.②④6、下列说法正确的是( )A.硫,氮的氧化物及二氧化碳的排放是形成酸雨的主要原因B.氨水能使紫色石蕊试液变红C.硝酸是一种强氧化性酸,所以硝酸和锌反应不能制取氢气D.铁能与硫酸反应,所以不能用铁质容器盛装浓硫酸7、下列叙述中正确的是( )A.氨水和液氨不同,氨水是混合物,液氨是纯净物B.氨水显碱性,溶液中只有OH -没有H +C.氨气与氯化氢气体相遇产生白色烟雾D.在反应3NH H ++4NH +中, 3NH 失去电子被氧化8、下图各装置不能达到实验目的的是( )A.装置①可用于从()3Fe OH 胶体中过滤出()3Fe OH 胶粒B.装置②可用于干燥、收集氨气,并吸收多余的氨气C.装置③可用于排空气法收集2NO 气体D.装置④可用于证明2SO 易与NaOH 溶液反应9下列有关氮元素的单质及其化合物的说法错误的是( ) ①氮气和氧气在放电条件下可直接生成②铵盐不稳定,受热分解都生成氨气 ③向溶液中加入稀盐酸,溶液无明显变化④实验室用加热氯化铵固体,用碱石灰除去氯化氢的方法来制备氨气A.①③④B.①③C.①④10、碳跟浓硫酸共热产生的气体X 和铜跟浓硝酸反应产生的气体Y 同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示),下列有关说法正确的是( )A.洗气瓶中产生的沉淀是碳酸钡B. Z 导管出来的气体中无二氧化碳C.洗气瓶中的溶液仍然呈中性D. Z 导管口有红棕色气体出现11、如图所示,向一定量的铁粉中加入一定体积121mol L -⋅的硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是( )①3NO -②3Fe + ③H + ④NO ⑤2NOA.①B.①⑤C.②④⑤D.①②③⑤12、如图,利用培养皿探究氨气的性质.实验时向NaOH 固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
高中化学氮及其化合物练习题及答案一、选择题1.下列每步转化不能通过一步反应就实现的是A.NH3TNOTNO2THNO3B.AITAI2O3TAI(OH)3TNaAIO2C.S^SO2^H2SO4^MgSO4D.FeTFeCI2TFe(OH)2TFe(OH)3【答案】B【详解】A•氨气发生催化氧化生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,A正确;B.铝与氧气反应生成氧化铝,氧化铝不溶于水,不能直接转化为氢氧化铝,B错误;C.S燃烧生成so2,SO2被氯水氧化可以转化为硫酸,硫酸与镁等反应可以生成硫酸镁,C正确;D.铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化转化为氢氧化铁,D正确;答案选B o2.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有CI-【答案】A【详解】A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B.原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C.产生不溶于盐酸的白色沉淀也可能是AgCI,则原溶液中不一定有SO42-,C项错误;D.加入盐酸酸化的AgNO3溶液时,则引入了CI-,故不能证明是原溶液中是否含有CI-,D项错误;答案选A o3.如图是产生和收集气体的实验装置示意图,该装置适合于()A.用浓硝酸和Cu制取NO2B.用H2O2溶液和MnO2制取O2C.用浓盐酸和MnO2制取Cl2D.用NH4CI溶液和Ca(OH)2制取NH3【答案】B【详解】A.二氧化氮会与水发生反应,不能用排水法收集,故A不合适;B.分液漏斗中盛放双氧水,圆底烧瓶中为二氧化锰,二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,故B合适;C.浓盐酸和二氧化锰制取氯气需要在加热条件下反应,故C不合适;D.氨气极易溶于水,不能用排水法收集,且氢氧化钙与溶于水时放出的热量较少,无法蒸出氨气,故D不合适;故答案为B。
高中化学学习材料基础课时4 生产生活中的含氮化合物一、单项选择题1.下列说法中正确的是( )A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在,都不是酸性氧化物B.N2+3H22NH3、N2+O22NO都属于氮的固定,且N2都表现还原性C.向BaCl2溶液中加入Na2SO3产生沉淀,再通入NO2,沉淀完全溶解D.某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该溶液一定有NH+4解析NO能与氧气反应生成NO2,NO在空气中不能稳定存在,A错误;N2→NH3,N 2表现氧化性,N2→NO,N2表现还原性,B错误;NO2与H2O反应生成HNO3,HNO3具有强氧化性,可以把SO2-3氧化为SO2-4,生成BaSO4沉淀,C错误。
答案 D2.下列叙述不正确的是( )A.NH3的喷泉实验说明氨气极易溶于水B.NH3遇到挥发性强酸就能冒白烟C.盛液溴的瓶内加少量水可防止液溴的挥发D.NO和NH3均可用排空气法收集解析NH3与挥发性酸的蒸气能形成固体小微粒而形成白烟,B正确;溴微溶于水且密度比水大,加入的少量水会浮在液面上,C正确;NO易与空气中氧气反应,D错误。
答案 D3.关于如图进行的实验的说法,正确的是( )A.若X为HCl,则烧瓶内可产生白雾B.选择适当的X和Y溶液可产生有色喷泉C.若烧瓶内产生喷泉,则Y溶液一定呈酸性D.若通入气体为Cl2,则烧瓶内一定无喷泉产生解析若X为HCl,则烧瓶内会发生HCl与浓氨水挥发出来的氨气的反应,刚开始时会产生白烟,而不是白雾,A错误;选择适当的X和Y溶液可产生有色喷泉,如硫化氢气体和硫酸铜溶液,B正确;若烧瓶内产生喷泉,则Y与X发生反应即可,故Y溶液不一定呈酸性,C错误;若通入气体为Cl2,Y溶液为碱性溶液则烧瓶内可以产生喷泉,D错误。
答案 B4.对于某些离子的检验及结论一定正确的是( )A.加入氨水有白色沉淀产生,继续滴加氨水沉淀不溶解,一定有Al3+B.加入氯化钡溶液有白色沉淀产生,再加硝酸,沉淀不消失,一定有SO2-4 C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH+4D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+解析Mg(OH)2、Al(OH)3等均不溶于氨水,故A错;加入BaCl2溶液产生不溶于硝酸的白色沉淀,溶液中除了可能存在SO2-4外,也可能存在SO2-3、Ag+等,故B错;C项正确;加入Na2CO3溶液产生白色沉淀,再加盐酸白色沉淀消失,溶液中存在的离子有可能是Ca2+,故D错。
新高中化学氮及其化合物 (讲义及答案)一、选择题1.下列每步转化不能通过一步反应就实现的是A.NH3→NO→NO2→HNO3B.Al→Al2O3→Al(OH)3→NaAlO2C.S→SO2→H2SO4→MgSO4D.Fe→FeCl2→Fe(OH)2→Fe(OH)3【答案】B【详解】A.氨气发生催化氧化生成NO,NO与氧气反应生成NO2,NO2溶于水生成硝酸,A正确;B.铝与氧气反应生成氧化铝,氧化铝不溶于水,不能直接转化为氢氧化铝,B错误;C.S燃烧生成SO2,SO2被氯水氧化可以转化为硫酸,硫酸与镁等反应可以生成硫酸镁,C 正确;D.铁与盐酸反应生成氯化亚铁,氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化转化为氢氧化铁,D正确;答案选B。
2.起固定氮作用的化学反应是A.雷雨时空气中的 NO转化为NO2B.N2与H2在一定条件下反应生成NH3 C.用NaOH吸收NO2和NO D.工厂用NH3催化氧化制NO【答案】B【详解】A.NO转化为NO2不是固氮作用的反应,选项A错误;B.N2与H2在一定条件下反应生成NH3,是由单质氮气转化为氨气,符合氮的固定的定义,选项B正确;C.用NaOH吸收NO2和NO不是固氮作用的反应,选项C错误;D.用氨气转化为NO不是固氮作用的反应,选项D错误;答案选B。
3.对于硫酸和硝酸的比较中,下列叙述不正确的是()A.冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装B.稀硫酸和稀硝酸都具有氧化性C.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性D.硫酸和硝酸都是重要的化工原料【答案】C【详解】A. 铝、铁与冷的浓硫酸和浓硝酸发生的钝化,因此冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装,故A正确;B. 稀硫酸和稀硝酸都具有氧化性,稀硫酸和金属反应生成氢气,表现氧化性,稀硝酸和金属反应生成硝酸盐和一氧化氮表现氧化性,故B正确;C. 浓硫酸和浓硝酸都具有很强的腐蚀性,浓硫酸具有脱水性,浓硝酸不具有,故C错误;D. 化工生产中用硝酸、硫酸生产化肥、农药、炸药、燃料,金属加工前的酸洗等,故D正确。
第十一讲氮及其化合物
1. (2017届宿迁学测第一次模拟)下列气体中能用排水法收集的无色气体是( )
A. SO2
B. Cl2
C. NO2
D. NO
2. (2017届无锡学测第二次模拟)下列关于物质性质的说法正确的是( )
A. 通常状况下,NO2是无色的气体
B. SO2能漂白品红等物质,说明SO2有氧化性
C. 氯化钙溶液和AgNO3溶液混合有白色沉淀产生
D. 加热时,铁单质与浓硝酸不发生反应
3. (2017届扬州学测第一次模拟)关于反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 的说法正确的是( )
A. Cu是氧化剂
B. HNO3在反应中被氧化
C. 每生成1 mol NO转移3 mol e-
D. HNO3仅表现出酸性
4. (2017届南京一中模拟)NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为( )
A. 3∶1
B. 1∶3
C. 1∶2
D. 2∶1
5. (2017届江苏启东中学模拟)下列有关物质的性质或用途的叙述中,正确的是( )
A. 常温下,运输浓硫酸、浓硝酸时可用铝制或铁制槽车
B. 用氯化钡溶液可区别SO2-4和CO2-3
C. CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D. 硅晶体用于制造光导纤维
6. (2016届南师附中模拟)下列关于氨的叙述中,错误的是( )
A. 氨易液化,因此可用来作制冷剂
B. 氨易溶解于水,因此可用来作喷泉实验
C. 氨极易溶解于水,因此氨水比较稳定(不容易分解)
D. 氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
7. (2016届盐城中学模拟)人工固氮是指通过人工的方法将空气中游离的氮转变为化合态的氮的方法。
下列过程中属于人工固氮的是( )
A. 氮气和氢气在一定条件下反应生成氨气
B. 下雷阵雨时,在雷电作用下,空气中的氮气和氧气化合生成一氧化氮
C. 豆科植物的根瘤菌把空气中的氮气变成氮的化合物
D. 一氧化氮和氧气化合生成二氧化氮
8. (2016届南京中华中学模拟)下列反应的离子方程式错误的是( )
A. 铁与稀硫酸反应:Fe+2H+===Fe2++H2↑
B. 铜与浓硝酸反应:Cu+2NO-3+4H+===Cu2++2NO2↑+2H2O
C. 碳酸钙跟稀盐酸反应:CO2-3+2H+===CO2↑+H2
D. 铁与氯化铁溶液反应:Fe+2Fe3+===3Fe2+
9. (2016届金陵中学模拟)为了更简便制取干燥氨气,下列方法中合适的是 ( )
A. NH4Cl和H2SO4(浓)混合加热,生成的气体用碱石灰干燥
B. N2+H2―→NH3,用烧碱干燥
C. 加热浓氨水,气体用碱石灰干燥
D. 加热NH4HCO3,气体用浓硫酸干燥
10. (2017届扬州新华中学模拟)某氮肥样品可能含有NH4HCO3、NH4Cl、NH4NO3中的一种或几种。
称取该样品0.500 0 g,溶解配成100.00 mL溶液,加过量浓NaOH溶液,加热,将产生的氨气通入60.00 mL 0.100 0 mol·L-1的H2SO4溶液中(设产生的NH3全部逸出),剩余的H2SO4溶液能消耗20.00 mL 0.225 0 mol·L-1的NaOH溶液。
下列说法正确的是( )
A. 吸收NH3消耗的H2SO4为6.000×10-3 mol
B. 上述过程共产生NH3 268.8 mL
C. 该样品中NH+4的质量分数为43.2%
D. 该氮肥样品必含NH4Cl
11. (2018届镇江一中模拟)1.52 g铜镁合金完全溶解于50 mL 密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。
下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2∶1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
12. (2018届无锡一中模拟)设空气中O2的体积分数为0.2,N2的体积分数为0.8。
在有水存在的条件下,某氮的氧化物(NO与NO2形成的混合物)和一定量空气混合恰好完全反应生成硝酸,反应后气体体积减小了一半(相同条件下)。
则该氮的氧化物中NO与NO2的体积比可能是( )
A. 1∶5
B. 1∶4
C. 1∶3
D. 任意比
第十一讲氮及其化合物1. D 2. C 3. C 4. C 5. A 6. C7. A8. C 9. C10. D11. D12. A。