(新课标)2018届高考化学大一轮复习专题讲座四五大平衡常数课件
- 格式:ppt
- 大小:1.53 MB
- 文档页数:35





授课主题化学平衡常数、转化率及反应方向的推断教学目的能够写出化学平衡常数的表达式;可以计算出物质的平衡转化率;教学重难点推断反应是否达到平衡状态;反应物平衡转化率的变更推断;焓变、熵变及化学反应方向的关系教学内容本节学问点讲解1.化学平衡常数(1)定义在肯定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式对于一般的可逆反应:m A(g)+n B(g)p C(g)+q D(g),K=(C)(D) (A)(B)p qm nc cc c⋅⋅。
(3)应用①推断反应进行的限度K值大,说明反应进行的程度大,反应物的转化率高。
K值小,说明反应进行的程度小,反应物的转化率低。
K <10−510−5~105>105反应程度很难进行反应可逆反应可接近完全②推断反应是否达到平衡状态化学反应a A(g)+b B(g)c C(g)+d D(g)在随意状态时,浓度商均为Q c=(C)(D) (A)(B)c da bc cc c⋅⋅。
Q c>K时,反应向逆反应方向进行;Q c=K时,反应处于平衡状态;Q c<K时,反应向正反应方向进行。
③利用平衡常数推断反应的热效应若上升温度,K值增大,则正反应为吸热反应;若上升温度,K值减小,则正反应为放热反应。
2.转化率对于一般的化学反应:a A+b B c C+d D,达到平衡时反应物A的转化率为α(A)=A AA的初始浓度-的平衡浓度的初始浓度×100%=0(A)(A)(A)c cc×100%[c0(A)为起始时A的浓度,c(A)为平衡时A的浓度]反应物平衡转化率的变更推断推断反应物转化率的变更时,不要把平衡正向移动与反应物转化率提高等同起来,要视详细状况而定。
常见有以下几种情形:反应类型条件的变更反应物转化率的变更有多种反应物的可逆反应m A(g)+n B(g)p C(g)+q D(g) 恒容时只增加反应物A的用量反应物A的转化率减小,反应物B的转化率增大同等倍数地增大(或减小)反应物A、B的量恒温恒压条件下反应物转化率不变恒温恒容条件下m+n>p+q反应物A和B的转化率均增大m+n<p+q反应物A和B的转化率均减小m+n=p+q反应物A和B的转化率均不变只有一种反应物的可逆反应m A(g)n B(g)+p C(g) 增加反应物A的用量恒温恒压条件下反应物转化率不变恒温恒容条件下m>n+p反应物A的转化率增大m<n+p反应物A的转化率减小m=n+p反应物A和B的转化率不变3.化学反应进行的方向一、自发过程1.含义在肯定条件下,不须要借助外力作用就能自动进行的过程。
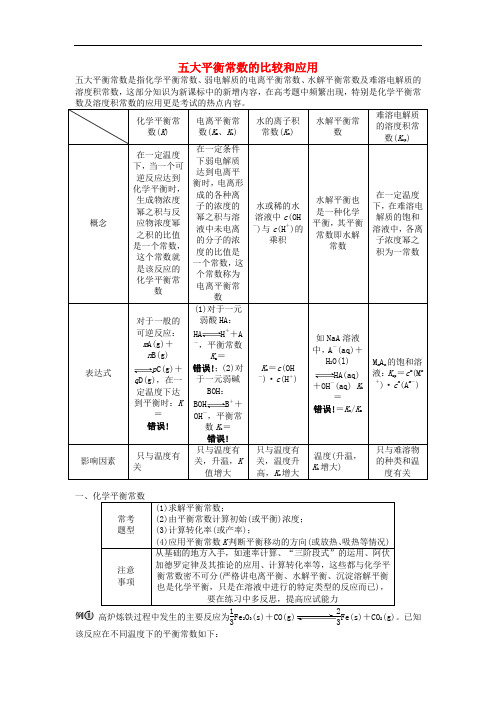
五大平衡常数的比较和应用 五大平衡常数是指化学平衡常数、弱电解质的电离平衡常数、水解平衡常数及难溶电解质的溶度积常数,这部分知识为新课标中的新增内容,在高考题中频繁出现,特别是化学平衡常数及溶度积常数的应用更是考试的热点内容。
化学平衡常数(K ) 电离平衡常数(K a 、K b ) 水的离子积常数(K w ) 水解平衡常数 难溶电解质的溶度积常数(K sp )概念 在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数 在一定条件下弱电解质达到电离平衡时,电离形成的各种离子的浓度的幂之积与溶液中未电离的分子的浓度的比值是一个常数,这个常数称为电离平衡常数水或稀的水溶液中c (OH -)与c (H +)的乘积 水解平衡也是一种化学平衡,其平衡常数即水解常数 在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数 表达式 对于一般的可逆反应:m A(g)+n B(g) p C(g)+q D(g),在一定温度下达到平衡时:K =错误! (1)对于一元弱酸HA :HA H ++A -,平衡常数K a =错误!;(2)对于一元弱碱BOH :BOH B ++OH -,平衡常数K b =错误!K w =c (OH -)·c (H +) 如NaA 溶液中,A -(aq)+H 2O(l) HA(aq)+OH -(aq) K h =错误!=K w /K a M m A n 的饱和溶液:K sp =c m (M n+)·c n (A m -) 影响因素 只与温度有关 只与温度有关,升温,K 值增大 只与温度有关,温度升高,K w 增大 温度(升温,K h 增大) 只与难溶物的种类和温度有关一、化学平衡常数常考 题型 (1)求解平衡常数;(2)由平衡常数计算初始(或平衡)浓度;(3)计算转化率(或产率);(4)应用平衡常数K 判断平衡移动的方向(或放热、吸热等情况)注意 事项 从基础的地方入手,如速率计算、“三阶段式”的运用、阿伏加德罗定律及其推论的应用、计算转化率等,这些都与化学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶解平衡也是化学平衡,只是在溶液中进行的特定类型的反应而已),要在练习中多反思,提高应试能力高炉炼铁过程中发生的主要反应为13Fe 2O 3(s)+CO(g)23Fe(s)+CO 2(g)。
2018年全国卷高考化学复习专题突破《四大平衡常数》一、水的离子积常数1.水的离子积常数的含义H 2O ⇋H ++OH -表达式:25 ℃时,K w =c (H +)·c (OH -)=1.0×10-14.2.对K w 的理解(1)K w 适用于纯水、稀的电解质(酸、碱、盐)水溶液.(2)恒温时,K w 不变;升温时,电离程度增大(因为电离一般吸热),K w 增大.二、电离平衡常数(K a 、K b )1.电离平衡常数的含义如对于HA ⇋H ++A -,K a =)A (H )A ()(H c c c -+∙;BOH ⇋B ++OH -,K b =(BOH))(OH )(B c c c -+∙. 2.K 值大小的意义相同温度下,K 值越小表明电离程度越小,对应酸的酸性或碱的碱性越弱.3.影响K 值大小的外因同一电解质,K 值只与温度有关,一般情况下,温度越高,K 值越大;此外对于多元弱酸来说,其K a 1≫K a 2≫K a 3.三、水解平衡常数(K h )1.水解平衡常数的含义A -+H 2O ⇋HA +OH -,达到平衡时有K h =)(A (HA))(OH -c c c ∙-=K w K a .同理,强酸弱碱盐水解平衡常数与弱碱电离平衡常数K b 的关系为K h =K w K b. 2.影响K h 的因素K h 值的大小是由发生水解的离子的性质与温度共同决定的;温度一定时,离子水解能力越强,K h 值越大;温度升高时,K h 值增大;对于多元弱酸阴离子或多元弱碱阳离子来说,其K h 1≫K h 2≫K h 3.四、溶度积常数(K sp )1.溶度积常数K sp 的表达式对于组成为A m B n 的电解质,饱和溶液中存在平衡A m B n (s)⇋m A n +(aq)+n B m -(aq),K sp =c m (A n +)·c n (B m -).2.影响K sp 大小的因素 对于确定的物质来说,K sp 只与温度有关;一般情况下,升高温度,K sp 增大.3.溶度积规则当Q c >K sp 时,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡;当Q c =K sp 时,溶液饱和,沉淀与溶解处于平衡状态;当Q c <K sp 时,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和.4.K sp 与物质溶解度的关系(1)对于组成形式相同的物质来说,K sp 越小,物质越难溶解或溶解度越小;组成形式(A m B n )不同的物质,K sp 越小且m +n 越小的物质越难溶.(2)K sp 的大小与沉淀转化的关系:组成形式相同的难溶物质,K sp 较大的沉淀易转化为K sp 较小的沉淀,但当二者K sp 相差不大时,反过来也可转化;对于组成形式(A m B n )不同的物质来说,一般情况下,K sp 较大且m +n 也较大的物质易转化为K sp 较小且m +n 也较小的物质。