江西省乐安一中高二化学 03氮、磷、氨和铵盐培优教案
- 格式:doc
- 大小:311.00 KB
- 文档页数:11


《氮和磷》化学教案一、教学目标1.了解氮和磷的物理性质和化学性质。
2.掌握氮和磷的化合物及其应用。
3.培养学生的实验操作能力和观察能力。
4.提高学生分析问题和解决问题的能力。
二、教学重点与难点1.教学重点:氮和磷的物理性质、化学性质及其化合物。
2.教学难点:氮和磷的化学性质及其化合物。
三、教学准备1.教具:氮气、磷、氮的化合物、磷的化合物、实验仪器等。
2.教学环境:实验室、多媒体设备。
四、教学过程1.导入新课(1)提问:同学们,你们知道空气中含量最多的气体是什么吗?(2)学生回答:氮气。
2.学习氮的物理性质(1)展示氮气:同学们,这就是氮气,它是一种无色无味的气体,密度比空气略小。
(2)引导学生观察氮气的物理性质:同学们,请观察氮气在实验中的表现,它不支持燃烧,也不与氧气反应。
3.学习氮的化学性质(1)讲解氮的化学性质:氮气在高温高压条件下可以与氧气反应氮的氧化物。
(2)展示实验:将氮气和氧气混合,加热至高温,观察的氮的氧化物。
4.学习氮的化合物(1)讲解氮的化合物:氮的化合物主要包括氮氧化物、氨、硝酸等。
(2)展示氮的化合物:展示氨水、硝酸等化合物,并简要介绍其性质和用途。
5.学习磷的物理性质(1)展示磷:同学们,这就是磷,它是一种白色固体,分为红磷和白磷两种同素异形体。
(2)引导学生观察磷的物理性质:同学们,请观察磷的物理性质,它可以在暗处发光,燃烧时产生大量白烟。
6.学习磷的化学性质(1)讲解磷的化学性质:磷在空气中容易氧化,燃烧时五氧化二磷。
(2)展示实验:将磷在空气中燃烧,观察的五氧化二磷。
7.学习磷的化合物(1)讲解磷的化合物:磷的化合物主要包括磷酸、磷酸盐等。
(2)展示磷的化合物:展示磷酸、磷酸盐等化合物,并简要介绍其性质和用途。
8.实验操作(1)分组实验:将学生分成若干小组,每组进行氮气和磷的实验操作。
(2)实验指导:教师指导学生进行实验操作,观察实验现象,记录实验结果。
(2)学生回答:氮和磷的物理性质、化学性质及其化合物。

江西省乐安一中高二化学 教案01 第一章 第一节 氮和磷【同步教育信息】一.教学内容:第一章 第一节 氮和磷1. 掌握氮分子的结构、性质。
2. 掌握NO NO 、2的重要性质。
3. 了解氮气的用途及氮的固定。
4. 掌握氮的氧化物及NO NO O 、与22的混合气体溶于水的计算。
5. 掌握磷及其化合物的结构与性质。
二. 重点、难点:1. 氮分子和磷的结构和性质。
2. NO NO O 、与22的混合气体溶于水的计算。
四. 知识分析:1. N 2的结构与性质的关系:N N N N N 2分子中有三个共价键,其电子式为,结构式为::::⋅⋅≡,其键能为946KJ mol /,大于氢分子,氧分子,氯分子的键能,所以氮分子结构很稳定,但在高温放电等条件下,氮分子获得了足够的能量,足以破坏两原子间的三个共价键时,能与H O 22、金属等发生化学反应。
从化合价上分析:203+-−−−−→−−−−−−←N N N 被氧化失电子被还原得电子 N H 223+23NHN O NO 222+放电 3232Mg N Mg N +点燃 N 2与其化合物之间的转化关系如下:高温、高压催化剂Mg N 323-N N O 202→+ N O H N O ++→4253 N H -33 N O 242. 磷的结构与性质的关系:磷原子的最外层有5个电子,在反应中能得到3个电子,表现非金属性,可以与氧、卤素及许多金属直接化合。
452225P O P O +点燃232232P Cl PCl Cl +点燃(不足) 252252P Cl PCl Cl +点燃(充足) 磷的非金属性比氮弱,也比硫、氯弱。
白磷和红磷性质的差异:白磷与红磷的结构不同,白磷为正四面体结构,记作P 4,红磷的结构比较复杂,导致两者的性质不同:如白磷有剧毒,不溶于水,但能溶于CS 2,着火点为40 C ;红磷无毒,不溶于水和CS 2,着火点为240 C 。
磷及其化合物的转化关系图:PCl 3 ←→→P P O H PO 2534 Ca PO 342() PCl 5Ca H PO ()242【典型例题】[例1] 已知氮化镁(Mg N 32)与水反应的化学方程式为Mg N H O Mg OH NH 32223632+=↓+↑(),试写出氮化镁溶于盐酸的化学方程式。

高中化学-高二氨、铵盐(第二课时)教案【教学目标】1.了解氨的基本性质和制备方法。
2.掌握铵盐的定义、分类及常见的制备方法。
3.能够运用所学知识解决相关的实际问题。
【教学重点与难点】1.重点:氨的基本性质和制备方法;铵盐的定义、分类及常见的制备方法。
2.难点:铵盐的定性分析及相关实际问题的解决。
【课前自学】1.了解氨的基本性质和制备方法:(1)氨的基本性质:氨是一种气体,无色、有刺激性气味。
它具有碱性,能和酸反应,生成相应盐和水。
具有利于与酰化、缩合和加成等化学反应活泼性。
(2)制备方法:1)优化剩余法:在制造合成氨时,把气态氨直接吸收在水或者稀烷基硫酸溶液中,生成氨水或者氨磺酸。
2)碳酸氢铵分解法:碳酸氢铵加热分解制备氨的方法,是实验室制备氨气体的基本方法。
3)萘基硫腙合成氨法:在高温高压下,用萘基硫腙(或叫为构造同异构体)合成氨。
(3)氨的用途:作为化学工业原料和合成物等,用于制作化肥、冰箱制冷和医药工业等多方面。
2.掌握铵盐的定义、分类及常见的制备方法:(1)定义:铵盐是一类化学物质,由铵离子和阴离子组成。
作为一种重要的化学物质,在工业和生活中有广泛的应用。
(2)分类:铵盐可分为无机铵盐和有机铵盐两种。
无机铵盐是由氨和氢氧化物、酸等反应制成的,有机铵盐是由有机物与氨反应得到的。
(3)常见的制备方法:1)由碳酸铵和酸反应生成,其中较常用的是盐酸、硫酸等。
2)在有机化合物含有氨基的基础上,通过氨和其反应生成有机铵盐。
3)氨水和一些阴离子化合物反应,生成相应的无机铵盐。
【课堂授课】1.复习提问:上一节课所学的内容。
2.认识氨:(1)性质:气体,无色、气味刺激,具有碱性,能和酸反应。
(2)制备方法:碳酸氢铵分解法。
(3)用途:作为化学工业原料和合成物等,用于制作化肥、冰箱制冷和医药工业等多方面。
3.认识铵盐:(1)定义:铵盐是一种由铵离子和阴离子组成的化合物。
(2)分类:铵盐可分为无机铵盐和有机铵盐两种。

2023年高二化学教案氨、铵盐(第一课时)(精选3篇)一、教学目标1. 知识目标:了解氨的性质及制备方法;掌握铵盐的命名及化学式的写法。
2. 能力目标:能够通过实验观察和实验数据分析归纳氨和铵盐的性质及制备方法。
3. 情感目标:培养学生良好的实验观察能力和实验数据处理能力,增强学生对化学实验的兴趣与探索精神。
二、教学重难点1. 教学重点:氨的性质及制备方法。
2. 教学难点:铵盐的命名及化学式的写法。
三、教学准备实验仪器:百页滤纸、蒸馏装置、小瓶、试管等。
实验药品:氨水、盐酸、氯化铵、硝酸铵等。
四、教学过程Step 1 引入新课1. 教师通过引入一些实际生活中与氨和铵盐相关的例子,如氨水的应用、氯化铵的应用等,引起学生的兴趣。
2. 根据学生已有的知识,让学生展开思考,了解氨和铵盐的性质及制备方法可能涉及到的实验和实验设备。
Step 2 实验观察与实验讨论1. 实验一:氨的制备和性质观察(1)将一定量的氯化铵和氢氧化钙放入试管中并轻轻摇匀。
(2)用百页滤纸蘸取稀盐酸,然后对上方的试管进行装置,观察发生的化学反应及产物的性质。
2. 实验二:铵盐的制备和命名(1)将一定量的氯化铵和硝酸铵分别溶解在不同试管中。
(2)用试纸测定溶液的酸碱性。
(3)根据化合物的离子组成和化学式书写规则,写出两个化合物的化学式,并命名。
Step 3 实验结果分析与知识总结1. 分组讨论,学生根据实验观察结果,总结氨和铵盐的性质及制备方法,并写在黑板上。
2. 教师引导学生根据总结的知识,回答相关问题,如氨水的制备方法,铵盐的命名规则等。
五、课堂小结通过本节课的学习,我们了解了氨的性质及制备方法,掌握了铵盐的命名及化学式的写法。
同时,我们通过实验观察和数据分析,培养了实验观察和实验数据处理能力。
六、作业布置1. 完成课堂练习题。
2. 预习下节课内容:铵盐的化学反应及应用。
以上是2023年高二化学教案的第一课时内容,希望能对你有所帮助。

高中氮和磷化学优秀教案教学目标:
1. 了解氮和磷的基本性质和化合物;
2. 掌握氮和磷的常见化合物的命名和化学方程式的书写;
3. 了解氮和磷在生活中的应用;
4. 提高学生的实验技能和动手能力。
教学重点:
1. 氮的性质和化合物;
2. 磷的性质和化合物。
教学难点:
1. 氮的氧化物的性质和应用;
2. 磷的氧化物的性质和应用。
教学准备:
1. 实验器材:试管、烧杯、玻璃棒等;
2. 实验药品:氮气、氨水、磷酸等;
3. 讲义和教学课件。
教学过程:
一、引入(5分钟)
通过图片和实验现象引入氮和磷的话题,引起学生兴趣。
二、讲解氮和磷的性质(15分钟)
1. 讲解氮的性质、氮气的制备方法和应用;
2. 讲解磷的性质、磷的存在形式和化合物。
三、进行实验(25分钟)
1. 实验一:氮气的制备
2. 实验二:磷酸与氨水的反应
四、总结(5分钟)
总结本节课学习内容,强调氮和磷在生活中的应用和重要性。
五、作业布置(5分钟)
布置与氮和磷相关的练习题,培养学生的解决问题能力。
教学反思:
本节课通过实验的形式让学生更直观地了解氮和磷的性质和化合物,提高了学生的实验技
能和动手能力。
同时,引入氮和磷的应用和重要性,增强了学生对知识的理解和运用能力。
下节课可以通过案例分析或小组讨论的形式,进一步拓展学生的思维和沟通能力。

高二化学教案:《氮和磷》教学设计(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的学习资料,如语文资料、数学资料、英语资料、历史资料、地理资料、化学资料、生物资料、物理资料、政治资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of learning materials for everyone, such as language materials, mathematics materials, English materials, historical materials, geographic materials, chemical materials, biological materials, physical materials, political materials, other materials, etc. Please pay attention to the data format and writing method!高二化学教案:《氮和磷》教学设计[教学目标]1.知识目标(1)掌握氮族元素性质的相似性、递变性。

2023年高二化学教案氮和磷(第一课时)(精选3篇)教案一课题:氮和磷班级:高二化学时间:2023年教学目标:1. 理解氮和磷元素的性质和重要性;2. 掌握氮和磷的常见化合物及其应用领域;3. 培养学生对氮和磷的兴趣,并能够发现其在日常生活中的应用。
教学重点:1. 氮和磷元素的性质和重要性;2. 氮和磷的常见化合物及其应用领域。
教学难点:1. 氮和磷的重要性及其应用领域的理解;2. 学生对氮和磷的应用进行拓展和创新。
教学准备:1. 教材;2. PPT资料;3. 实验器材和化学试剂。
教学过程:Step 1:导入(5分钟)介绍氮和磷元素在化学中的重要性,引发学生对氮和磷的兴趣。
Step 2:知识讲解(30分钟)1. 氮的性质和重要性;2. 氮的常见化合物及其应用领域;3. 磷的性质和重要性;4. 磷的常见化合物及其应用领域。
Step 3:案例分析(15分钟)通过实际案例,让学生了解氮和磷的应用领域,例如农业、医药等。
Step 4:小组讨论(15分钟)分成小组,让学生自由讨论氮和磷在日常生活中的应用,并总结出来。
Step 5:实验展示(10分钟)进行一个简单的实验,展示氮和磷的一些化学反应,加深学生对氮和磷的理解。
Step 6:课堂总结(5分钟)回顾本节课的内容,强调氮和磷的重要性和应用领域,并鼓励学生在日常生活中发现更多的应用。
教学延伸:1. 班级集体出游时,可以观察和讨论氮和磷在旅游景点的应用;2. 鼓励学生开展科学实验或创新项目,探索氮和磷的新应用领域。
教案二课题:氮和磷班级:高二化学时间:2023年教学目标:1. 理解氮和磷元素的性质和周期表位置;2. 了解氮和磷的化合价和化合物类型;3. 掌握氮和磷常见化合物的制备方法和应用。
教学重点:1. 氮和磷元素的性质和周期表位置;2. 氮和磷的化合价和化合物类型;3. 氮和磷常见化合物的制备方法和应用。
教学难点:1. 学生对氮和磷的化合价和化合物类型的理解;2. 学生对氮和磷常见化合物的制备方法和应用进行探究。
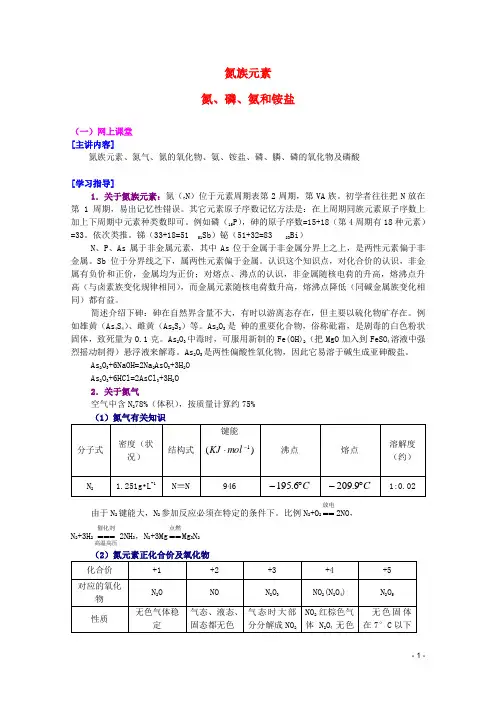
氮族元素 氮、磷、氨和铵盐(一)网上课堂 [主讲内容]氮族元素、氮气、氮的氧化物、氨、铵盐、磷、膦、磷的氧化物及磷酸[学习指导]1.关于氮族元素:氮(7N )位于元素周期表第2周期,第VA 族。
初学者往往把N 放在第1周期,易出记忆性错误。
其它元素原子序数记忆方法是:在上周期同族元素原子序数上加上下周期中元素种类数即可。
例如磷(15P ),砷的原子序数=15+18(第4周期有18种元素)=33。
依次类推。
锑(33+18=51 51Sb )铋(51+32=83 83Bi )N 、P 、As 属于非金属元素,其中As 位于金属于非金属分界上之上,是两性元素偏于非金属。
Sb 位于分界线之下,属两性元素偏于金属。
认识这个知识点,对化合价的认识,非金属有负价和正价,金属均为正价;对熔点、沸点的认识,非金属随核电荷的升高,熔沸点升高(与卤素族变化规律相同),而金属元素随核电荷数升高,熔沸点降低(同碱金属族变化相同)都有益。
简述介绍下砷:砷在自然界含量不大,有时以游离态存在,但主要以硫化物矿存在。
例如雄黄(As 4S 4)、雌黄(As 2S 3)等。
As 2O 3是 砷的重要化合物,俗称砒霜,是剧毒的白色粉状固体,致死量为0.1克。
As 2O 3中毒时,可服用新制的Fe(OH)2(把MgO 加入到FeSO 4溶液中强烈摇动制得)悬浮液来解毒。
As 2O 3是两性偏酸性氧化物,因此它易溶于碱生成亚砷酸盐。
As 2O 3+6NaOH=2Na 2AsO 3+3H 2O As 2O 3+6HCl=2AsCl 3+3H 2O 2.关于氮气空气中含N 278%(体积),按质量计算约75% (1)氮气有关知识由于N 2键能大,N 2参加反应必须在特定的条件下。
比例N 2+O 2放电==2NO , N 2+3H 2高温高压催化剂===2NH 3,N 2+3Mg 点燃==Mg 3N 2(2)氮元素正化合价及氧化物和NO气体 稳定,气体不稳定熔点°C -91 -163.5 -100.6 N 2O 4 -11.133.5 沸点°C-88.5-1523.5(分解)21.3升华3.关于NO 和NO 2一氧化氮和二氧化氮是氮的氧化物中最重要的两个氧化物,它们的分子中具有奇数价电子的分子,称奇分子。

“化学教案——氮和磷第一课时”一、教学目标1.了解氮和磷的物理性质和化学性质。
2.掌握氮和磷的用途及其在自然界和生活中的重要性。
3.培养学生的观察能力、实验能力和分析问题的能力。
二、教学重点与难点1.教学重点:氮和磷的物理性质和化学性质。
2.教学难点:氮和磷的反应原理及实验操作。
三、教学过程1.导入新课(1)提问:同学们,你们知道空气中含量最多的元素是什么吗?(2)学生回答:氮。
2.探究氮的物理性质(1)观察氮气样品,描述其颜色、状态、气味。
(2)教师提问:氮气在空气中有什么作用?(3)学生回答:氮气是空气的主要成分,约占空气体积的78%。
3.探究氮的化学性质(1)教师演示:将氮气与氧气混合,通过电火花引发反应,观察现象。
(2)学生观察:氮气与氧气反应淡蓝色的氮氧化物。
(3)教师提问:氮气在什么条件下可以与氧气反应?(4)学生回答:在高温、高压、催化剂的条件下,氮气可以与氧气反应。
4.探究磷的物理性质(1)观察磷的样品,描述其颜色、状态、硬度。
(2)教师提问:磷有什么用途?(3)学生回答:磷可以用来制造火柴、肥料、农药等。
5.探究磷的化学性质(1)教师演示:将磷与氧气混合,点燃引发反应,观察现象。
(2)学生观察:磷与氧气反应大量白烟。
(3)教师提问:磷在什么条件下可以与氧气反应?(4)学生回答:在点燃的条件下,磷可以与氧气反应。
(1)氮的用途:制造氮肥、氮氧化物、炸药等。
(2)磷的用途:制造火柴、肥料、农药等。
(3)氮和磷在自然界和生活中的重要性:氮是植物生长的必需元素,磷是人体骨骼、牙齿的主要成分。
7.课堂小结本节课我们学习了氮和磷的物理性质、化学性质及用途,了解了氮和磷在自然界和生活中的重要性。
希望大家能够将所学知识运用到实际生活中,为我国农业、工业、医药等领域的发展做出贡献。
8.作业布置(1)熟记氮和磷的物理性质、化学性质及用途。
(2)查阅资料,了解氮和磷在自然界和生活中的应用。
(3)完成课后练习题。

人教版高二《氮和磷》教学设计【教学目标】一、知识与能力:1.了解氮族元素性质的相似性和递变规律以及磷的性质;2.掌握氮气的化学性质(跟氢气、氧气的反应)。
3.培养学生能够运用元素周期律和原子结构理论指导元素化合物知识,培养学生的思维能力。
二、过程与方法教师提问学生回答、演示实验、使用多媒体三、情感态度与价值观通过氮族元素有关量变引起质变,以及氮气性质的相对稳定性等知识,对学生进行辩证唯物主义教育。
并通过汽车尾气对空气污染等有关知识对学生进行环境保护教育。
教师活动学生活动【复习、提问】氮气有哪些化学性质?【引导】NO和NO2对环境危害很大,是主要的大气污染物,对人、动物、植物、建筑物的危害很大。
【放录像】NO、NO2造成的日本东京和英语伦敦的化学烟雾事件,我国四川乐山大佛腐蚀变形,酸雨造【思考、回答】【看录像】成美国洛杉矶湖泊已无生物……(1分钟)【提问】看过录像有何感受?【强调】环境保护的重要性。
【追问】你认为防治氮的氧化物污染环境的关键是什么?【阅读指导】课本相关内容。
【放录像】介绍目前防治氮的氧化物污染的科技信息。
(1分钟)【指导阅读】课本有关氮气用途的内容【板书】3.氮气的用途【思考、回答】NO、NO2等一旦污染空气,人类将无法逃避,无处可藏。
为了我们的家园,为了人类自己,我们应从方方面面注意防止环境污染,保护环境。
【阅读、回答】氮的氧化物主要来源是化石燃料(煤、石油)的燃烧废气和未经处理的硝酸厂的废气,关键处理好废气和尾气。
【看录像】【阅读归纳】(1)做化工原料(2)做保护气(如保鲜苹果)(3)作冷冻剂(如超低温手术)【传看、观察】【引言】磷和氮一样是构成蛋白质的元素之一。
无论动物还是植物体内都含磷,它对维持动物体内正常的生理机能起着重要的作用。
【板书】二、磷【展示】红磷、白磷【讲解】这是两种磷的单质,磷像碳一样,它的单质也有多种同素异形体,其重要的【阅读、思考、记忆、回答】白磷和红磷在某些性质方面不同。
高二化学教案氮和磷(第一课时)(精选3篇)教案1:氮的化学性质和应用教学目标:1. 了解氮元素的化学性质;2. 掌握氮元素的主要化合物的结构和性质;3. 了解氮元素在农业、医药等方面的应用。
教学重点:1. 氮元素的化学性质;2. 氨、硝酸等氮元素的化合物的结构和性质;3. 氮元素在农业、医药等方面的应用。
教学难点:1. 氮元素的化学性质;2. 氨、硝酸等氮元素的化合物的结构和性质。
教学准备:教师:教学课件、实验装置和实验药品、氮元素的示意图;学生:学习笔记、化学实验器材、化学实验报告。
教学过程:Step 1 自主学习学生阅读教材上关于氮元素的相关知识,重点理解氮元素的化学性质和氮元素的主要化合物的结构和性质。
Step 2 讲解教师根据学生阅读的内容,对氮元素的化学性质进行讲解,重点将氨、硝酸等氮元素的化合物的结构和性质进行详细解释。
Step 3 实验教师进行氨的合成实验,通过此实验让学生进一步了解氨的性质和应用。
Step 4 总结教师引导学生对氮元素的化学性质和应用进行总结,并帮助学生进行相关习题的训练。
Step 5 课堂练习学生完成教师布置的课堂练习题,巩固所学知识。
Step 6 课后作业布置相关的课后作业,巩固所学内容。
教案2:磷的化学性质和应用教学目标:1. 了解磷元素的化学性质;2. 掌握磷元素的主要化合物的结构和性质;3. 了解磷元素在农业、医药等方面的应用。
教学重点:1. 磷元素的化学性质;2. 磷酸、磷酸盐等磷元素的化合物的结构和性质;3. 磷元素在农业、医药等方面的应用。
教学难点:1. 磷元素的化学性质;2. 磷酸、磷酸盐等磷元素的化合物的结构和性质。
教学准备:教师:教学课件、实验装置和实验药品、磷元素的示意图;学生:学习笔记、化学实验器材、化学实验报告。
教学过程:Step 1 自主学习学生阅读教材上关于磷元素的相关知识,重点理解磷元素的化学性质和磷元素的主要化合物的结构和性质。
2023年高二化学教案氨,铵盐(精选3篇)一、氨的性质及应用【教学目标】1. 了解氨的物理性质和化学性质;2. 理解氨的合成和提纯方法;3. 掌握氨的应用领域和相关注意事项。
【教学重点】1. 理解氨的物理性质和化学性质;2. 掌握氨的合成和提纯方法。
【教学难点】1. 理解氨的制备和提纯过程;2. 掌握氨的应用领域和相关注意事项。
【教学过程】【Step 1】引入引导学生回顾氨的基本性质,并提问:“氨具有什么性质?为什么氨有广泛的应用领域?”【Step 2】学习氨的性质1. 展示氨的物理性质和化学性质的实验现象和实验数据,引导学生观察实验现象和推理性质。
【Step 3】学习氨的制备和提纯1. 介绍氨的合成方法和提纯方法,例如:氨的合成可以通过氮气和氢气在高温高压条件下催化反应得到;氨的提纯可以通过溶解氨气于水中再除去杂质得到。
2. 对比讨论不同制备和提纯方法的优缺点,引导学生思考最适合的方法选择。
【Step 4】学习氨的应用和注意事项1. 介绍氨的应用领域,如制冷剂、合成纤维、消毒剂等。
2. 引导学生探究氨的应用中需要注意的安全问题和环保意识。
【Step 5】总结和拓展总结氨的物理性质和化学性质,以及氨的制备和应用领域,进一步展开相关氨的研究内容的拓展学习。
二、铵盐的性质和制备【教学目标】1. 了解铵盐的基本性质;2. 理解铵盐的制备方法;3. 掌握常见的铵盐的性质和应用。
【教学重点】1. 理解铵盐的性质和结构;2. 掌握铵盐的制备方法。
【教学难点】1. 理解铵盐的结构和性质的关系;2. 掌握铵盐的制备方法。
【教学过程】【Step 1】引入通过实验或观察引导学生思考:“你曾经接触过铵盐吗?它们有什么共同的特点?”【Step 2】学习铵盐的性质1. 介绍铵盐的基本性质,如溶解度、热稳定性等;2. 理解铵离子的结构和性质的关系,如铵盐易水解、易溶于水等。
【Step 3】学习铵盐的制备1. 介绍铵盐的制备方法,例如:通过酸和铵化合物反应得到;2. 引导学生探究铵盐制备过程中可能出现的问题和改进方法。
高二化学教案氨、铵盐(第一课时)(精选3篇)教案一:氨的性质与利用课时目标:1. 了解氨的性质、结构和制备方法;2. 掌握氨的用途和危害;3. 培养学生的实验操作能力。
教学重点:1. 氨的制备方法;2. 氨的性质。
教学难点:1. 氨的用途和危害。
教学准备:1. 氨水、氨气、含氨的溶液;2. 总结本课学习的内容。
教学过程:Step 1:导入新课(5分钟)老师可以通过出示一些与氨有关的图片,让学生思考并讨论这些图片可能与什么有关系,引发学生的兴趣。
Step 2:导入本课内容(5分钟)老师通过展示一段视频,让学生观察并思考视频中涉及的氨的性质和用途。
引导学生自己提出问题,比如:氨是如何制备的?氨有什么特性?氨有哪些用途?等等。
Step 3:学习氨的制备方法(15分钟)老师解释并演示氨的制备方法,如氨水的制备方法、氨气的制备方法等。
学生可以自己动手操作一些实验,来加深对氨的制备方法的理解。
Step 4:学习氨的性质(15分钟)老师通过展示一些实验现象,让学生观察并记录实验结果。
然后,通过学生的实验结果,引导学生总结氨的一些性质,比如氨的气味、溶解性、还原性等。
Step 5:探究氨的用途和危害(10分钟)通过师生互动,让学生回答氨的用途和危害,引导学生思考氨在生活中的重要性和危害性,并引导学生合理利用和保护氨资源。
Step 6:课堂小结(5分钟)教师总结本课学习的内容,并布置相关的作业,鼓励学生积极参与讨论和思考。
教案二:氨的实验观察与实验规律课时目标:1. 了解氨的实验观察现象;2. 探究氨的实验规律;3. 提高学生的实验操作能力。
教学重点:1. 探究氨的实验规律;2. 学习氨的实验操作技巧。
教学难点:1. 提高学生的实验操作能力。
教学准备:1. 氨水、硫酸铵、氨气、香蕉皮;2. 总结本课学习的内容。
教学过程:Step 1:导入新课(5分钟)老师可以通过出示一些氨的实验图片,让学生观察并思考这些实验可能涉及的氨的特性和实验规律,引发学生的兴趣。
2023年高二化学教案氮和磷(第二课时)(精选3篇)教案一:化学教学设计教学目标:1. 掌握氮和磷元素的基本性质和周期表上的位置。
2. 了解氮和磷的常见化合物及其用途。
3. 能够使用化学式表示氮和磷的化合物。
教学重点:1. 氮和磷元素的基本性质和周期表上的位置。
2. 氮和磷的常见化合物及其用途。
3. 化学式表示氮和磷的化合物。
教学难点:1. 理解氮和磷的周期表位置和性质的关系。
2. 掌握使用化学式表示氮和磷的化合物。
教学准备:1. PowerPoint 幻灯片。
2. 实验室用具和试剂。
教学过程:Step 1:导入通过回顾上节课的内容,引出本节课的主题。
Step 2:展示和讲解使用 PowerPoint 幻灯片展示氮和磷元素的基本性质和周期表上的位置。
讲解氮和磷的常见化合物及其用途。
Step 3:实验演示进行一些与氮和磷相关的实验演示,例如氨气制备、白磷的燃点等等。
通过实验展示氮和磷的一些特性。
Step 4:讨论和总结安排学生进行小组讨论,讨论氮和磷元素的性质和应用。
然后进行全班讨论,总结氮和磷的一些重要特点。
Step 5:练习提供一些练习题,让学生巩固所学知识。
Step 6:作业布置布置相关的作业,要求学生进一步巩固所学内容。
教学延伸:1. 组织学生进行项目研究,了解更多关于氮和磷的应用领域。
2. 对于学习成绩较好的学生,可以安排进一步的实验探究或者综合应用题。
教案二:高二化学第二课时教案教学目标:1. 掌握氮和磷的性质及其化合物的命名和化学式的书写方法。
2. 理解氮和磷在自然界中的分布和应用。
3. 培养学生的实践动手能力和创新思维。
教学重点:1. 氮和磷的性质及其化合物的命名和化学式的书写方法。
2. 理解氧化还原反应中氮和磷的应用。
教学难点:1. 理解氮和磷的性质与应用之间的关系。
2. 学生实验操作能力的培养。
教学准备:1. 实验器材和试剂。
2. PowerPoint 幻灯片。
3. 实验操作规程。
高中化学-高二氮和磷教案
一、教学目标:
1. 了解氮的特性、元素周期表上的位置和组成;
2. 掌握氮与其他元素的反应;
3. 了解磷的特性、元素周期表上的位置和组成;
4. 掌握氮和磷的化合物及其性质。
二、教学重点:
1. 氮的特性和氮的化合物的性质;
2. 磷的特性和磷的化合物的性质。
三、教学难点:
1. 氮化合物的分子结构;
2. 磷的还原特性。
四、教学过程
第一步:导入新课
引入本课新知,简要介绍氮和磷的概念及其在日常生活中的应
用。
第二步:氮的特性
1. 引导学生通过观察和实验,了解氮的特性及其重要性;
2. 介绍氮的元素周期表上的位置和化学符号。
第三步:氮的化合物
1. 介绍氮的常见化合物N2O、NH3、N2H4等的分子结构及其性质;
2. 分析N2O、NH3、N2H4等化合物的制备方法和应用。
第四步:磷的特性
1. 介绍磷的特性及其重要性;
2. 介绍磷在元素周期表上的位置。
第五步:磷的化合物
1. 介绍磷的常见化合物PH3、P4O6、P4O10等的分子结构及其性质;
2. 分析PH3、P4O6、P4O10等化合物的制备方法和应用。
第六步:课堂练习
1. 基于学生对氮和磷的掌握程度,进行有针对性的课堂练习;
2. 提高学生对氮和磷的理解和应用能力。
第七步:课堂总结
对此次课堂教学内容进行综合总结,提高学生对氮和磷的理解程度,加深对化学概念的认识。
氮、磷、氨和铵盐(一)网上课堂 [主讲内容]氮族元素、氮气、氮的氧化物、氨、铵盐、磷、膦、磷的氧化物及磷酸[学习指导]1.关于氮族元素:氮(7N )位于元素周期表第2周期,第VA 族。
初学者往往把N 放在第1周期,易出记忆性错误。
其它元素原子序数记忆方法是:在上周期同族元素原子序数上加上下周期中元素种类数即可。
例如磷(15P ),砷的原子序数=15+18(第4周期有18种元素)=33。
依次类推。
锑(33+18=51 51Sb )铋(51+32=83 83Bi )N 、P 、As 属于非金属元素,其中As 位于金属于非金属分界上之上,是两性元素偏于非金属。
Sb 位于分界线之下,属两性元素偏于金属。
认识这个知识点,对化合价的认识,非金属有负价和正价,金属均为正价;对熔点、沸点的认识,非金属随核电荷的升高,熔沸点升高(与卤素族变化规律相同),而金属元素随核电荷数升高,熔沸点降低(同碱金属族变化相同)都有益。
简述介绍下砷:砷在自然界含量不大,有时以游离态存在,但主要以硫化物矿存在。
例如雄黄(As 4S 4)、雌黄(As 2S 3)等。
As 2O 3是 砷的重要化合物,俗称砒霜,是剧毒的白色粉状固体,致死量为0.1克。
As 2O 3中毒时,可服用新制的Fe(OH)2(把MgO 加入到FeSO 4溶液中强烈摇动制得)悬浮液来解毒。
As 2O 3是两性偏酸性氧化物,因此它易溶于碱生成亚砷酸盐。
As 2O 3+6NaOH=2Na 2AsO 3+3H 2O As 2O 3+6HCl=2AsCl 3+3H 2O 2.关于氮气空气中含N 278%(体积),按质量计算约75% (1)氮气有关知识由于N 2键能大,N 2参加反应必须在特定的条件下。
比例N 2+O 2放电==2NO , N 2+3H 2高温高压催化剂===2NH 3,N 2+3Mg 点燃==Mg 3N 2(2)氮元素正化合价及氧化物熔点°C -91 -163.5 -100.6 N 2O 4 -11.133.5 沸点°C-88.5-1523.5(分解)21.3升华2一氧化氮和二氧化氮是氮的氧化物中最重要的两个氧化物,它们的分子中具有奇数价电子的分子,称奇分子。
(1)实验室制法及性质3Cu+8HNO 3(稀)∆==3Cu(NO 3)2+2NO ↑+4H 2ONO 近似不溶于水,不与水反应。
NO 极易被O 2氧化(2NO+O 2=2NO 2),所以只用排水取气法收集NO 。
NO 是空气的污染物,它使人和动物中毒,中毒的原因是,NO 与血红蛋白结合,使血携氧能力降低,造成组织缺氧,脑缺氧,心脏缺氧危及生命。
Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2ONO 2溶于水,而且跟水发生歧化反应3NO 2+H 2O=2HNO 3+NO ,所以NO 2只能用向上排空气法收集。
NO 2是有刺激性气味有毒的气体,它使人中毒的原因是:刺激呼吸器官,引起肺部病变,使人生病甚至死亡。
NO 2是红棕色气体,在低温时易聚合成二聚体N 2O 4。
N 2O 4 2NO 2,温度在140C ︒以上N 2O 4全部成变NO 2,超过C ︒150,NO 2发生分解2NO 2 C︒===1502NO+O 2(2)自然界中氮的循环氮分子键能大,一般条件下不参加反应,但给它足够能量,比如高温、高压,放电条件下,N 2也能参加反应。
在氮族元素这章开篇,第一个内容就是一副图,图的内容是大气中氮参与的自然循环。
自然现象中的雷电,使NO O N 222放电==+,2NO+O 2=2NO 2,3NO 2+H 2O=2HNO 3+NO ,HNO 3在土址中形成硝酸盐,被植物吸收,生成蛋白质,动物食用蛋白质,给动物以活力,动物死了,植物、动物遗体腐烂,被微生物分解,又生成N 2,回归自然,周而复始,大气中的N 2含量基本不变。
(3)关于光化学污染大气中NOx 浓度达一定程度时,如果还有碳氢化合物,硫氧化合物等存在,受强烈的太阳紫外线照射后产生一种新的二次污染物——光化学烟雾。
在复杂的光化学反应中,主要生成光化学氧化剂(O 3)及其他复杂的化合物,统称为光化学烟雾。
4.氨和铵盐关于氨和铵盐(教材上是第二节)教材内容写得很清楚,在网上教学第一讲和第二讲中有关氨分子结构,氨分子间的氢键,氨易溶于水与水分子之间产生的氨键,已经交待清楚,不再重述。
下面谈几点学习氨时的注意地方。
(1)实验室制氨气,是用铵盐(除去NH 4NO 3)与廉价碱Ca(OH)2为原料加热,发生离子互换型的复分解反应,产生氨气。
但不可写离子方程式。
原因是:利用固体中的湿存水发生离子交换反应,而不是在溶液中的离子碰撞型的反应。
收集NH 3只用向下排气不能用排水法。
(2)氨的喷泉实验,在常压下进行,看成是一体积水溶解一体积氨(不管液体充满或没充满烧瓶),氨水不扩散到烧杯中,氨水的物质的量浓度都为L mol 4.221,即0.045mol ·L -1。
在我们所示的气体中,NH 3在水中溶解度最大,常温常压下,1:700溶于水(1—指水的-9°C~140°体积,700—指NH 3体积,与体积比浓度恰好相反。
1:4稀H 2SO 4,1—指浓H 2SO 4体积,4—指水的体积),用下列方程式表示:NH 3+H 2O ⇌O H NH 23⋅⇌NH 4++OH -但是计算氨水浓度时,溶质是NH 3,而不是主要成分 少量 少量NH 3·H 2O ,这是初学者最容易出错的地方。
还要注意,由于NH 3相对分子质量是17,水的相对分子质量是18,氨水浓度越大其氨水密度越小(其它溶液基本是浓度大密度也大。
)高二化学第四章要学习电解的电离,从化学概念上讲,氨水是混合物,但先从成分上讲,氨水主要成分是NH 3·H 2O ,可以把氨水看成是NH 3·H 2O 的水溶液,由于NH 3·H 2O 可以电离出少量的NH 4+和OH -,所以我们把NH 3·H 2O 叫一元弱碱。
而现在又没分离出纯净的NH 3·H 2O ,因此就把氨水叫弱碱。
氨水对金属有腐蚀性,所以把它盛在橡皮袋或陶瓷坛中。
(3)氨气的检验①用湿的红色石蕊试纸,能使这条试纸变蓝,就是氨气。
简写反应式:NH 3·H 2O ⇌ NH 3++OH -,OH -使石蕊变蓝。
在高中化学中只有NH 3一种气体溶于水,水溶液呈碱性。
②从空中生白烟的实验现象,蘸有浓氨水和浓盐酸(浓HNO 3也有这种现象)玻棒靠近别接触。
玻棒周围生成大量白烟。
③氨气的干燥,要用碱性干燥剂,如碱石灰(NaOH 和CaO 的混合物)、CaO 、Ca(OH)2、NaOH 等都可以。
但不许用中性干燥剂CaCl 2,CaCl 2能大量吸收NH 3。
(4)氨气的还原性教材上是用4NH 3+5O 2催化剂∆===4NO+6H 2O 来讲NH 3的还原性的。
原因是这个反应叫氨的催化氧化,是制硝酸的主要一步反应。
氨中氮为-3价,还原性是它主要性质之一,以后你们会遇到:2NH 3+3Cl 2=N 2+6HCl ,2NH 3+3CuO ∆=3Cu+N 2+3H 2O 等等。
你们不要忘记:“H 3N ”,氨分子中有孤电子对它会形成稳定的络合分子或离子。
氨也是空气的污染物(5)铵盐—NH 4+与酸根离子构成的化合物。
铵盐都是晶体,都易溶于水,热稳定性不好,易分解。
NH 4Cl ∆=NH 3↑+HCl ↑(NH 3和HCl 在气相中相遇,又发生NH 3+HCl=NH 4Cl 反应,习惯叫NH 4Cl 的假升华)NH 4HCO 3∆=NH 3↑+CO 2↑+H 2O 。
(NH 4)2CO ∆=2NH 3↑+CO 2↑+H 2O 。
但要注意(NH 4)2SO 4和NH 4NO 3分解是属于氧化还原反应。
例如:O H HNO N O N H N 2323543245++↑=∆+-(还有其他类的氧化还原反应)。
246243)(3N O S H N ∆+-=O H NH SO 232643+↑+↑+↑。
铵盐都能跟碱反应,产生氨气,这是实验室制NH 3的依据。
5.磷 膦(PH 3) 五氧化二磷(1)书上介绍了白磷和红磷是磷元素的两种重要同素异形体,不重述。
白磷分子结构已经被公认为:4个P 原子构成空心正四面体形分子,键角C ︒60。
从这节课以后,你要学会计算,共价分子中,共价单键数。
例如在白磷(P 4)分子中,每个P 原子以3个单电子成键,共用1243=⨯个单电子,每2个电子成一条单键,6212=条单键,所以1molP 4中有6molP-P 键。
红磷结构尚无统一认识。
通过白磷 红磷,或者白磷红磷燃烧的唯一产物是P 2O 5,可以证明它们是由同一种元素形成的两种单质。
红磷的化学性质比N 2活泼(是由于N 2键能大)在点燃条件下顺利与O 2(生成P 2O 5),与Cl 2(生成PCl 3—常温为液体,或PCl 5—常温为白色固体)反应。
白磷表面发黄,所以也叫黄磷。
白磷缓慢氧化,在暗处看到黄色光(过去曾有人称鬼火),表面温度达到C ︒40便自燃,如何贮存自磷?(用水做保护液)白磷在浓碱中发生歧化反应放出PH 3。
21233240333O P KH H P O H KOH P +-∆+↑=++(次磷酸钾),白磷在Cl 2中能自燃,遇液氯或溴会爆炸。
不慎把白磷沾到皮肤上,可用CuSO 4溶液(0.2mol •L -1)冲洗。
(2)磷化氢(PH 3)称为膦大量的PH 3来源于白磷与碱的歧化反应。
磷化物与水反应也生成PH 3。
Ca 3P 2+6H 2O=3Ca(OH)2+2PH 3↑PH 3与NH 3相似,是三角锥形分子︒=∠93HPH ,它是一种无色剧毒有类似大蒜臭味的气味。
在水中溶解度比NH 3小得多,碱性比氨水弱。
(3)五氧化二磷和磷酸P 2O 5溶在冷水中生成偏磷酸P 2O 5+H 2O (冷)=2HPO 3;溶解在热水中生成磷酸P 2O 5+3H 2O 加热===2H 3PO 4。
P 2O 5吸湿性很强,所以常作干燥剂用。
磷酸是用磷矿石[Ca 3(PO 4)2]与浓硫酸反应制取的。
Ca(PO 4)2+3H 2SO 4(浓)=3CaSO 4↓+2H 3PO 4。
H 3PO 4是中等强度的三元酸,与碱作用,能生成一种正盐,两种酸式盐。
[例题精析]1.将一个充满NO 的试管倒扣于水槽中,然后向试管中通入一定量的O 2,试管中恰好充满液体时,则通入的O 2与原NO 气体的体积比为___________。
假若生成的溶质不向外扩散,且为标准状况,则所得的溶液的物质的量浓度是多少?分析:向NO 中通入O 2,发生反应2NO+O 2=2NO 2①,3NO 2+H 2O=2HNO 3+NO ②为了推导出NO 与HNO 3的计算关系,把中间产物NO 2约去,所以把①3⨯+②2⨯得到方程式③4NO+3O 2+2H 2O=4HNO 3 L 4.224⨯ 4molC(HNO 3)=1045.04.2214.2244-⋅==⨯L mol L molL mol注意:此题的反应条件是——向倒扣水中盛满一试管NO 中通入O 2。