高中化学选修三几种典型晶体晶胞结构模型总结
- 格式:doc
- 大小:350.00 KB
- 文档页数:5


学生版:典型晶体模型
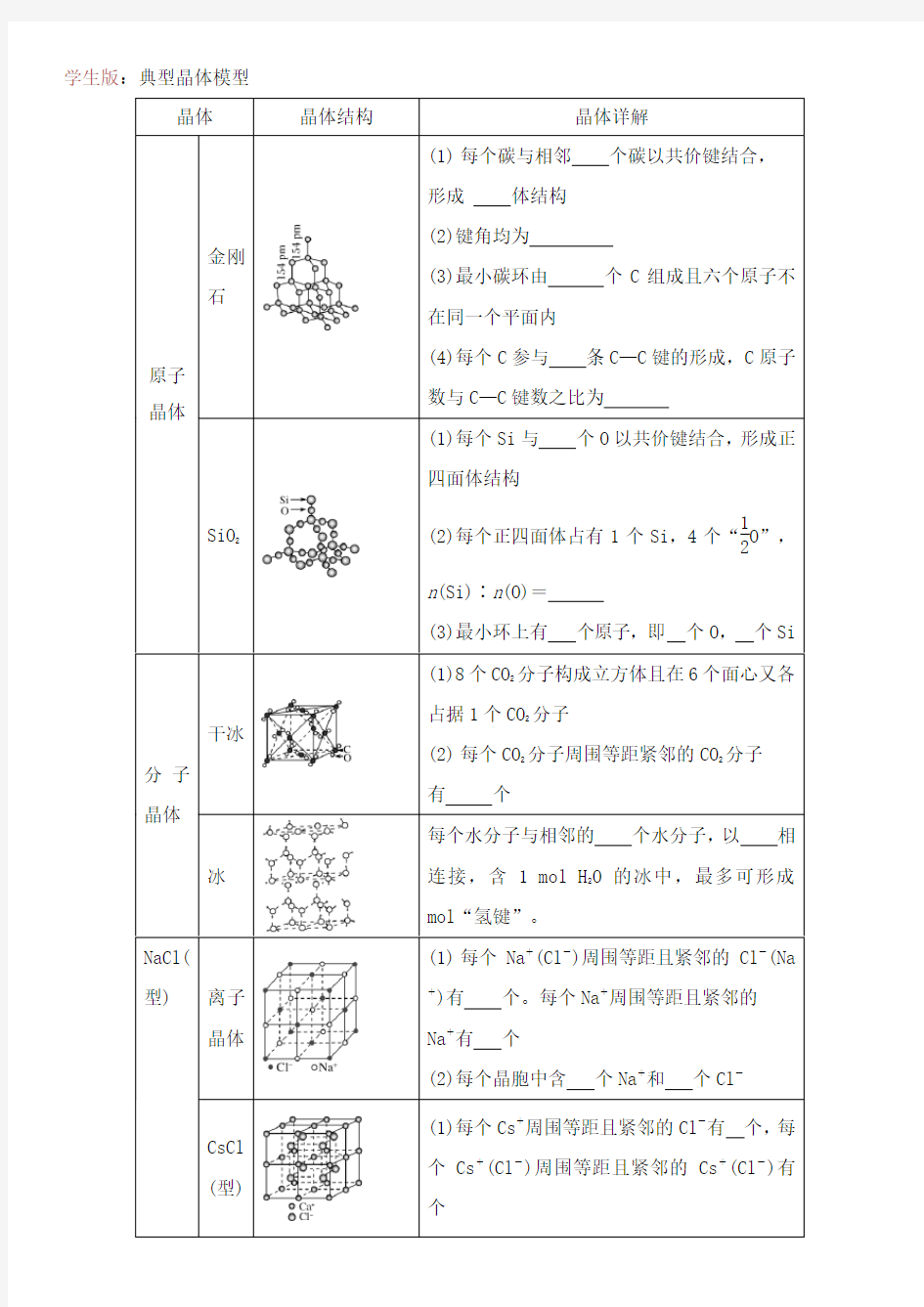
晶体晶体结构晶体详解
原子晶体金刚
石
(1)每个碳与相邻个碳以共价键结合,
形成体结构
(2)键角均为
(3)最小碳环由个C组成且六个原子不
在同一个平面内
(4)每个C参与条C—C键的形成,C原子
数与C—C键数之比为
SiO
2
(1)每个Si与个O以共价键结合,形成正
四面体结构
(2)每个正四面体占有1个Si,4个“
1
2
O”,
n(Si)∶n(O)=
(3)最小环上有个原子,即个O,个Si
分子晶体干冰
(1)8个CO
2
分子构成立方体且在6个面心又各
占据1个CO
2
分子
(2)每个CO
2
分子周围等距紧邻的CO
2
分子
有个
冰
每个水分子与相邻的个水分子,以相
连接,含 1 mol H
2
O的冰中,最多可形成
mol“氢键”。
NaCl(
型)离子
晶体(1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na +)有个。每个Na+周围等距且紧邻的
Na+有个
(2)每个晶胞中含个Na+和个Cl-
CsCl (型)(1)每个Cs+周围等距且紧邻的Cl-有个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-)有个
(2)如图为个晶胞,每个晶胞中含个Cs +、个Cl-
金属晶体简单
六方
堆积
典型代表Po,配位数为,空间利用率52%
面心
立方
最密
堆积
又称为A
1
型或铜型,典型代表,配位
数为,空间利用率74%
体心
立方
堆积
又称为A
2
型或钾型,典型代表,配位
数为,空间利用率68%
六方
最密
堆积
又称为A
3
型或镁型,典型代表,配位
数为,空间利用率74%
混合晶体石墨(1)石墨层状晶体中,层与层之间的作用是
(2)平均每个正六边形拥有的碳原子个数是,C原子采取的杂化方式是
(3)每层中存在σ键和π键,还有金属键
(4)C—C的键长比金刚石的C—C键长,熔点比金刚石的
(5)硬度不大、有滑腻感、能导电
教师版典型晶体模型
晶体晶体结构晶体详解
原子晶体金刚
石
(1)每个碳与相邻4个碳以共价键结合,形成
正四面体结构
(2)键角均为109°28′
(3)最小碳环由6个C组成且六个原子不在同
一个平面内
(4)每个C参与4条C—C键的形成,C原子数
与C—C键数之比为1∶2
SiO
2
(1)每个Si与4个O以共价键结合,形成正四
面体结构
(2)每个正四面体占有1个Si,4个“
1
2
O”,
n(Si)∶n(O)=1∶2
(3)最小环上有12个原子,即6个O,6个Si
分子晶体干冰
(1)8个CO
2
分子构成立方体且在6个面心又各
占据1个CO
2
分子
(2)每个CO
2
分子周围等距紧邻的CO
2
分子有12
个
冰
每个水分子与相邻的4个水分子,以氢键相连
接,含1 mol H
2
O的冰中,最多可形成2 mol“氢
键”。
NaCl(型)离子
晶体
(1)每个Na+(Cl-)周围等距且紧邻的Cl-(Na+)
有6个。每个Na+周围等距且紧邻的Na+有12
个
(2)每个晶胞中含4个Na+和4个Cl-
CsCl (型)(1)每个Cs+周围等距且紧邻的Cl-有8个,每个Cs+(Cl-)周围等距且紧邻的Cs+(Cl-)有8个
(2)如图为8个晶胞,每个晶胞中含1个Cs+、1个Cl-
金属晶体简单
六方
堆积
典型代表Po,配位数为6,空间利用率52%
面心
立方
最密
堆积
又称为A
1
型或铜型,典型代表Cu、Ag、Au,
配位数为12,空间利用率74%
体心
立方
堆积
又称为A
2
型或钾型,典型代表Na、K、Fe,配
位数为8,空间利用率68%
六方
最密
堆积
又称为A
3
型或镁型,典型代表Mg、Zn、Ti,
配位数为12,空间利用率74%
混合晶体石墨(1)石墨层状晶体中,层与层之间的作用是范德华力(2)平均每个正六边形拥有的碳原子个数是2,C原子采取的杂化方式是sp2 (3)每层中存在σ键和π键,还有金属键
(4)C—C的键长比金刚石的C—C键长短,熔点比金刚石的高