水质 高锰酸盐指数的测定方法和注意事项(酸性法)
- 格式:doc
- 大小:58.00 KB
- 文档页数:3

高锰酸盐指数的测定实验报告一、实验目的1、掌握高锰酸盐指数的测定原理和方法。
2、熟练使用相关实验仪器进行测定操作。
3、了解高锰酸盐指数在水质评价中的意义和应用。
二、实验原理高锰酸盐指数是反映水体中有机和无机可氧化物质污染的常用指标。
在酸性条件下,水样中加入一定量的高锰酸钾溶液,加热反应一定时间,然后加入过量的草酸钠溶液还原剩余的高锰酸钾,再用高锰酸钾溶液回滴过量的草酸钠,通过计算消耗的高锰酸钾量来求得高锰酸盐指数。
化学反应式如下:4MnO₄⁻+ 5C + 12H⁺ → 4Mn²⁺+ 5CO₂+ 6H₂O2MnO₄⁻+ 5C₂O₄²⁻+ 16H⁺ → 2Mn²⁺+ 10CO₂+ 8H₂O三、实验仪器与试剂1、仪器酸式滴定管(50ml)移液管(10ml、25ml)锥形瓶(250ml)电热恒温水浴锅电子天平2、试剂高锰酸钾标准溶液(01mol/L):称取32g 高锰酸钾溶于12L 水中,加热煮沸,使体积减少到约 1L,放置过夜,用 G-3 玻璃砂芯漏斗过滤后,滤液贮存于棕色瓶中备用。
草酸钠标准溶液(01000mol/L):称取 06705g 经 105-110℃烘干2h 并冷却的草酸钠溶于水,移入 100ml 容量瓶中,用水稀释至标线,摇匀。
硫酸(1+3):将 1 体积浓硫酸缓缓加入 3 体积水中,混匀。
四、实验步骤1、水样采集与预处理采集具有代表性的水样,置于清洁的玻璃瓶中。
若水样中含有悬浮物质,需用中速定量滤纸过滤,滤液作为测定水样。
2、测定取 1000ml 经预处理的水样于 250ml 锥形瓶中。
加入 5ml(1+3)硫酸,摇匀。
用移液管准确加入 1000ml 001mol/L 高锰酸钾溶液,摇匀。
将锥形瓶放入沸水浴中加热 30min(从水浴重新沸腾起计时)。
取出锥形瓶,趁热加入 1000ml 00100mol/L 草酸钠标准溶液,摇匀。
此时溶液应为无色。
用001mol/L 高锰酸钾溶液滴定至溶液呈微红色,且30s 内不褪色,记录消耗的高锰酸钾溶液体积 V₁(ml)。

水质高锰酸盐指数的测定(酸性法)使用范围:适用于地表水、饮用水;不适用于工业废水。
一、原理样品中加入已知量的高锰酸钾和硫酸,使沸水浴中加热30mins,高锰酸钾将样品中某些有机物和无机还原性物质氧化,反应后加入过量的草酸钠还原剩余的高锰酸钾,再用高锰酸钾标准溶液回滴过量的草酸钠。
通过计算得到样品中高锰酸盐指数。
氧化反应:在沸水浴条件下,酸性高锰酸钾将还原性物质氧化。
5C2O42-(草酸钠)+2MnO4-+16H+→2Mn2++10CO2+8H2O二、测试流程三、注意事项1、水样保存采集水样后,加浓硫酸至pH1-2,尽快分析。
保存时间超过6h,需冷藏(0-5℃),但不超过2天。
2、实验条件①消解:沸水浴温度为98℃,高原地区沸点偏低,可能影响消解效率,须注明实际沸点(相同条件下,100℃时反应速率大概是95℃的1.6倍)。
沸水浴水面需要高于锥形瓶内液面。
②反应时间:研究表明,消解时间从30增加到60mins时,结果增加4-10%。
反应需要严格控制时间,保持测试样品消解时间的一致性。
③条件电极电位E=Eθ+RT/5F·ln(a MnO4-·a H+8/a Mn2+)。
高锰酸钾溶液浓度变化对于反应有较大的影响。
④酸度对反应影响较小:硫酸溶液在反应体系中已算是浓电解质,离子间相互作用明显,硫酸浓度发生一定变化时,对于氢离子活度变化不大(离子活度受电解质浓度和离子活度影响,浓电解质溶液中浓度升高会引起活度下降)。
⑤空白滴定温度控制:当反应液温度低于80℃时,应重新加热后再滴定。
3、COD Cr和COD Mn的对比①COD所表示的是水体中受还原性物质污染的指标,主要是水体中受有机物污染的指标。
②COD的定量方法主要受氧化剂种类、浓度,消解温度、时间,酸度的影响。
COD Cr的条件电极电位能达到1.55V,对水体约有90%左右的氧化率;COD Mn的条件电极电位能达到1.45V,对水体约有50%左右的氧化率,COD Mn测试只适用于地表水、饮用水,不适用于COD值高的工业废水。

高锰酸盐指数测定原理
高锰酸盐指数是水质检测中重要的参数之一,其值反映了水样中有机物氧化分解的程度,从而判断水的生化需氧量。
本文将介绍高锰酸盐指数测定的原理。
1. 实验原理
高锰酸盐指数测定实验采用高锰酸钾在酸性条件下与有机物氧化分解的方法,由于高锰酸钾对有机物的氧化作用是区域性而非选择性的,所以其值并不直接反映有机物种类和数量,而是对有机物处理效果的一个指标。
2. 实验步骤
高锰酸盐指数实验的具体步骤如下:
(1)取1mL水样,加入50mL锰硫酸溶液,酸化至PH=4.
(2)用Na2C2O4溶液滴定至溶液颜色由紫色变为浅粉色,并记录滴定量.
(3)通过计算,求出高锰酸盐指数.
3. 结果计算
高锰酸盐指数计算公式为:
指数 = (C1 × V1 × 80) / V0
其中,C1为Na2C2O4溶液浓度,V1为滴定溶液体积,V0为取样体积.
4. 结果分析
高锰酸盐指数值越大,说明水中有机物含量较高,污染程度较重,处
理难度也相应增大;反之,若值较小,则说明水质较好,处理难度较低。
5. 注意事项
在高锰酸盐指数实验操作过程中,需注意以下事项:
(1)选用干净的容器及设备.
(2)精确称量所需试剂,并记录好滴定过程和溶液颜色变化.
(3)除去水样中悬浮物质和浮游生物后进行测试.
(4)实验操作过程中一定要佩戴防护手套、口罩、护目镜等。
6. 结论
高锰酸盐指数测定是水质检测中较为常用的方法之一,通过它可以了解水中有机物的污染程度,从而指导后期水处理工作。
在实验操作过程中需严格遵守安全操作规程,确保实验的准确性和安全性。

高锰酸盐指数(GB11892—1989)酸性法概述1.方法原理水样加入硫酸使呈酸性后,加入一定量的高锰酸钾溶液,并在沸水浴中加热反应一定的时间。
剩余的高锰酸钾,用草酸钠溶液还原并加入过量,再用高锰酸钾溶液回滴过量的草酸钠,通过计算求出高锰酸钾指数数值。
2.方法适用范围酸性法适用于氯离子含量不超过300mg/L的水样。
当水样的高锰酸盐指数数值超过5mg/L时,则酌情分取少量,并用水稀释后再测定。
3.水样的采集和保存水样采集后,应加入硫酸使pH调至< 2,以抑制微生物活动。
样品应尽快分析,必要时,应在0—5℃冷藏保存,并在48小时内测定。
4.仪器(1)沸水浴装置。
(2)250ml锥形瓶。
(3)50ml酸式滴定管。
(4)定时钟。
试剂(1) 高锰酸钾溶液(1/5KMnO4=0.1mol/L):称取3.2g高锰酸钾溶于1.2L水中,加热煮沸,使体积减少到约1L,放置过夜,用G-3玻璃砂芯漏斗过滤后,滤液贮于棕色瓶中保存。
(2) 高锰酸钾溶液(1/5KMnO4=0.01mol/L):吸取100ml上述高锰酸钾溶液,用水稀释至1000ml,贮于棕色瓶中。
使用当天应进行标定,并调节至0.01mol/L准确浓度。
(注:最好每次用完就换)(3) 1+3硫酸。
(4) 草酸钠标准溶液(1/2Na2C2O4=0.100mol/L):称取0.6705g在105--110℃烘干1小时并冷却的草酸钠溶于水,移入100ml容量瓶中,用水稀释至标线。
(5) 草酸钠标准溶液(1/2Na2C2O4=0.0100mol/L):吸取10.00ml上述草酸钠溶液,移入100ml容量瓶中,用水稀释至标线。
(注:草酸钠标准溶液现配现用)步骤(1)分取100ml混匀水样(如高锰酸钾指数高于5mg/L,则酌情少取,并用水稀释至100ml)于250ml锥形瓶中。
(2)试碱,使pH保持在6-8之间。
(3)加入5ml(1+3)硫酸,摇匀。
(4)加入10.00ml 0.01mol/L高锰酸钾溶液,摇匀,立刻放入沸水浴中加热30分钟(从水浴重新沸腾起计时)。

实验十一实验十一高锰酸盐指数的测定(酸性法)一、实验目的1. 掌握KMnO4溶液的配制方法2. 了解高锰酸盐指数测定的意义及表示方法3. 掌握高锰酸钾法测定高锰酸盐的原理和方法二、实验原理水样加入硫酸使呈酸性后,加入一定量的高锰酸钾溶液,并在沸水浴中加热反应一定时间,剩余的高锰酸钾,用草酸钠还原并加入过量,再用高锰酸钾溶液回滴过量的草酸钠,通过计算求出高锰酸盐指数。
显然,高锰酸盐指数是一个相对的条件性指标,其测定结果与溶液的酸度,高锰酸盐浓度加热温度和时间有关,因此,测定时一定要严格遵守操作规定,使结果具有可比性。
方法适用范围:酸性法适用于氯离子含量不超过300mg/L的水样,当水样的高锰酸盐指数值超过10mg/L时,则酌情分取少量水样,并用水稀释后再行测定。
水样的采集与保存:水样采集后,应加入硫酸使pH<2,以抑制微生物活动,样品应尽快分析,并在48小时内测定。
三、试剂和仪器一、仪器1、台秤2、分析天平3、量筒4、烧杯5、棕色试剂瓶6、100ml、250ml容量瓶7、电炉8、250ml锥形瓶9、移液管10、滴定管11、定时钟二、试剂:所用蒸馏水需加高锰酸钾重蒸馏1. 0.1mol/L KMnO4溶液:称取优级高锰酸钾1.6g,溶于500ml蒸馏水中,并在电炉上加热至刚沸,在稍低于沸点下加热半小时,取下冷却后,用微孔漏斗过滤,装入棕色瓶中于暗处放置。
2. 0.01mol/L KMnO4溶液:吸取上述0.1mol/L KMnO4溶液25ml于250ml 容量瓶中,用水稀释至刻度,混匀备用。
3. (1:3)H2SO4:取比重为1.84的浓硫酸慢慢加入到盛有3体积蒸馏水的烧杯中,搅匀后,滴加0.01 mol/L高锰酸钾溶液呈浅红色,若红色褪去应再补加至浅红色不褪去为至,转入试剂瓶中。
4. 0.01000 mol/L Na2C2O4:准确称取0.1676g Na2C2O4于烧杯中,加入约10ml蒸馏水溶解,加热至刚冒热气,转移至250ml容量瓶中定容四、实验步骤:1、吸取混匀水样100.0ml(如高锰酸盐指数高于10mg/L,则酌情少取,并用水稀释至100.0ml)于250ml锥形瓶中。


高锰酸盐指数测定方法计算公式的修正高锰酸盐指数是反应水中有机和无机可氧化物质污染的常用指标。
高锰酸盐指数是指水样中的部分有机物和无机还原性物质在一定条件下被高锰酸钾氧化,收集消耗的高锰酸钾量,计算出氧的当量。
高锰酸盐指数不作为理论需氧量或总有机物含量的指标,因为在规定的条件下,很多有机物只能被部分氧化,挥发性有机物不计入测定值。
一、实验目的1.掌握酸性法测定高锰酸盐指数的原理和方法。
2.掌握滴定管的使用方法。
3.学会滴定终点的判断。
二、实验原理样品中加入已知量的高锰酸钾和硫酸,在沸水浴中加热30min,高锰酸钾将样品中的某些有机物和无极还原性物质氧化,反应后加入过量的草酸钠还原剩余的高锰酸钾,再用高锰酸钾标准溶液回滴过量的草酸钠,通过计算得到样品中高锰酸盐指数。
三、实验仪器1.六孔水浴锅温度可调,功率足够。
2.酸式滴定管 25ml。
3.移液管、烧杯、锥形瓶等。
四、实验试剂不含还原性物质的水。
1.(1+3)硫酸溶液在不断搅拌下,将100ml浓硫酸(ρ=1.84g/ml)慢慢加入到300ml水中。
趁热加入数滴高锰酸钾溶液直至溶液出现粉红色。
2.氢氧化钠溶液,ρ=500g/L 称取50g氢氧化钠溶于水并稀释至100ml。
3.草酸钠标准贮备液,c(1/2 Na2C2O4)=0.100 0 mol/L 称取0.670 5 g经120℃烘干2 h并放冷的草酸钠(Na2C2O4)溶解水中,移入100 ml容量瓶中,用水稀释至标线,混匀,置4℃保存。
4.草酸钠标准溶液,c(1/2 Na2C2O4)=0.010 0 mol/L 吸取10.00 ml草酸钠贮备液于100 ml容量瓶中,用水稀释至标线,混匀。
5.高锰酸钾标准贮备液,c(1/5 KMnO4)=0.1 mol/L 称取3.2 g高锰酸钾溶解于水并稀释至1000m l。
于90~95℃水浴中加热此溶液两小时,冷却,存放两天后,倾出清液,贮于棕色瓶中。
6.高锰酸钾标准溶液,c(1/5 KMnO4)=0.01 mol/L 吸取100 ml高锰酸钾标准贮备液于1 000 ml容量瓶中,用水稀释至标线,混匀,此溶液在暗处可保存几个月,使用当天标定其浓度。

用酸性法测定高锰酸盐指数时的注意事项摘要:高锰酸盐指数的测定结果与溶液的酸度、高锰酸盐浓度、加热温度和时间及所用蒸馏水的纯度等条件有关,因此,在测定时必须严格遵守操作的有关规定,使结果准确。
关键词:酸性法高锰酸盐指数高锰酸盐指数是反应水体中有机及无机可氧化物质污染的常用指标,它是在一定条件下,用高锰酸钾氧化水中的的某些有机物及无机还原性物质,由消耗的高锰酸钾量计算相当的氧量,以氧的mg/L表示。
酸性法测定高锰酸盐指数时的误差主要来源于高锰酸钾溶液的不稳定性,浓度标定不准确引入的误差和测定条件的酸度、温度控制不当影响反应引入的误差。
因此,要消除误差,获得一个相对的准确测定值,必须要解决好以下几点:1配制较稳定0.1mol/L的高锰酸钾溶液纯的高锰酸钾溶液是相当稳定的,但因市售的高锰酸钾试剂常含有一些杂质,并且受蒸馏水中常含有微量还原性物质的影响,促进了高锰酸钾溶液的分解,此外,由于KMnO4溶液能自行分解,分解的速度因溶液的pH值而不同,一般在中性溶液中分解很慢,在碱性和酸性溶液中分解较快,见光分解的速度更快。
因此,必须正确地配制和保存高锰酸钾溶液。
为了配制较稳定的KMnO4溶液,常采用下列措施:(1)称取3.2g的KMnO4,溶解在不含还原性物质的蒸馏水中并稀释至1000mL。
(2)将配制好的KMnO4溶液于90~95℃水浴中加热两小时,然后在暗处放置2~3d,使溶液中可能存在的还原性物质完全氧化。
(3)倾出清夜,贮存于棕色试剂瓶中并存放于暗处,以待标定。
2 准确标定0.1mol/L的KMnO4溶液的浓度用 Na2C2O4标定KMnO4溶液。
其标定方法是将 Na2C2O4在105~110℃烘干约2h以后,冷却至室温即可使用。
在H2SO4酸性溶液中MnO4-与C2O42-的反应:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O为了能使此反应定量的迅速进行,应控制好以下条件:(1)温度控制:反应温度70~80℃。
![实验9水中高锰酸盐指数的测定[文]](https://uimg.taocdn.com/8dd50a9b51e2524de518964bcf84b9d529ea2c5c.webp)
实验9 水中高锰酸盐指数的测定[文] 实验9 水中高锰酸盐指数的测定一、实验目的1.了解和掌握水中高锰酸盐指数的测定方法和原理。
2.学习使用酸性高锰酸钾溶液滴定法测定水样中的高锰酸盐指数。
3.掌握实验操作过程中的注意事项和安全要求。
二、实验原理高锰酸盐指数是反映水体受到有机物和还原性无机物污染程度的重要指标之一。
它表示水体在酸性条件下,与高锰酸钾发生氧化还原反应后,高锰酸钾所消耗的量。
高锰酸盐指数越高,说明水体受到的污染越严重。
酸性高锰酸钾滴定法是测定水中高锰酸盐指数的常用方法。
该方法是在一定浓度的硫酸酸性溶液中,加入一定量高锰酸钾溶液,加热煮沸一定时间,用已知浓度的草酸钠溶液滴定剩余的高锰酸钾,通过计算得到水样中高锰酸盐指数。
三、实验步骤1.采集水样:用干净、干燥的玻璃瓶或塑料瓶采集水样,并贴上标签,注明采样地点、时间等。
2.准备试剂:准备酸性高锰酸钾溶液(0.025mol/L)、草酸钠溶液(0.01mol/L)和硫酸(1+3)溶液。
3.预处理水样:将采集的水样摇匀后,用离心管或过滤器过滤,除去水样中的悬浮物和杂质。
4.滴定操作:将过滤后的水样放入250mL烧杯中,加入5mL酸性高锰酸钾溶液,轻轻摇匀,加热至沸,并保持微沸状态15min。
然后用草酸钠溶液滴定剩余的高锰酸钾,至颜色消失为止。
记录滴定量(V)。
5.空白试验:用同样的方法进行空白试验,除了不加入水样外,其他操作与滴定操作相同。
记录滴定量(V0)。
6.结果计算:根据下列公式计算水样中高锰酸盐指数:高锰酸盐指数(mg/L)= [(V-V0) × C × 8000] / Vw其中,V为滴定水样时消耗的草酸钠溶液体积(mL),V0为空白试验消耗的草酸钠溶液体积(mL),C为草酸钠溶液浓度(mol/L),8000为校正系数,Vw为水样体积(mL)。
四、注意事项和安全要求1.在采集水样时,要确保容器干净、干燥,避免污染和干扰。

高锰酸盐指数的测定(酸性法)适用范围:本标准适用于饮用水、水源水和地表水的测定,检测限:0.5~10mg/L,对于高锰酸盐指数较高的水,可适当稀释后测定。
(本方法不适用于工业废水中有机污染较重的水)试剂:1.高锰酸钾使用液(约0.002mol/L):称取0.32g高锰酸钾溶于水中,于90~95℃水浴加热30分钟,冷却,用水稀释至1000ml。
3.(1+3)硫酸:将100ml硫酸慢慢加入到300ml水中,趁热滴加高锰酸钾溶液至呈微红色。
4.草酸钠标准溶液(约0.005mol/L):称取0.6705g在120℃烘干并冷却的优级纯草酸钠溶于水,移入1000ml容量瓶中,用水稀释至标线。
实验步骤:吸取50ml混匀水样于250ml锥形瓶中→加入5ml(1+3)硫酸,混匀→加入10.00ml 高锰酸钾溶液,摇匀→放入沸水浴中加热30min(从水浴重新沸腾起计时)→取下锥形瓶,趁热加入10ml草酸钠标准溶液,摇匀至无色→立即用高锰酸钾溶液滴定至显微红色(30秒不变色),记录高锰酸钾溶液消耗量。
空白试验:用50ml蒸馏水代替,按上述步骤所测高锰酸钾溶液体积为V0;注意:空白样要用高锰酸钾标准溶液回滴,要记录下回滴所用高锰酸钾溶液体积V2,具体步骤如下:向已所测高锰酸钾溶液体积为V0的空白样中加入l0ml草酸钠标准溶液摇匀→继续用高锰酸钾溶液滴定至显微红色,记录下所用高锰酸钾溶液体积V2。
按下式求得高锰酸钾溶液的校正系数(K)。
K=10/V2式中,10—加入草酸钠标准溶液的体积,ml;V2—回滴加入高锰酸钾溶液消耗量,ml。
结果计算:I(Mn)=(V1-V0)*K*C*16*1000/V式中:V1——滴定样品消耗的高锰酸钾溶液体积,mlV0——空白试验消耗的高锰酸钾溶液体积,mlV ——样品体积,mlK ——锰酸钾溶液的校正系数C ——草酸钠标准溶液的浓度,mol/L16——氧原子摩尔质量,g/mol1000——氧原子摩尔质量g转换成mg的变换系数。
实验四 水质高锰酸盐指数的测定一、目的要求1. 掌握高锰酸盐指数的测定原理及方法。
二、实验原理高锰酸盐指数是指在酸性或碱性介质中,以高锰酸钾为氧化剂,处理水样时所消耗的量,以氧的mg/L 来表示。
水中的亚硝酸盐、亚铁盐、硫化物等还原性无机物和在此条件下可被氧化的有机物,均可消耗高锰酸钾。
因此,高锰酸盐指数常被作为地表水体受有机污染物和还原性无机物质污染程度的综合指标。
样品中加入已知量的高锰酸钾和硫酸,在沸水浴中加热30分钟,高锰酸钾将水样中的某些有机物和无机还原性物质氧化,反应后加入过量草酸钠还原剩余的高锰酸钾,再用高锰酸钾标准溶液返滴定过量的草酸钠,通过计算得到样品中高锰酸盐指数。
反应方程式为:OH 8CO 10Mn 2H 16O C 5MnO 2O H 6CO 5Mn 4H 12C 5MnO 4222-242-4222-4++=++++=++++++据此,测定结果的计算式为)/O 1000mol g 00.32O C 21-MnO 45COD 21--242-421MnO -4L mg V cV V V c ()()(水样⨯⋅⨯⎥⎦⎤⎢⎣⎡+=式中,V 1为第一次加入KMnO 4溶液的体积;V 2为第二次加入KMnO 4溶液的体积。
由于Cl -对高锰酸钾法有干扰,因而本法仅适用于地表水、地下水、饮用水和生活污水中的高锰酸钾指数的测定,含Cl -较高的工业废水应采用K 2Cr 2O 7法测定三、仪器与试剂1、100ml 量筒、250ml 锥形瓶、50ml 酸式棕色滴定管、100ml 容量瓶、5ml 吸量管,10ml 胖肚移液管、电炉2、(1+3)硫酸、草酸钠标准贮备液、高锰酸钾标准贮备液:C (KMnO 4)≈0.02 mol/L 四、分析步骤1、草酸钠标准溶液的配制(0.005mol/L ):准确称取草0.17g 左右草酸钠基准物于100~105℃烘干2h 并冷却至室温,置于小烧杯中,加少量水溶解后,定量转移至250ml 容量瓶中,以水稀释至刻度,摇匀,计算其准确浓度。
水质高锰酸盐指数的测定(酸性法)实验过程分析王思海(文山壮族苗族自治州生态环境局文山分局生态环境监测站,云南文山663099)【摘要】高锰酸盐指数是反映水体中有机及无机可氧化物质污染的常用指标。
酸性KMnO4可氧化水样中的某些有机物及无机还原性物质,用Na2C2O4标准溶液还原剩余KMnO4,再用KMnO4返滴定过量的Na2C2O4,通过计算求出高锰酸盐指数,以氧的mg/L来表示。
通过对该项目实验过程的分析,能让分析人员快速掌握高锰酸盐指数的测定方法。
【关键词】高锰酸盐指数;自身指示剂;返滴定法;物质的量【中图分类号】X832【文献标识码】A【文章编号】2095-2066(2021)02-0016-02高锰酸盐指数是指在酸性条件下,用KMnO4氧化水样中的某些有机物及无机还原性物质,所消耗的KMnO4量,以氧的mg/L来表示。
高锰酸盐指数是反映水体中有机及无机可氧化物质污染的常用指标。
1实验原理分析1.1氧化还原滴定法实验室高锰酸盐指数的测定常用氧化还原滴定法进行滴定分析。
向待测样品中加入H2SO4呈酸性后再加入定量的KMnO4,KMnO4将待测样品中有机及无机可氧化物质氧化,然后加入过量的Na2C2O4还原剩余的KMnO4,再用KMnO4标准溶液回滴反应后的Na2C2O4,通过消耗KMnO4的量计算相当的氧量,以氧的mg/L来表示。
滴定反应原理如下:2MnO4-+5C2O42-+16H+‗2Mn2++10CO2↑+8H2O1.2自身指示剂在上述反应中KMnO4标准溶液为自身指示剂。
溶液中MnO4-为紫红色,用它来滴定无色Na2C2O4标准溶液,在化学计量点附近,稍过量的MnO4-就会使溶液呈浅红色,从而指示终点。
在氧化还原滴定中,利用滴定剂或被滴定液本身的颜色变化来指示终点,称为自身指示剂[3]。
1.3返滴定法返滴定法是指先加入一定量且过量的标准溶液,待其与被测物质反应完全后,再用另一种滴定剂滴定剩余的标准溶液,从而计算被测物质的量,因此返滴定法又称剩余量滴定法。
用酸性法测定高锰酸盐指数时的注意事项摘要:高锰酸盐指数的测定结果与溶液的酸度、高锰酸盐浓度、加热温度和时间及所用蒸馏水的纯度等条件有关,因此,在测定时必须严格遵守操作的有关规定,使结果准确。
高锰酸盐指数是反应水体中有机及无机可氧化物质污染的常用指标,它是在一定条件下,用高锰酸钾氧化水中的的某些有机物及无机还原性物质,由消耗的高锰酸钾量计算相当的氧量,以氧的mg/L表示。
酸性法测定高锰酸盐指数时的误差主要来源于高锰酸钾溶液的不稳定性,浓度标定不准确引入的误差和测定条件的酸度、温度控制不当影响反应引入的误差。
因此,要消除误差,获得一个相对的准确测定值,必须要解决好以下几点:1配制较稳定0.1mol/L的高锰酸钾溶液纯的高锰酸钾溶液是相当稳定的,但因市售的高锰酸钾试剂常含有一些杂质,并且受蒸馏水中常含有微量还原性物质的影响,促进了高锰酸钾溶液的分解,此外,由于KMnO4溶液能自行分解,分解的速度因溶液的pH值而不同,一般在中性溶液中分解很慢,在碱性和酸性溶液中分解较快,见光分解的速度更快。
因此,必须正确地配制和保存高锰酸钾溶液。
为了配制较稳定的KMnO4溶液,常采用下列措施:(1)称取3.2g的KMnO4,溶解在不含还原性物质的蒸馏水中并稀释至1000mL。
(2)将配制好的KMnO4溶液于90~95℃水浴中加热两小时,然后在暗处放置2~3d,使溶液中可能存在的还原性物质完全氧化。
(3)倾出清夜,贮存于棕色试剂瓶中并存放于暗处,以待标定。
2 准确标定0.1mol/L的KMnO4溶液的浓度用Na2C2O4标定KMnO4溶液。
其标定方法是将Na2C2O4在105~110℃烘干约2h以后,冷却至室温即可使用。
在H2SO4酸性溶液中MnO4-与C2O42-的反应:2MnO4-+5C2O42-+16H+==2Mn2++10CO2↑+8H2O为了能使此反应定量的迅速进行,应控制好以下条件:(1)温度控制:反应温度70~80℃。
高锰酸盐指数测定高锰酸盐指数(Chemical Oxygen Demand,COD)是指在酸性条件下,有机物质经氧化反应后所需消耗高锰酸钾的量,是测定废水中有机物质含量的一种重要指标。
高锰酸盐指数测定方法简便、经济,能够快速反映废水中有机性物质的含量,是现代水处理技术中必不可少的环保分析技术之一。
本文将详细介绍高锰酸盐指数的测定原理、方法和注意事项。
一、测定原理高锰酸盐指数(COD)测定是利用高锰酸钾在酸性介质中的氧化性来测定水中有机物的含量。
采用硫酸和高锰酸钾将有机物氧化为低级酸和氧化物,反应生成的氧化物使溶液由灰白色变为深紫色。
在一定的反应时间后,用铁铵盐测定剩余的高锰酸钾,根据高锰酸根离子在吸收波长处的吸光度计算出高锰酸盐指数(COD)。
二、测定方法1. 试剂和仪器试剂:高锰酸钾(K2MnO4)、硫酸(H2SO4)、铁铵盐(Fe(NH4)2(SO4)2.6H2O)、硫酸铵(NH4)2 SO4。
仪器:分光光度计、移液管、量筒、可控加热设备、盛样瓶、比色皿等。
2. 操作步骤(1)样品处理将废水样品通入大口瓶中,加入硫酸,控制pH值为1.0左右。
样品的处理量一般为50-100mL。
如果样品中含有较多的浮游物和杂质,可以用滤纸滤掉,以避免影响后续测定的准确性。
(2)加入试剂向样品中加入0.25g高锰酸钾,将试管浸泡于水浴中,保持温度在150℃左右,加速反应。
(3)滴定铁铵盐溶液反应时间一般为2小时,取出试管,立即加入硫酸铵,使溶液中的高锰酸钾还原为锰离子,同时加入铁铵盐溶液,将溶液变为浅红色。
用1mol/L硫酸滴定至浅粉红色为止,记录铁铵盐用量V1(mL)。
(4)空白对照相同体积的水作为空白对照,按上述方法进行滴定,记录铁铵盐用量V2(mL)。
空白对照用于纠正试剂本身的色差。
3. 计算COD值COD值的计算公式为:COD=mL(Fe(NH4)2(SO4)2·6H2O)×0.025×1000 / mL样品COD为高锰酸盐指数(mg/L),0.025是高锰酸钾每毫升的浓度,1000是将mg/L换算成g/L所需的倍数。
高锰酸盐指数的测定——酸性高锰酸钾法一、适用范围1、本方法适用于饮用水、水源水、地面水的测定,测定范围在0.5mg/L —4.5mg/L ,对污染较重的水样,经适当稀释后测定。
2、本方法不适用于测定工业废水中有机污染的负荷量。
二、试剂与仪器试剂:除非另有说明,均使用符合国家标准或专业标准的分析纯试剂。
1、KMnO 42、基准Na 2C 2O 43、H 2SO 4:1+3(所用的浓硫酸密度为1.84g/mL )。
仪器:电热板直火加热锅、分析天平、棕色酸式滴定管、滴定台、洗瓶、玻璃棒、烧杯、锥形瓶、试剂瓶、移液管、吸耳球、恒温水浴等;三、实验检测步骤(1) C [1/5KMnO4]=)51(Mr V m =0.01mol/L 溶液的配制与标定 配制:称取0.32g KMnO 4溶于120mL 水中,超声搅拌溶解后,用电热板直火加热煮沸,使体积减少到100mL ,放置过夜。
用G3玻璃砂芯漏斗过滤后,将滤液贮于棕色试剂瓶中保存,KMnO 4浓度约为0.02mol/L 。
用移液管移取10.00mL 0.02mol/L 的KMnO 4溶液于100mL 的棕色容量瓶中并用重蒸水定容至刻度线。
标定:① 准确称取经120℃烘干2h 并放冷的Na 2C 2O 4 0.6705g 于100mL 烧杯中,加水溶解后移入100mL 容量瓶,即为C [1/2Na2C2O4]=0.1mol/L 的Na 2C 2O 4溶液; ② 取10.00mL 上述Na 2C 2O 4溶液于100mL 的容量瓶中,加重蒸馏水定容后,可得浓度为C [1/2Na2C2O4]=0.01mol/L 的Na 2C 2O 4溶液;③ 将100mL 重蒸水和5mL (1+3) H 2SO 4依次加入250mL 的锥形瓶中,然后用移液管移取10.00mL C [1/2Na2C2O4]=0.0100mol/L 的Na 2C 2O 4标准溶液,加热至70~80℃,用C [1/5KMnO4]=0.01mol/L 溶液滴定至溶液由无色至刚刚出现浅红色为滴定终点,并保持半分钟内不褪色【注:滴定时在锥形瓶下面放一张白纸作参照】。
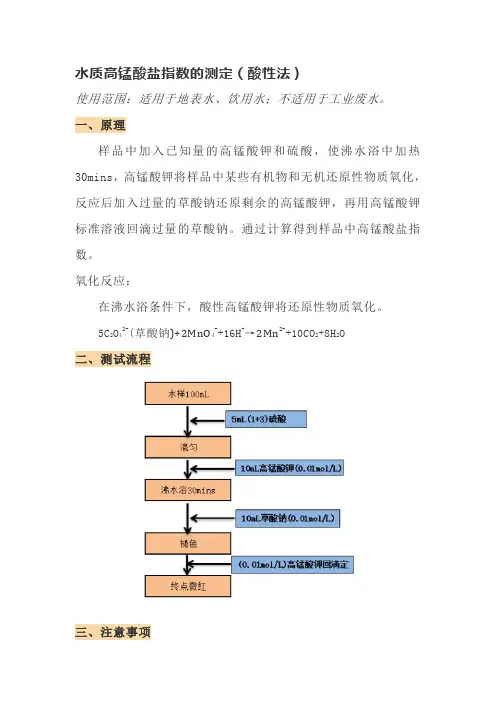
水质高锰酸盐指数的测定(酸性法)
使用范围:适用于地表水、饮用水;不适用于工业废水。
一、原理
样品中加入已知量的高锰酸钾和硫酸,使沸水浴中加热30mins,高锰酸钾将样品中某些有机物和无机还原性物质氧化,反应后加入过量的草酸钠还原剩余的高锰酸钾,再用高锰酸钾标准溶液回滴过量的草酸钠。
通过计算得到样品中高锰酸盐指数。
氧化反应:
在沸水浴条件下,酸性高锰酸钾将还原性物质氧化。
5C2O42-(草酸钠)+2MnO4-+16H+→2Mn2++10CO2+8H2O
二、测试流程
三、注意事项
1、水样保存
采集水样后,加浓硫酸至pH1-2,尽快分析。
保存时间超过6h,需冷藏(0-5℃),但不超过2天。
2、实验条件
①消解:沸水浴温度为98℃,高原地区沸点偏低,可能影响消解效率,须注明实际沸点(相同条件下,100℃时反应速率大概是95℃的1.6倍)。
沸水浴水面需要高于锥形瓶内液面。
②反应时间:研究表明,消解时间从30增加到60mins时,结果增加4-10%。
反应需要严格控制时间,保持测试样品消解时间的一致性。
③条件电极电位E=Eθ+RT/5F·ln(a MnO4-·a H+8/a Mn2+)。
高锰酸钾溶液浓度变化对于反应有较大的影响。
④酸度对反应影响较小:硫酸溶液在反应体系中已算是浓电解质,离子间相互作用明显,硫酸浓度发生一定变化时,对于氢离子活度变化不大(离子活度受电解质浓度和离子活度影响,浓电解质溶液中浓度升高会引起活度下降)。
⑤空白滴定温度控制:当反应液温度低于80℃时,应重新加热后再滴定。
3、COD Cr和COD Mn的对比
①COD所表示的是水体中受还原性物质污染的指标,主要是水体中受有机物污染的指标。
②COD的定量方法主要受氧化剂种类、浓度,消解温度、时间,酸度的影响。
COD Cr的条件电极电位能达到1.55V,对水体约有90%左右的氧化率;COD Mn的条件电极电位能达到1.45V,对水体约有50%左右的氧化率,COD Mn测试只适用于地表水、饮用水,不适用于COD值高的工业废水。
两种COD之间没有明显的线性关系。
参考标准:GB11892-89水质高锰酸盐指数的测定。