物质的量及其单位——摩尔
- 格式:pptx
- 大小:259.57 KB
- 文档页数:18

第04讲物质的量及其单位——摩尔摩尔质量课程标准课标解读1.了解物质的量及其相关量的含义和应用。
2.认识物质的量与微观粒子之间的相互关系,能够进行简单的化学计算。
3.了解物质的量、摩尔质量和物质的质量之间的关系关系,能够进行简单的化学计算,体会定量研究对化学科学的重要作用。
1.了解物质的量及其单位——摩尔,了解物质的量与微观粒子数之间的关系。
从物质的量的角度来认识物质的微观构成。
2.从物质的量与微观粒子之间的关系,能够运用物质的量、摩尔质量、阿伏加德罗常数的相互关系进行简单计算。
3.体会以内物质的量的概念对化学科学的重要作用。
知识点01 物质的量及其单位1.物质的量(1)概念:物质的量是一个基本物理量,通过它可以把物质的宏观量(如质量、体积)与原子、分子或离子等微观粒子的数量联系起来。
(2)单位:摩尔,简称:摩。
(3)符号:n。
2.摩尔——物质的量的单位(1)标准:1mol包含6.02214076×1023个基本单元(原子、分子或离子等微观粒子或它们的组合)。
(2)符号:mol。
(3)计量对象:分子、原子、离子、原子团、电子、质子、中子等所有微观粒子。
3.阿伏加德罗常数4.物质的量、阿伏加德罗常数与微粒数(N)的关系n=ANN。
【即学即练1】(2022•丽水高一检测)下列对于“摩尔”的理解正确的是()。
A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为molC.我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔D.1mol氧含6.02×1023个O2【解析】选B。
物质的量是国际科学界建议采用的一种物理量,摩尔是物质的量的单位,故A错误;摩尔是物理量物质的量的单位,简称摩,符号为mol,故B正确;物质的量需要指明微粒种类,1mol氧气中约含6.02×1023个O2,故D错误;把12g12C中所含碳原子数规定为1mol,近似为6.02×1023/mol,称为阿伏伽德罗常数,是微观粒子的集合体,故C错误。




《物质的量及单位——摩尔》讲义一、引入在我们学习化学的过程中,经常会遇到描述物质组成和化学反应的情况。
如果仅仅用质量来表示物质,有时候会显得不够精确和方便。
这时候,“物质的量”这个概念就应运而生了。
它就像是一把神奇的钥匙,能够帮助我们更深入、更准确地理解和研究化学世界。
二、物质的量的定义物质的量是一个物理量,它表示含有一定数目粒子的集合体。
这听起来可能有点抽象,那我们来打个比方。
假如把一堆苹果看作一个集合体,我们不去关心每个苹果的大小和重量,而是只关注这一堆苹果的总数。
在化学中,物质的量就是这样,用来表示原子、分子、离子等微观粒子的多少。
三、物质的量的单位——摩尔既然有了物质的量这个概念,那总得有个单位来衡量它吧?这个单位就是摩尔(mol)。
1 摩尔到底是什么意思呢?1 摩尔任何粒子所含的粒子数与 0012kg 碳 12 中所含的碳原子数相同。
这个数字非常庞大,约为 602×10²³,我们把它叫做阿伏加德罗常数,通常用Nₐ表示。
就好像我们说一打鸡蛋是 12 个,一摩尔粒子就是约 602×10²³个。
四、为什么要引入摩尔这个单位想象一下,如果我们每次描述物质的组成都要数清楚原子、分子的个数,那得是多么巨大的工作量,而且几乎不可能做到。
有了摩尔这个单位,就方便多了。
比如,我们说 1 摩尔氧气,就知道里面含有约 602×10²³个氧分子,而不用一个一个去数。
这使得在化学计算和研究中,能够更加简洁、高效地处理问题。
五、物质的量(n)、阿伏加德罗常数(Nₐ)与粒子数(N)的关系这三者之间的关系可以用一个公式来表示:N =n × Nₐ也就是说,如果我们知道了物质的量和阿伏加德罗常数,就可以算出粒子数;反过来,如果知道了粒子数和阿伏加德罗常数,也能求出物质的量。
例如,有 301×10²³个水分子,那么水的物质的量就是:n = N /Nₐ = 301×10²³/ 602×10²³ mol⁻¹= 05 mol六、通过物质的量计算物质的质量我们知道,每种物质都有自己的摩尔质量。


物质的量及其单位——摩尔1 物质的量(1如原子、分子或离子等(2)符号:n。
(3)单位:摩尔(mol),例如:n(H2)=1 mol。
(4)物质的量是国际单位制中七个基本物理量之一。
名师提醒(1)“物质的量”是一个专有名词,不能删减或增添任何字,例如:不能写成“物质量”“物质的质量”或“物质质量”等。
(2)某微粒的物质的量可用“n(微粒符号)”的形式来表示,如n(O2)、n(H2O)、n(Na +)等。
2 物质的量的单位——摩尔(1)含义:摩尔是物质的量的单位,简称“摩”。
“摩尔”起源于希腊文mole,原意为“堆量”。
(2)符号:mol。
(3名师提醒(1)摩尔只能用来表示微观粒子的多少,不能用来表示宏观物质的多少。
例如:1 mol小米、1 mol苹果、1 mol元素等都是错误的。
(2)用摩尔表示微观粒子多少时,必须指明微观粒子的种类,例如:1 mol H 、1 mol H 2、1 mol H +都正确;但1 mol 氢不正确,因为其表示的微观粒子不明确。
3 阿伏加德罗常数(1)定义:国际计量大会规定,1 mol 包含6.022 140 76×1023个基本单元(原子、分子或离子等微观粒子或它们的组合)。
6.022 140 76×1023 mol -1这一常数被称为阿伏加德罗常数。
阿伏加德罗常数个12C 原子的质量约为0.012 kg 。
通常,阿伏加德罗常数可以近似表示为6.02×1023 mol -1。
(2)符号:N A 。
(3)单位:mol -1。
(4)物质的量(n )、微粒数(N )、阿伏加德罗常数(N A )之间的关系:n =变形公式:N =nA N A =名师提醒(1)为了纪念阿伏加德罗在气体定律方面作出的功绩,化学界把测得的1 mol 物质所含的微粒数称为阿伏加德罗常数。
(2)1 mol 任何“微粒”集体都含有6.02×1023个“微粒”。
(3)物质的量是以摩尔为单位、阿伏加德罗常数为标准,计量微观粒子数目的物理量。

【知识要点】一、物质的量及其单位——摩尔1、物质的量的含义:物质的量表示含有一定数目粒子的集体,指物质中所含微粒(分子、原子、离子、电子、质子、中子等)的多少,故物质的量是衡量物质所含微粒数目多少的一个物理量,其国际单位为摩尔,符号mol。
2、摩尔:摩尔是物质的量的单位,类似于长度的单位为米,质量的单位为千克,摩尔可以表示物质的量的多少:1mol 物质所含微粒的多少,用阿伏加德罗常数来表示。
3、阿伏加德罗常数(N A)国际上规定,0.012kg12C所含的碳原子数为阿伏加德罗常数,用N A表示。
这是一个规定值,也是一个精确值,平时计算时是用近似值计算,阿伏加德罗常数的近似值为6.02×1023mol-1。
阿伏加德罗常数的引入,就把物质的量与微观粒子联系在了一起,其含义是:1mol任何微粒所含微粒数为阿伏加德罗常数,换言之,阿伏加德罗常数个微粒的物质的量为1mol,根据二者的联系,可总结出如下转化关系式:n=其中n表示物质的量,N为微粒个数,(此处微粒可以指分子、原子、离子、电子、质子、中子等)由上述公式可知,N A为常数,n与N应成正比,即n1∶n2=N1∶N2,其含义为两种物质的物质的量之比等于它们的微粒数之比。
二、摩尔质量与气体摩尔体积1、摩尔质量:(1)定义:单位物质的量的物质所具有的质量,叫摩尔质量,单位为g/mol或kg/mol。
(2)含义:摩尔质量能把物质的量与物质的质量联系在一起。
其具体联系公式为:n=。
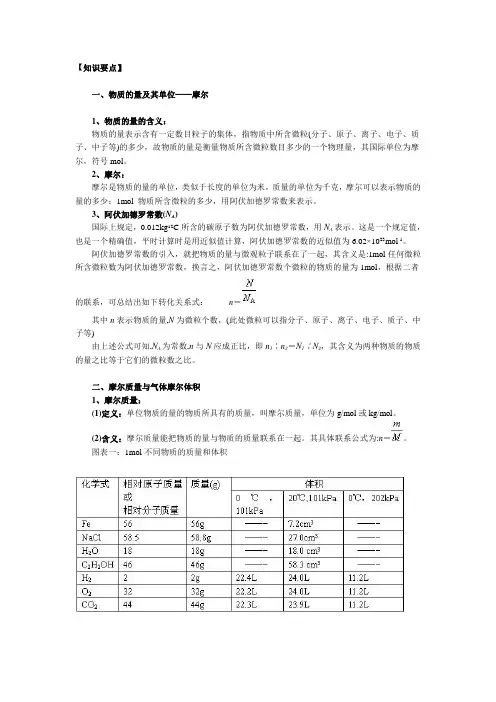
图表一:1mol不同物质的质量和体积摩尔质量虽是一个新概念,但从表格中的数据可知,1molFe、NaCl、H2O、C2H5OH等物质的质量在数值上分别与它们的相对原子质量或相对分子质量相等。
据此可知如下结论:原子:摩尔质量就是以g/mol为单位,在数值上等于其相对原子质量。
分子:摩尔质量就是以g/mol为单位,在数值上等于其相对分子质量。
故依据公式计算时,摩尔质量就是一个隐含的数据,题目中就不再告诉。

《物质的量及单位——摩尔》讲义一、引入在化学的世界里,我们常常需要处理各种各样的物质。
当我们想要定量地描述物质的组成和变化时,仅仅使用质量、体积等物理量往往不够精确和方便。
这时候,“物质的量”这个概念就应运而生了,而与之紧密相连的单位——摩尔,成为了化学中极其重要的度量工具。
二、什么是物质的量物质的量是一个用于表示含有一定数目粒子的集合体的物理量。
它就像是一个“大口袋”,把众多的微观粒子装在一起进行计量。
我们可以把物质的量想象成一堆苹果。
如果我们一个一个地数苹果,那会非常繁琐。
但如果我们把一定数量的苹果装成一筐,每次就可以以筐为单位来计算苹果的数量,方便又快捷。
物质的量对于微观粒子来说,就是这样的一筐“苹果”。
物质的量的符号是“n”,它的单位是摩尔,简称“摩”,符号为“mol”。
三、摩尔的定义1 摩尔到底代表多少呢?1 摩尔任何粒子所含的粒子数均为阿伏加德罗常数个。
阿伏加德罗常数约为 602×10²³。
这就好像我们规定一筐苹果正好是 60 个,那么 1 摩尔粒子就相当于这固定的 602×10²³个粒子。
比如说,1 摩尔氧原子,就含有602×10²³个氧原子;1 摩尔水分子,就含有 602×10²³个水分子。
需要注意的是,阿伏加德罗常数是一个非常巨大的数字,这也反映了微观世界中粒子数量的极其庞大。
四、物质的量与粒子数的关系通过阿伏加德罗常数,我们可以建立起物质的量(n)与粒子数(N)之间的关系:n = N /Nₐ (其中Nₐ 表示阿伏加德罗常数)这个公式就像是一座桥梁,让我们能够在物质的量和粒子数之间自由转换。
如果我们知道了某种物质所含粒子的数目,就可以通过这个公式算出物质的量;反过来,如果知道了物质的量,也能算出所含粒子的数目。
例如,已知有 1204×10²⁴个氧分子,那么氧分子的物质的量 n =1204×10²⁴/ 602×10²³= 2 mol。
第1章认识化学科学第3节化学中常用的物理量-物质的量物质的量及其单位—摩尔摩尔质量(第一课时)1、建立物质的量概念,基于物质的量定量认识物质的组成及变化。
2、了解物质的量及其单位——摩尔,了解物质的量与微观粒子数之间的关系。
3、了解摩尔质量的概念。
4、了解物质的量、摩尔质量、物质质量之间的关系。
1、建立物质的量概念,基于物质的量定量认识物质的组成及变化。
2、物质的量,阿伏伽德罗常数、微粒数、摩尔质量之间的关系。
请回忆初中所学的知识,表述下列方程式的意义?【新课导入】【过渡】1 滴水约含有17万亿亿个水分子。
怎么样才能既科学又方便的知道一定质量或体积的水中含有多少个水分子呢?如何把难见难称量的微观粒子和可见可称量的宏观物质联系起来?一、物质的量及其单位1. 定义:是衡量物质所含微观粒子多少的物理量。
2. 符号:n。
3. 单位:摩尔,简称摩,符号mol。
七个基本物理量及其单位和符号【注意事项】①专有化:。
②微观化:。
③集体化:。
④具体化:。
【课堂练习】1、填空1 mol H2O 中含___ mol H ,___ mol 氧原子。
1 mol K2SO4中含___mol 氧原子,___mol 原子。
1.5 mol Na2O2中含___mol 钠原子,___mol 氧原子。
2、判断正误(正确的打“√”,错误的打“×”)①物质的量可以理解为物质的数量()②物质的量表示物质所含指定粒子集合体数目的多少()③物质的量描述对象是分子、原子等微观粒子()④摩尔是国际单位制中七个基本物理量之一()⑤ 1 mol氢中含有2 mol氢原子和2 mol电子()国际计量大会规定,1 mol 任何微粒所含的微粒数与所含的碳原子数相等。
实验测定:约为个。
说明: 1 mol 任何微粒所含的微粒数与0.012 kg 12C 所含的碳原子数相等,都约为6.02×1023个。
二、阿伏加德罗常数(N A)【练习】阿伏加德罗常数就是 6.02×1023。