02药物毒代动力学 (2)
- 格式:ppt
- 大小:9.65 MB
- 文档页数:116




毒代动力学名词解释毒代动力学(Toxicokinetics,TK)是一门研究毒物在体内的吸收、分布、代谢和排泄过程及其动态变化规律的学科。
它是毒理学的重要组成部分,通过对毒物在生物体内的运动和转化进行定量分析,为评估毒物的毒性和潜在危害提供了关键的科学依据。
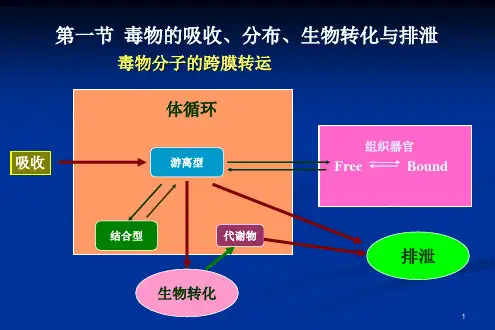
毒物进入体内的第一步是吸收。
吸收的方式多种多样,比如通过口服、吸入、皮肤接触等。
口服是常见的途径之一,毒物经过胃肠道的消化和吸收后进入血液循环。
吸入则通常针对气体、蒸汽或颗粒物形式的毒物,通过呼吸道直接进入肺部,然后迅速进入血液循环。
皮肤接触时,毒物可能透过皮肤的角质层和其他层次进入体内。
毒物在吸收后会在体内进行分布。
分布过程受到多种因素的影响,包括毒物的化学性质、组织器官的血液灌注量、组织亲和力以及体内的屏障系统(如血脑屏障、胎盘屏障等)。
一些毒物可能会优先在特定的器官或组织中蓄积,例如脂肪组织、肝脏、肾脏等。
这是因为不同的组织对毒物的摄取和储存能力存在差异。
代谢是毒物在体内发生化学变化的过程。
主要的代谢场所是肝脏,但其他器官如肾脏、胃肠道等也可能参与其中。
代谢反应可以分为Ⅰ相反应和Ⅱ相反应。
Ⅰ相反应主要包括氧化、还原和水解等,目的是增加毒物的极性,使其更易于排出体外。
Ⅱ相反应则是将经过Ⅰ相反应后的毒物与内源性物质(如葡萄糖醛酸、硫酸等)结合,进一步增加其水溶性,促进排泄。
排泄是毒物从体内清除的过程。
主要的排泄途径包括肾脏排泄(通过尿液)、胆汁排泄(通过粪便)、呼吸道排泄(以气体形式)以及其他途径如汗液、乳汁等。
肾脏排泄是最重要的排泄方式之一,毒物经过肾小球滤过、肾小管重吸收和分泌等过程排出体外。
胆汁排泄对于一些大分子或极性较低的毒物具有重要意义,它们可能在肠道中被重新吸收,形成肠肝循环。
毒代动力学的研究通常会涉及一系列的参数,这些参数能够定量地描述毒物在体内的动态变化。
其中,最重要的参数之一是血药浓度时间曲线。
通过测定不同时间点血液中毒物的浓度,可以绘制出这条曲线,从中可以得到许多关键的信息,如达峰时间、峰浓度、曲线下面积等。




第二章药物毒性代谢动力学1.毒代动力学的研究目的:1).描述药物在动物的全身暴露及其与毒性剂量和时间的关系;2)了解毒性研究中药物暴露量与毒理学结果之间的关系;3)描述重复给药的暴露延长对代谢过程(包括代谢酶)的影响;4)评价药物在不同种属、性别、年龄、生理及病理状态下的毒性反应;5)评价毒理学试验间的关联性、毒理学实验与药效学试验的关联性、毒理学结果对临床试验特别是临床I期试验的支持作用;6)阐明药物的制毒机制和毒性发生、发展规律;7)为进一步的非临床毒性研究设计和临床试验的给药剂量设置和药物的安全性评价提供资料。
2.毒代动力学的研究内容:1)单次给药毒性研究:即急性毒性研究,指动物一次(或24h内多次)给予受试物后,一定时间内所产生的毒性反应。
单次给药的毒性研究一般用两种啮齿类动物或一种啮齿类和一种非啮齿类动物。
常用的方法有:最大耐受量法、最大给药量法、半数致死量法、固定剂量法、序贯法、近似致死剂量法和积累剂量设计法。
(前四种方法常用于啮齿类动物,后两种方法主要用于非啮齿类动物)2)重复给药毒性研究:也称长期毒性研究,通过长期的重复给药显示动物的毒性,预测药物可能对人的不良反应,降低其临床用药风险。
重复给药毒代动力学研究的信息:全身暴露情况、性别和种属差异、剂量相关性、蓄积程度、肝药酶的变化等。
一般先提供4周给药的毒代动力学资料,以支持一期临床研究。
然后在啮齿动物(如大鼠)进行可长达6个月月和非啮齿动物(如Beagle犬)9个月(国内)或12个月(国外)的进一步的重复给药毒性的毒代动力学研究。
进行4周给药的肚带动力学研究,一般在给药的首日、末日和4周期间测定各剂量组合对照组的药物浓度,观察AUC和稳态浓度的变化。
采样时间可根据毒代动力学而定,但通常是给药后0.5、1、2、4、8、12、24h。
3)组织分布研究4)遗传毒性研究5)致突变、致畸、致癌试验6)生殖毒性研究:主要研究药物对生殖能力、胚胎和胎儿生长发育及分娩前后动物的影响。

药物毒代动力学研究技术指导原则一、概述毒代动力学研究目的是获知受试物在毒性试验中不同剂量水平下的全身暴露程度和持续时间,预测受试物在人体暴露时的潜在风险(注释1)。
毒代动力学是非临床毒性试验的重要研究内容之一,其研究重点是解释毒性试验结果和预测人体安全性,而不是简单描述受试物的基本动力学参数特征。
毒代动力学研究在安全性评价中的主要价值体现在:(一)阐述毒性试验中受试物和/或其代谢物的全身暴露及其与毒性反应的剂量和时间关系;评价受试物和/或其代谢物在不同动物种属、性别、年龄、机体状态(如妊娠状态)的毒性反应;评价非临床毒性研究的动物种属选择和用药方案的合理性。
(二)提高动物毒性试验结果对临床安全性评价的预测价值。
依据暴露量来评价受试物蓄积引起的靶部位毒性(如肝脏或肾脏毒性),有助于为后续安全性评价提供量化的安全性信息。
(三)综合药效及其暴露量和毒性及其暴露信息来指导人体试验设计,如起始剂量、安全范围评价等,并根据暴露程度来指导临床安全监测。
本指导原则适用于中药、天然药物和化学药物。
生物制品的毒代动力学研究可参考本指导原则(注释2)。
二、基本原则毒代动力学研究需执行《药物非临床研究质量管理规范》(GLP)(注释3)。
毒代动力学试验通常伴随毒性试验进行,常被称为伴随毒代动力学试验。
开展研究时可在所有动物或有代表性的亚组或卫星组动物中进行,以获得相应的毒代动力学数据(注释4)。
三、基本内容(一)暴露量评估毒代动力学试验的基本目的是评估受试物和/或其代谢物的全身暴露量,常通过适当数量的动物和剂量组来开展研究。
伴随毒代动力学研究所用动物数量应保证能获得足够的毒代动力学数据。
由于毒性试验中通常采用两种性别动物,暴露测定也应包括两种性别的动物。
选择单性别动物时应说明理由(注释5)。
暴露评估应考虑以下因素(注释6):血浆蛋白质结合、组织摄取、受体性质和代谢特征的种属差异、代谢物的药理活性、免疫原性和毒理学作用。
在血浆药物浓度相对较低时,特殊的组织或器官也可能会有较高水平的受试物和/或其代谢物。

临床前药物安全性评价研究中的药物毒代动力学问题(天津药物研究院,天津药物代谢动力学与临床药理研究室,天津300193)任何物质均具有两重性,药物也不例外,在剂量适当时它有a疗疾病的作用,在超过一定剂量时它会出现副作用。
临床前药物安全性评价研究是考察药物在不同剂量水平产生毒性的表现和程度,以及剂量和给药时程与毒性的关系,毒性靶器官与药物的关系。
但并未涉及在体内药物浓度及其在体内驻留的问题。
在药物安全性评价研究中开展毒代动力学研究目的是理解药物毒性试验结果,发现毒性的剂量水平和时程的关系,提高毒性研究资料的价值。
“毒代动力学”(Toxicokinetics)严格从词源解释来说应为“毒物动力学”或“毒性动力学「Toxicokinetics是由toxic(毒,毒物或毒性)和kinetics(动力学)两词组合而成的,"toxico"来自希腊词"toxikon(毒或毒物),"kinetics”来自希腊语"kinesis"(动力学)。
但目前国内一般将该词译为“毒代动力学”。
毒代动力学是一新兴的药代动力学和毒理学结合的学科,被研究者认识的时间极短,在国内目前基本属于空白,还没有发表过一篇毒代动力学研究的论文。
1994年10月国际协调会议(ICH)采纳了并提出了三方协调的毒性研究中的毒代动力学试验原则。
随着科学的发展,对新药研究要求的提高,我国也准备将毒代动力学研究列入新药研究的必须项目。
这里仅将国际上的毒代动力学研究的一些基本要求介绍于后,供新药研究者参考。
1毒代动力学研究目的毒代动力学作为临床前药物安全性评价试验的一个组成部分。
药物对机体的作用强度不仅取决于体液中药物浓度的大小,而且也取决于药物在体内驻留时间的长短,在此用暴露(exposure)来表达药物浓度和驻留时间的关系。
毒代动力学研究提供了毒代动力学参数和比较全身暴露((Systemicexposure)与毒性的关系。