全国高校BIM毕业设计作品大赛报名表
- 格式:doc
- 大小:253.50 KB
- 文档页数:6


品茗杯全国高校bim应用设计大赛流程1.报名参赛的高校需出具学校开具的报名确认函。
Each participating college needs to provide a confirmation letter from the school.2.参赛作品需提交设计图纸和文字描述,形式不限。
Participants need to submit design drawings and written descriptions, in any format.3.参赛作品需包含BIM应用方案设计和创新性元素。
Entries must include BIM application design and innovative elements.4.评审采取实地考察和网络评审相结合的方式进行。
The judging will be conducted through a combination of site visits and online evaluations.5.评审团由BIM领域专家和相关行业领军人物组成。
The judging panel is made up of experts in the field of BIM and leading figures in related industries.6.评审将主要从设计创新性、技术可行性和实用性等方面进行评分。
The judging will mainly focus on design innovation, technical feasibility, and practicality for scoring.7.评审结果将在规定时间内公布并通知获奖高校。
The results of the judging will be announced within the specified time and the winning colleges will be notified.8.获奖高校需组织参赛代表参加颁奖典礼并领奖。

全国高校第二届斯维尔杯BIM软件建模大赛总要求1、要求使用清华斯维尔软件公司提供的大赛版软件,按所报专项完成计划任务书中所列的参赛内容。
2、比赛用BIM系列软件如下:斯维尔杯高校BIM大赛组委会咨询电话:6二O一O年十二月卅日全国高校第二届斯维尔杯BIM软件建模大赛综合任务书一、概述全国高等院校学生斯维尔杯“BIM系列软件建筑信息模型大赛”是以建筑信息模型为基础,根据协同设计理念,由建筑学、土木工程、建筑设备、工程造价、工程管理等相关专业学生相互配合,分别承担产业链中三类重要角色(设计师、造价师、建造师),协同完成的大赛。
完成不同专业与项目上、下游之间的数据共享,从而建立起能在同一个数字空间表达工程设计、工程造价及工程管理等各专业信息的数据模型.二、目的为积极贯彻教育部有关“深化人才培养模式改革,健全提高教学质量的体制机制。
深入实施高等院校教学质量与教学改革工程,大力支持就业为导向的高等职业院校改革与建设;”配合院校落实高校实训课程体系,建设与实践教学,培养既符合国家发展要求又与社会实践相接轨的实用人才。
三、组队要求由2-5名学生组成一队,其中一名为替补队员。
建议由建筑学、土木工程、工程造价、工程管理专业的学生组成一队,完成工程设计、工程造价、工程管理专业的作品。
不按此方式组合的团队,以能够完成相关专业作品为基础组队亦可。
四、比赛内容从单项工程的设计直至单项工程建设完工,工作任务涵盖整个单项工程:1、工程设计——建筑设计、结构设计、室内的电、水、空调通风、消防、弱电部分。
建筑节能设计及日照分析。
2、工程造价——将工程设计专业完成的设计项目进行工程造价计算,包括建筑专业、装饰专业、安装专业三个单项造价。
3、工程管理——将单位工程的建造过程用“技术标”的形式,做出“质量控制、工期安排、施工现场平面布置图”的标书。
五、比赛题目及要求1、项目名称:某综合楼2、项目需求:根据业主要求,需要建造一栋综合楼,该综合楼内设有:办公室、休息室、多媒体会议室、其他房间、洗手间、楼梯及安全消防走道等附属设施。
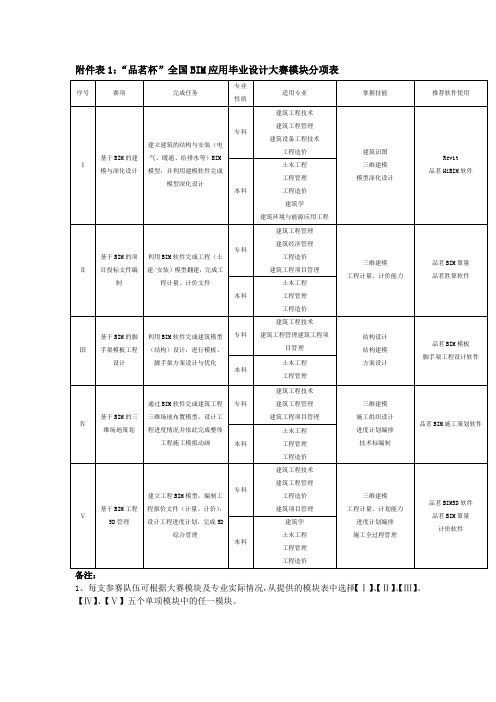
附件表1:“品茗杯”全国BIM应用毕业设计大赛模块分项表
备注:
1、每支参赛队伍可根据大赛模块及专业实际情况,从提供的模块表中选择【Ⅰ】、【Ⅱ】、【Ⅲ】、【Ⅳ】、【Ⅴ】五个单项模块中的任一模块。
备注:
1.此表需填写后打印,并经领导签字盖系、院公章,扫描后上传至报名网站处待报名审核;
2.本次比赛以团队形式报名,指导老师限1人,参赛学生由3-5人组成;
3.参赛队伍可根据大赛模块及专业实际情况,从提供的模块表中选择【Ⅰ】、【Ⅱ】、【Ⅲ】、
【Ⅳ】、【Ⅴ】五个单项模块中的任一模块;
4.参赛学生第1位默认为团队队长,且不可变更,请大家填表时注意;
5.地址信息为大赛奖品发放地址,且不可变更,请认真填写。
备注:
1、团体优秀奖证书在网络晋级赛完成后统一邮递,其余奖项在答辩现场颁奖。
2、“品茗杯”全国BIM应用毕业设计大赛一等奖获奖团队将获得推荐就业实习机会。
全国高校BIM毕业设计作品大赛报名表
备注:(此表为报名审核需要,内容需真实,否则后果自负)
1)鲁班通行证即鲁班BIM系统的登录账号,密码请自己牢记。
免费注册地址:
此表需填写后打印,并经领导签字盖系、院公章(如两专业联合组队,需两个专业盖章),扫描备用报名审核;
2)以团队形式报名,报名老师需为指导老师,参赛学生团队一般由 5 人或5人
以内组成;
3)大赛赛项序号,根据专业及实际情况选择“大赛赛制”模块“A1+、A1+、
A1+、A1+、A2+、A2+、A2+、A2+、”中一个(每支团队只能一个)模块,或选择独立一个模块小类“A1、A2、、、、、、、、”。
4)参赛学生第 1 位默认为团队组长,请大家填表时注意;
5)毕设启动为本校毕设实际开始时间,如;。
附件:第十一届“创新杯”建筑信息模型(BIM)应用大赛参赛细则一、参赛须知(1)参赛作品均要求使用正版软件设计完成。
(2)参赛者必须保证作品的原创性,不得抄袭、剽窃他人作品,不得侵犯任何第三方的知识产权或其他权利。
侵权的法律责任概由剽窃、抄袭者承担。
(3)参赛作品的申报材料原则上不予退还,请参赛者自行保存底稿。
二、填写报名表(1)本次大赛的所有最终奖项将根据实际报名参赛的作品数量进行调整。
每个参赛的项目都要在报名表中明确“拟申报奖项”,如:建筑类中居住建筑、公共建筑(商业综合体、科研办公、医疗、文化体育等)和工业建筑,填写“建筑类-科研办公”。
每个报名表只能申报一个奖项,如果申报两个或两个以上奖项,请务必相应填报两个或两个以上表格并按照不同奖项的侧重点分别准备参赛资料。
如,某项目拟申报“建筑类-商业综合体”及“综合类-拓展应用”,则该项目需要提交两份参赛资料,一份侧重该项目的综合BIM应用以参评“建筑类-商业综合体”奖项,另一份侧重该项目在拓展创新技术方面的突破性BIM应用以参评“综合类-拓展应用”奖项。
(2)请严格遵守各奖项类别的报奖项目范围:建筑类奖项限工业与民用建筑工程的设计项目申报,基础设施类奖项限基础设施工程的设计项目申报,综合类奖项为设计类项目以外例如施工、运维、可持续发展等项目申报。
注:(1)请于2020年4月30日前将所填报名表通过电子邮件或者传真提交至会务组,电子邮件:***,***,传真至********转2006。
联系人:XXX,周琳瑜,电话:********转2002、2008,********,********,********或********。
(2)参赛者也可以访问中国勘察设计协会网站(******。
(4)大赛组委会将于2020年4月22日下午3点安排“第十一届‘创新杯’建筑信息模型(BIM)应用大赛”网络答疑会,请注意查收组委会通知。
三、作品提交要求如下:(1)参赛者在比赛规定的期限内(截止日期为2020年6月30日,以当地邮戳为准)将以下要求的参赛文件保存在U盘内,连同加盖公章免责授权文件一起,快递或邮寄(为确保作品准时收集,建议递后致电确认)至:创新杯组委会。
全国高中化学竞赛试题集萃(二)三、本题包括2小题,共24分。
(第26题6分,第27题18分)26. S2O在碱性条件下发生的歧化反应如下:S2O+OH-→S2-+S2O42-+ SO32-+H2O该反应包含两个独立的歧化反应,它们的离子方程式分别为①、②。
如果这两个独立的歧化反应是等物质的量发生的,则按上述S2O的总歧化反应的配平的离子方程式为③。
27. 在酸性溶液中IO3-离子被I-离子还原生成碘,在碱性溶液中IO3-离子不被I-离子还原,而无论在酸性或碱性溶液中IO4-都被I-离子还原。
在酸性溶液中,IO3-离子与I-离子反应的方程式为①,IO4-离子与I-离子反应的方程式为②;在碱性溶液中IO4-离子与I-离子反应的方程式为③。
现有1升含有IO3-和IO4-离子的混合溶液,用移液管取出25.00cm3放入锥形瓶中,酸化后加入过量的固体碘化钾,用0.1014 mol·dm-3的硫代硫酸钠标准溶液滴定,消耗24.65cm3硫代硫酸钠标准溶液;另取上述混合液25.00cm3,用碳酸氢钠溶液缓冲到pH=8,加入过量的固体碘化钾,用0.05020 mol·dm-3的亚砷酸钠标准溶液滴定,消耗4.98cm3亚砷酸钠标准溶液(酸根离子均为正酸根离子)。
第一次滴定的离子方程式为④,产物中的含氧阴离子的Lewis结构式为⑤,第二次滴定的离子方程式为⑥,产物中的含氧阴离子的几何构型为⑦。
在1升原溶液中,IO3-离子的mol数为⑧,IO4-离子的mol数为⑨。
四、本题包括2小题,共19分。
(第28题15分,第29题4分)28. 硼烷化学是二十世纪的产物,由于它有可能作为高能燃料而促使其化学迅速发展,五十年代后,硼烷的立体化学、结构和键合理论有很大发展,已成为现代无机化学的重要内容之一。
最简单的硼烷是B2H6(乙硼烷),它属于①电子化合物(填缺、富、正常),它燃烧能放出大量的热,其燃烧反应方程式为②,它之所以没有实际应用作火箭燃料,是因为⑴③,⑵④。
在180℃时乙硼烷与NaBH4反应,得到一种钠盐和一种气体。
其钠盐中含有由B和H两种元素组成,式量为141.82,电荷为-2的离子,在这种离子中,B和H的质量分数分别为:B:91.47%,H:8.53%。
B2H6与NaBH4反应的化学方程式为⑤,该反应转移的电子数为⑥,在产物中硼元素的平均氧化数为⑦,该反应的氧化剂是⑧,还原剂是⑨。
乙硼烷还能与氨气反应,生成共价型离子化合物,且阴、阳离子都有四面体结构,其阳离子的化学式为⑩,阴离子的化学式为,化学反应方程式为。
29. 有一立方晶系AB型离子化合物,A的离子半径为61pm,B的离子半径为220pm,则B离子的堆积方式为①,A离子占有B离子围成的②空隙中,该类空隙占有率为③%,该晶体属于④型。
五、本题包括3小题,共22分。
(第30题4分,第31题6分,第32题12分)30. 某分子式为C5H10的化合物中,存在着分子内张力,从核磁共振谱中可知,分子内有三类不同化学环境的碳原子和四类不同化学环境的氢原子,它可以发生加成反应,此化合物的结构式为①(注意立体构型),它的命名为(用系统法命名)②。
31. α-氨基丙酸是蛋白质中的一个成分,它可由另一个α-氨丙酸[L-(-)-丝氨酸]通过一系列的反应制得。
将下列反应所得的中间产物填写在答题卡中相应的位置处。
CO NH23CHHO CH2CONH2CH OHL-(-)-丝氨酸32. 分子式为C10H10的某烃(A)与氯化亚铜的氨溶液不起反应,在HgSO4存在条件下(A)与稀硫酸(H2SO4+ H2O)反应,生成化合物(B)和(C),它们的分子式均为C10H12O。
化合物(B)能和羟氨(NH2OH)发生反应,并能起卤仿(NaOH+X2)反应,化合物(C)也能与羟氨反应,但不起卤仿反应。
化合物(A)与高锰酸钾酸性溶液共热,得到间苯二甲酸。
则:(A)的结构式为①,(B)的结构式为②,(C)的结构式为③。
化合物(B)+羟氨反应的产物为④,化合物(B)与卤仿应的产物为⑤,化合物(C)+羟氨反应的产物为⑥。
六、本题包括2小题,共13分。
(第33题3分,第34题10分)33. 锂与H2反应生成氢化锂时,在生成物中常含有未反应的锂。
常用气体容量法测定氢化锂中未反应的金属锂的含量。
在22℃和97.46kPa时,0.205g样品与水反应,收集到561cm3未经干燥的氢气,试计算该样品中未反应的金属锂的质量百分比。
(已知22℃时水的饱和蒸气压为2.67kPa)34.试回答下列问题:⑴下列物种的化学式为A ①,B ②,C ③。
⑵完成下列变化的离子方程式A(aq)④,B+H2C2O4→⑤⑶A转化为C的产率为⑥⑷为在工业上实现A全部转化成C,实用的方法是⑦,化学表达式为⑧。
七、本题包括3小题,共22分。
(第35题8分,第36题6分,第37题8分)35. 在某KReO4酸性溶液中含Re26.65mg,将其通过一个装有Zn粒的反应柱后,ReO4-离子被锌还原,用0.02000mol·dm-3KMnO4标准溶液滴定还原后收集到的溶液(包括洗涤液),当滴到11.45cm3时,还原态的Re又全部被氧化成ReO4-。
⑴用计算说明被还原后的Re氧化数。
⑵用Re元素的核外电子构型说明此结果是合理的。
⑶试画出ReO4-的结构式(几何构型)。
36. 绿色植物的光合作用的总反应式为6CO2(g)+6H2O(l)C6H12O6(s)+ 6O2(g)每放出1分子O2需吸收波长为6.88×10-7m的8个光量子,1mol O2只能植物贮存469kJ·mol-1的能量。
在人体中,糖是体内能量主要的来源,人体所需的热量有70%是由糖类转化提供的,1mol 葡萄糖完全氧化时在理论上可释放2872 kJ·mol-1热量。
在人体内葡萄糖完全氧化分解时的能量变化方程式为C6H12O6+ 6O2+38H3PO4+38ADP→6CO2+44H2O+38A TPA TP+H2O→ADP+H3PO4ΔH=-36.0 kJ·mol-1请回答下列问题:⑴计算光合作用中绿色植物的能量转换效率。
⑵计算人体内葡萄糖完全氧化分解时能量的利用率。
⑶若将光合作用反应的逆反应设计成一个原电池,即葡萄糖的燃料电池,则其正极的电极反应式为▲,其负极的电极反应式为▲。
(光子的能量公式为,式中h为普朗克常数6.626×10-34J·s,c为光速,3.000×108m·s-1,λ为光的波长。
)37. 最简单的二元硼氮化合物可以通过下列反应合成:B2O3(l) + 2NH3(g) 2BN(s) + 3H2O(g)反应产生的氮化硼的结构与石墨结构相类似,但上、下层平行,B、N原子相互交替(见图)。
层内B-N核间距为145pm,面间距为333pm。
请回答下列问题:⑴试画出层状六方氮化硼的晶胞。
⑵写出晶胞中各原子的原子坐标。
⑶试计算层状六方氮化硼晶体的密度。
⑷在高压(60kbar)、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼,它与金刚石有类似结构。
若立方氮化硼晶胞的边长为361.5pm,试计算立方氮化硼晶体中B-N键的键长。
CO2光和叶绿素参考答案三、共24分26. (6分)①5S2O+14OH-=4S2-+3S2O42-+7H2O (2分)②S2O+4OH-=S2-+ SO32-+2H2O (2分)注:①、②次序可以交换。
③10S2O+34OH-=9S2-+3S2O42-+ 5SO32-+17H2O (2分)27. (18分) ①IO3-+5I-+6H+=3I2+3H2O (2分) ②IO4-+7I-+8H+=4I2+4H2O (2分)③IO4-+I-+ H2O=IO3-+I2+2OH- (2分) ④I2+2S2O32-=2I-+ S4O62- (2分)⑤(2分) ⑥AsO33-+I2+2OH- =AsO43-+ 2I-+H2O (2分)⑦正四面体(2分) ⑧0.00333mol(2分) ⑨0.01000 mol(2分)四、共19分28. (15分)①缺(1分) ②B2H6+3O2=3B2O3+3H2O (2分)③硼烷的热分解产物有毒(1分)④硼烷在空气中易着火爆炸(1分)。
⑤5 B2H6+2Na[BH4]= Na2[B12H12]+13H2↑(2分)⑥26e(1分)⑦+5/6(1分)⑧B2H6、Na[BH4] (1分) ⑨B2H6、Na[BH4] (1分)⑩[(NH3)2BH2]+ (1分)BH4- (1分)B2H6+2NH3=[(NH3)2BH2] [BH4] (2分)29. (4分)①立方面心(1分)②正四面体空隙(1分)③50% (1分)④ZnS型(1分)五、共22分30. (4分)①CH3HCH3HHH(CH3HCH3HHH)(2分)②顺-1,2-二甲基环丙烷,或(1R,2S)-1,2-二甲基环丙烷(2分)31. (6分)①OCH3CONH ClCHHO CH2+②OCH3CONH ClCHCl CH2+③OCONH2CHCl CH2(每空各2分)32. (12分)(每空各2分)①CH3CH3C C②CH3CH3CH2CO③CH3CH3CH2CO④CH3CH3CH2CNOH⑤CH3CH2COOH(Na)+CHX3⑥CH3CH3CH2CNOH六、共13分。
(第33题3分,第34题10分)33.(3分)解:LiH+ H2O=LiOH+H2↑2Li+2H2O=2LiOH+H2↑(1分)设样品中锂的质量分数为x0.205(1-x) 7.949+0.205x6.941 ×2(97.46-2.67)×0.5618.314×(273.2+22)(1分)x=0.374 (1分)34.(10分)⑴①K2MnO4(1分)②MnO2(1分)③KMnO4(1分)④3 MnO42-+O2+2H2O=2 MnO4-+ MnO2+4OH-(2分)⑵⑤MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O (2分)⑶⑥66.67% (1分)⑷⑦电解法(1分)⑧阳极:MnO42--e→MnO4-(1分)七、共22分35. (8分)解:⑴ReO4-中Re为+7氧化态,它的物质的量n=26.65/186.2=0.1434mmol (1分)在MnO4-→Mn2+的变化中,1mol MnO4-得到5mol电子,则11.45mL 0.02000mol/L MnO4-共得到电子n e=0.02000×11.45×5=1.145mmol电子(1分)1molReO4-失去的电子为 1.145/0.1431=8 mol电子(1分)∴被还原后Re的氧化数为7-8=-1(1分)⑵Re的电子构型为[Kr]4f145d56s2,获得一个电子后,其电子构型为[Kr]4f145d66s2,这是一种合理的电子排布式。