细胞培养14-2-27
- 格式:docx
- 大小:38.20 KB
- 文档页数:5




各种孔板细胞接种量总结下各种孔板细胞接种量仅供参考细胞培养瓶(板)接种量生长面积容量细胞数(大约)96孔板4~5×10 4 35mm培养皿1×10 648 孔板 1.3×10 5 60mm培养皿 2.6×10 624孔板 2.5×10 5 100mm培养皿7×10 612孔板5×10 5 150mm培养皿 1.8×10 76孔板 1.2×10 6细胞瓶面积容量工作体积细胞数目612.5cm2 25ml 2ml 5×10 525cm2 50ml 5ml 1×10 635cm2 75ml 10ml 2×10 675 cm2 250ml 15ml 4×10 68150cm2 700ml 40ml 1.1×107补充:不同孔板所加培养液的液面都不宜太深,一般在2~3mm范围,结合不同孔的底面积就可算出各培养孔的适宜加液量(参考下表)。
若加液量过多会影响气体(氧气)交换,而且在搬动过程中易溢出造成污染。
具体所加细胞密度依实验的目的不同灵活掌握。
注:各种单层生长的细胞在培养皿中长满的细胞数,主要取决于器皿底表面积和细胞体积的大小。
上表以Hela细胞为例给出的可获细胞量仅作参考。
教你如何用WORD文档(2012-06-27 192246)转载▼标签:杂谈1. 问:WORD 里边怎样设置每页不同的页眉?如何使不同的章节显示的页眉不同?答:分节,每节可以设置不同的页眉。
文件――页面设置――版式――页眉和页脚――首页不同。
2. 问:请问word 中怎样让每一章用不同的页眉?怎么我现在只能用一个页眉,一改就全部改了?答:在插入分隔符里,选插入分节符,可以选连续的那个,然后下一页改页眉前,按一下“同前”钮,再做的改动就不影响前面的了。
简言之,分节符使得它们独立了。
这个工具栏上的“同前”按钮就显示在工具栏上,不过是图标的形式,把光标移到上面就显示出”同前“两个字来。

DMEM(A) 细胞培养基(粉末型)成分DMEM(H) 细胞培养基(粉末型)成分DMEM(L) 细胞培养基(粉末型)成分【DMEM专题】DMEM细胞培养基(二)配制方法及注意事项配制方法:(1)在一个尽可能接近总体积的容器中加入比预期培养基总体积少5%的双蒸水。
(2)在室温(20℃到30℃)的水中加入干粉培养基,轻轻搅拌,不要加热。
(3)水洗包装袋的内部,转移全部的痕量干粉到容器内。
(4)加NaHCO3到培养基中。
(5)用双蒸水稀释到想要的体积,搅拌溶解。
注意不要过分搅拌。
(6)通过缓慢搅拌加入1N NaOH 或1N HCL调节pH值,由于pH值在过滤时会上升0.1到0.3,因而调节pH值使它比最终想要的pH值低0. 2到0.3。
培养基在过滤前要保持密封。
配制培养基要注意以下问题:●认真阅读说明书。
说明书都注明干粉不包含的成分,常见的有NaHC O3、谷氨酰胺、丙酮酸钠、HEPES等。
这些成分有些是必须添加的,如NaHCO3、谷氨酰胺,有些根据实验需要决定。
●配制是要保证充分溶解,NaHCO3、谷氨酰胺等物质都要等培养基完全溶解之后才能添加。
●配制所用的水应是三蒸水,离子浓度很低。
●所用器皿应严格消毒。
●配制好的培养基应马上过滤,无菌保存于4度。
●液体培养基主要是为了科研工作的方便而设计的培养基,它是一种灭菌后保证无菌的溶液,必要时可制成无内毒素等的溶液,可节省科研人员的工作量。
DMEM各种成分都有什么作用一般的基础培养基包括四大类物质:无机盐、氨基酸、维生素、碳水化合物。
(1)无机盐:对调节细胞渗透压、某些酶的活性及溶液的酸碱度都是必须的。
(2)氨基酸:缬氨酸、亮、异亮、苏、赖、色、苯丙、蛋、组、酪、精氨酸、胱氨酸(L型)都是细胞用以合成蛋白质的必需氨基酸,不能由其他氨基酸或糖类转化合成。
除此之外,还需要谷氨酰胺(glutamine)。
谷氨酰胺具有特殊的作用,对细胞的培养特别重要,能促进各种氨基酸进入细胞膜;它所含的氮是核酸中嘌呤和嘧啶的来源,还是合成—磷酸腺苷、二磷酸腺甘和三磷酸腺苷的原料。
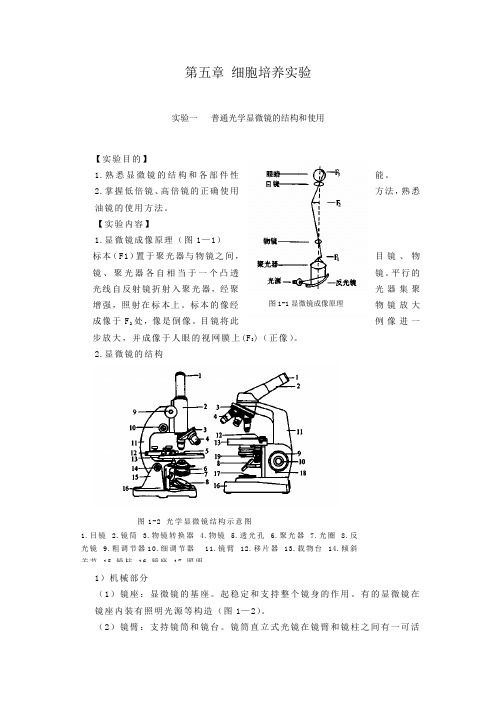
第五章 细胞培养实验实验一 普通光学显微镜的结构和使用【实验目的】1.熟悉显微镜的结构和各部件性能。
2.掌握低倍镜、高倍镜的正确使用方法,熟悉油镜的使用方法。
【实验内容】1.显微镜成像原理(图1—1)标本(F1)置于聚光器与物镜之间,目镜、物镜、聚光器各自相当于一个凸透镜。
平行的光线自反射镜折射入聚光器,经聚光器集聚增强,照射在标本上。
标本的像经物镜放大成像于F 2处,像是倒像。
目镜将此例像进一步放大,并成像于人眼的视网膜上(F 3)(正像)。
2.显微镜的结构1)机械部分(1)镜座:显微镜的基座。
起稳定和支持整个镜身的作用。
有的显微镜在镜座内装有照明光源等构造(图1—2)。
(2)镜臂:支持镜筒和镜台。
镜筒直立式光镜在镜臂和镜柱之间有一可活图1-2 光学显微镜结构示意图1.目镜2.镜筒3.物镜转换器4.物镜5.透光孔6.聚光器7.光圈8.反光镜 9.粗调节器10.细调节器 11.镜臂 12.移片器 13.载物台 14.倾斜关节 15.镜柱 16.镜座 17.照明 图1-1显微镜成像原理动的关节叫倾斜关节,可使镜臂作适当倾斜,便于观察。
镜筒倾斜式显微镜由于镜臂和镜柱连为一体,故无此关节。
(3)镜筒:位于镜臂前方的圆筒,上端安装目镜,下端装有旋转盘。
根据镜筒的数目,光镜可分为单筒式和双筒式两类。
(4)载物台:在镜筒下方,方形或圆形.放玻片标本用。
载物台中央有一圆形通光孔,两旁备有一压片夹。
有的载物台上装有标本移动器,移动器上装有弹簧夹,用于固定标本片。
移动器的一侧有两个旋钮,转动旋钮可使玻片前后左右移动。
(5)物镜转换器:圆盘状,在镜筒下方,其上装有3—4个放大倍数不同的物镜。
旋转物镜转换器可更换物镜。
(6)聚焦调节器;为调节焦距之用。
大旋钮为粗调节器,转动粗调节钮可使镜筒(或载物台)升降,调节焦距。
旋转一周可使镜筒(或戴物台)升降10mm。
一般用于低倍镜调焦。
小旋钮为细调节器,转动细调节钮可使镜筒(或超物台)缓慢升降,每旋转一周约使镜筒(或载物台)升降0.1mm。
细胞培养之细胞计数实验原理:当待测细胞悬液中细胞均匀分布时,通过测定一定体积悬液中的细胞的数目,即可换算出每毫升细胞悬液中细胞的细胞数目。
具体操作:一.准备工作:取一瓶传代的细胞,按照《传代细胞培养(消化法)》中的传代方法繁殖细胞,待长成单层后以被使用.二.细胞悬液制备:用0.25%的胰蛋白酶液消化、PBS液洗涤后,加入培养液(或Hanks液或PBS 等平衡盐溶液),吹打制成待测细胞悬液。
三.细胞计数:1.取一套血球计数板,将特制的盖玻片盖在血球计数槽上.2.制备计数用的细胞悬液:用吸管吸5滴细胞悬液到一离心管中,加入5滴台盼蓝染液(0.4%)或苯胺黑。
活细胞不会被染色,加入染液后就可以在显微镜下区别活细胞和死细胞。
3.将细胞悬液滴入计数板:将待测细胞悬液吹均匀,然后吸取少量悬液沿盖片边缘缓缓滴入,要保证盖片下充满悬液,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。
4.统计四个大格的细胞数:将血球计数板放于显微镜的低倍镜下观察,并移动计数板,当看到镜中出现计数方格后,数出四角的四个大铬(每个大格含有16个中铬)中没有被染液染上色的细胞数目。
5.计算原细胞悬液的细胞数:按照下面公式计算细胞密度:细胞悬液的细胞数/ml=(四个大格子细胞数/4)×2×104说明:/4因为计数了4个大格的细胞数;×2因细胞悬液:染液=1:1稀释;×104因为计数板中每一个大格的体积为:1.0mm×1.0mm×0.1mm=0.1mm3而 1ml=1000mm3四.细胞计数要点:1.进行细胞计数时,要求悬液中细胞数目不低于104个/ml,如果细胞数目很少要进行离心再悬浮于少量培养液中;2.要求细胞悬液中的细胞分散良好,否则影响计数准确性。
3.取样计数前,应充分混匀细胞悬液,尤其时多次取样计数时更要注意每次取样都要混匀,以求计数准确;4.数细胞的原则是只数完整的细胞,若细胞聚集成团时,只按照一个细胞计算。
ips 培养技术手册IP细胞培养技术手册1. 引言细胞培养技术是一种重要的生物学研究方法,用于研究细胞生物学、药理学、毒理学等领域。
IP细胞培养技术是一种特殊的细胞培养方法,通过使用IP细胞培养基和特定的培养条件,可以有效地培养和维持细胞。
本手册将介绍IP细胞培养技术的基本步骤和注意事项。
2. 材料与设备2.1 材料•IP细胞培养基•细胞培养皿•细胞培养瓶•双抗(青霉素和链霉素)•细胞培养相关试剂2.2 设备•CO2培养箱•细胞培养超净工作台•细胞计数仪3. 细胞培养步骤3.1 细胞复苏1.从-80°C冰箱中取出细胞冻存管。
2.将冻存管放入37°C水浴中快速融化。
3.轻柔地将细胞悬液转移至离心管中。
4.加入适量培养基,轻轻吹打细胞,使其均匀分散。
5.将细胞悬液转移至新的培养瓶中,加入适量培养基,混匀。
3.2 细胞培养1.将细胞悬液转移至细胞培养皿中。
2.将细胞培养皿放入CO2培养箱中,37°C、5% CO2条件下培养。
3.每隔一天更换一次培养基。
3.3 细胞传代1.弃去培养皿中的培养基。
2.加入适量胰蛋白酶,轻轻摇晃,使细胞分散。
3.等待细胞消化至适当程度后,加入适量培养基终止消化。
4.使用细胞刮刀将细胞从培养皿壁上刮下。
5.离心收集细胞,弃去上清。
6.加入适量培养基,轻轻吹打细胞,使其均匀分散。
7.将细胞悬液转移至新的培养瓶中,加入适量培养基,混匀。
4. 注意事项1.操作过程中应严格遵守无菌操作原则,避免污染。
2.使用新鲜、合格的细胞培养基和试剂。
3.细胞培养过程中应避免剧烈震荡,以免损伤细胞。
4.定期观察细胞生长状况,如细胞密度、形态等,及时调整培养条件。
5.细胞传代时,应注意控制胰蛋白酶的浓度和消化时间,避免过度消化。
5. 结语IP细胞培养技术是一种有效的细胞培养方法,通过遵循正确的操作步骤和注意事项,可以获得高质量的细胞。
希望本手册对您的研究工作有所帮助。
如有其他问题,请随时与我们联系。
双抗就是青链霉素混合液,青链霉素混合液(100X) (Penicillin-Streptomycin Solution)双抗,是专门用于细胞培养的,可以直接添加到细胞培养液内。
青霉素-链霉素溶液(100X)中,青霉素的含量为10000U/ml,链霉素的含量为10mg/ml。
在细胞培养液中推荐的青霉素的工作浓度为100U/ml,链霉素的工作浓度为0.1mg/ml。
双抗起的作用:抗生素,抑制细菌生长;避免细胞污染。
HSC- T6系为SV40 转染SD 大鼠的HSC-T6(大鼠肝星状细胞系):弃培液-->以PBS液洗两次-->0.05%胰酶消化-->镜下观察细胞变圆(约5分钟)-->以完全培液(DMEM培养基+10% FCS小牛血清)终止反应-->吹打,1:3 - 1:4接种,然后继续培养。
该细胞系生长速度很快,所以采用1:3 - 1:4接种,而且换液间隔不要超过48h,否则细胞容易脱落下来/view/240cc46925c52cc58bd6be77.htmlHSC-T6(大鼠肝星状细胞系):来源于美国Friedman实验室,从建系到现在已经传了78代。
HSCs,是活化的HSCs,能表达α- SMA、波形蛋白(vimentin),具有表达高水平COL-Ⅰ、TIMP- 1 mRNA特性,该细胞系能够长期传代,传代后具有稳定的表型。
道坤,梁海军,申保生,孙屹峰,乔汉臣,. 三甲益肝颗粒含药血清对HSC-T6细胞形态、增殖和凋亡的影响[J]. 第三军医大学学报,2010,(5).免疫组化1 免疫组化的概念免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。
2 免疫组化的分类免疫组织化学技术按照标记物的种类可分为免疫荧光法、免疫酶法、免疫铁蛋白法、免疫金法及放射免疫自影法等。
3 免疫组化实验所用的组织和细胞标本实验所用主要为组织标本和细胞标本两大类,前者包括石蜡切片(病理大片和组织芯片)和冰冻切片,后者包括组织印片、细胞爬片和细胞涂片。
其中石蜡切片是制作组织标本最常用、最基本的方法,对于组织形态保存好,且能作连续切片,有利于各种染色对照观察;还能长期存档,供回顾性研究;石蜡切片制作过程对组织内抗原暴露有一定的影响,但可进行抗原修复,是免疫组化中首选的组织标本制作方法。
4 免疫组化实验所用的抗体免疫组化实验中常用的抗体为单克隆抗体和多克隆抗体。
单克隆抗体是一个B淋巴细胞克隆分泌的抗体,应用细胞融合杂交瘤技术免疫动物制备。
多克隆抗体是将纯化后的抗原直接免疫动物后,从动物血中所获得的免疫血清,是多个B淋巴细胞克隆所产生的抗体混合物。
5 常用的染色方法根据标记物的不同分为免疫荧光法,免疫酶标法,亲和组织化学法,后者是以一种物质对某种组织成分具有高度亲合力为基础的检测方法。
这种方法敏感性更高,有利于微量抗原(抗体)在细胞或亚细胞水平的定位,其中生物素—抗生物素染色法最常用。
6 免疫组化操作步骤1.切片常规脱蜡至水。
如需抗原修复,可在此步后进行2. 缓冲液洗3min/2 次。
3. 为了降低内源性过氧化物酶造成的非特异性背景染色, 将切片放在Hydrogen Peroxide Block 中孵育10-15 分钟。
4. 缓冲液洗5min/2 次。
5. 滴加Ultra V Block ,在室温下孵育5 分钟以封闭非特异性的背景染色。
(注:孵育不要超过10 分钟,否则会导致特异性染色降低。
如果一抗的稀释液中含有 5 -10% 正常羊血清,这一步可以省略。
)6. 缓冲液洗5min/2 次。
7. 滴加一抗工作液37 ℃孵育1 -2 小时。
(具体孵育时间和温度由试验者最终决定)8. 缓冲液洗5min/2 次。
9 .滴加Primary Antibody Enhancer( 增强子) , 在室温下孵育20 分钟。
10 .缓冲液洗5min/2 次。
11 .滴加HRP Polymer( 酶标二抗) ,在室温下孵育30 分钟。
(注:HRP Polymer 对光敏感,应避免不必要的光暴露并储存在不透明的小瓶中。
)12 .缓冲液洗5min/2 次。
13 .向1ml DAB Plus Substrate ( 或AEC Plus Substrate) 中滴加1-2 滴DAB Plus Chromogen(或AEC Plus Chromogen), 混匀后滴加到切片上,孵育3 -15 分钟。
(具体时间由染色深浅决定。
)14 .自来水充分冲洗, 复染,脱水, 透明, 封片。
二.免疫组化( 三步法) 操作步骤:( 1 )、石蜡切片脱蜡至水。
( 2 )、3%H 2 O 2 室温孵育5-10 分钟,以消除内源性过氧化物酶的活性。
( 3 )、蒸馏水冲洗,PBS 浸泡5 分钟x2 (如需抗原修复,可在此步后进行)。
( 4 )、5-10% 正常山羊血清(PBS 稀释)封闭,室温孵育10 分钟,倾去血清,勿洗。
滴加一抗工作液,37 ℃孵育1-2 小时或4 ℃过夜。
( 5 )、PBS 冲洗,5 分钟x3 次。
( 6 )、滴加适量生物素标记二抗工作液,37 ℃孵育10-30 分钟。
(7 )、PBS 冲洗,5 分钟x3 次。
(8 )、滴加适量的辣根酶或碱性磷酸酶标记的链霉卵白素工作液,37 ℃孵育10-30 分钟。
(9 )、PBS 冲洗,5 分钟x3 次。
(10 )、显色剂显色3-15 分钟(DAB 或NBT/BCIP)(11 )、自来水充分冲洗,复染,脱水,透明,封片。
三. 冰冻切片免疫组化染色步骤:冰冻切片4-8um ,室温放置30 分钟后,入 4 ℃丙酮固定10分钟,PBS洗,5分钟x3,用过氧化氢孵育5-10分钟,消除内源性过氧化物酶的活性。
7 免疫组化实验结果的判定和分析从实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析,图片的确定与选取,相关数据的提供,上述工作是免疫组化工作的重点内容,只有严格的实验设计,标准的实验操作,专业化的结果分析才能更好的满足客户的要求,这点对于形式为腹水,上清,培养液之类的抗体显得更为重要。
关于上述服务内容应该在实验开始前由双方明确,一般而言,客户方实验前应提出需要什么样的结果与分析,例如是简要还是详细的描述实验结果,需要实验数据否,图片的数量与规格等。
如果为双盲试验或有第三方参与,则事先申明。
8 免疫组化在临床工作的意义近年来,随着免疫组织化学技术的发展和各种特异性抗体的出现,使许多疑难肿瘤得到了明确诊断。
在常规肿瘤病理诊断中,5%-10%的病例单靠H.E.染色难以作出明确的形态学诊断。
尤其是免疫组化在肿瘤诊断和鉴别诊断中的实用价值受到了普遍的认可,其在低分化或未分化肿瘤的鉴别诊断时,准确率可达50%-75%。
免疫组织化学的临床应用主要包括以下几方面:(1)恶性肿瘤的诊断与鉴别诊断;(2)确定转移性恶性肿瘤的原发部位;(3)对某类肿瘤进行进一步的病理分型;(4)软组织肿瘤的治疗一般需根据正确的组织学分类,因其种类多、组织形态相像,有时难以区分其组织来源,应用多种标志进行免疫组化研究对软组织肿瘤的诊断是不可缺少的;(5)发现微小转移灶,有助于临床治疗方案的确定,包括手术范围的确定。
(6)为临床提供治疗方案的选择。
9 免疫组化经验总结1、我认为首先需要掌握好免疫组化实验的原理,知道每一个操作步骤的目的,这样你才能大胆地去改革和纠正一些错误的步骤,如抗体孵育条件主要是抗体浓度、温度、时间,这三者一般是相互成反比的(相对),其中浓度是最重要的先决条件,温度决定反应的速度、时间决定反应的量。
比如温度有4℃、室温、37℃。
我推荐4℃最佳,反应最温和,背景较浅;而37℃反应速度较快,时间较短;室温我不太提倡,除非你每次都把环境温度控制在一定的范围,否则,尽量选择前两者。
2、定位和定性是免疫组化最大的优势。
相比于其他蛋白检测方法,免疫组化具有定位较直接准确、定性灵敏度高,是定位检测分析首选方法。
尤其对于有些因子的转位研究十分有用。
3、免疫组化结果定量分析的前提是高质量的染色切片。
免疫组化结果也能定量分析,但必须是背景染色浅而特异性染色较深的情况下,分析最为准确,这种原则可能也是我们日常审稿时判定研究结果的必备条件。
4、免疫组化实验一定要设置阳性和阴性对照。
阳性对照一般是用肯定表达这种抗原的切片来做;阴性对照一般是用PBS或非一抗替代一抗来进行反应,其余步骤均一致。
前者是排除方法和实验系统有无问题;后者是排除有无一抗外的非特异性染色。
5、免疫组化技术掌握与否的鉴定标准是同一切片或不同切片中不同抗原均从摸索浓度或条件而做出优良的染色切片。
我发现许多研究生把网上或者说明书摸索的反应条件、浓度、方法步骤,重复运用于同一性质的切片和同一种抗体,做出来后就觉得自己已经掌握了免疫组化方法,更换一种抗体后,居然连二抗的种属来源都拿错了。
失败往往促进你去思考试验原理和过程,成功有时也让自己很自傲。
6、免疫组化的应用广泛,是当前实验研究的最重要方法之一。
如今发SCI论文时,明显感觉仅靠量化的数据来发文章很难,加一些形态学数据或图片,老外十分欢迎,可能是怕你学术造假吧。
当然也不能做假阳性或假阴性结果。
代谢物组学代谢物组学(英语:metabolomics)是在后基因组学时代兴起的一门跨领域学科,其主要目标是定量的研究生命体对外界刺激、病理生理变化、以及本身基因突变而产生的其体内代谢物水平的多元动态反应。
代谢物组学诞生于上个世纪末,由英国伦敦帝国大学Jeremy Nicholson教授创立,之后得到迅速发展并渗透到多项领域,比如疾病诊断、医药研制开发、营养食品科学、毒理学、环境学,植物学等与人类健康护理密切相关的领域。
代谢物组学是对特定细胞过程遗留下的特殊化学指纹的系统研究,更具体地说,是对小分子代谢物组的整体研究。
代谢物组定义为在一个生物体内所有的代谢物的集合,而这些代谢物是此生物体基因表达的终产物。
因此,当信使RNA基因的表达数据和蛋白质组学的分析无法描述细胞体内的所有生理活动的时候,对代谢物组的表征是个非常重要的补充,我们可以用来它对细胞的生理活动实现一个瞬时快照。
1代谢物和代谢物组(metabolite and metabolome)代谢物通常指在生命体内实现代谢过程的小分子有机化合物。
一级代谢物直接参与细胞的正常生长、发展和繁殖。
二级代谢物不直接参与这些过程,但是通常具备重要的生态功能,比如说抗生素和色素。