内氢键对有机物酸性的影响.doc
- 格式:doc
- 大小:66.50 KB
- 文档页数:8

氢键的形成以及对物质性质的影响090901135 姚瑶摘要:本文主要论述了氢键的本质,形成,种类以及对物质性质的影响,阐述了氢键形成的条件以及分子中存在氢键物理和化学性质的变化。
关键词:氢键,形成条件,影响在高中化学课本必修2第二章中讲微粒之间的相互作用力涉及到氢键的内容,NH3,H2O,HF等分子之间存在一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。
氢键是已经以共价键与其他原子键合的氢原子与另一个原子间产生的分子间作用力。
原子半径较小,非金属性很强的原子X(N,O,F)与H原子形成强极性共价键,与另一个分子中半径较小,非金属性很强的原子Y(N,O,F)产生较强的静电吸引,形成氢键,通式X-H…Y-H(X,Y可同可不同,一般为N,O,F)。
氢键可以分为分子间氢键和分子内氢键。
根据氢键的形成条件,CHF3满足氢键形成条件,但CHF3能否形成分子间氢键?形成氢键必须满足俩个基本条件,第一:分子中必须有一个与电负性很强的元素形成强极性键的氢原子,第二:另一分子中必须有带孤对电子对,电负性大,且原子半径小的元素(如F,O,N等),因为氢原子的特点是原子半径小,结构简单,核外只有一个电子,无内层电子,它与电负性大的元素形成共价键后,电子强烈电负性大的元素一边,使氢几乎成为赤裸的质子,呈现相当强的正电负性,因此它易与另一分子中电负性大的元素接近,并产生静电吸引作用,从而形成氢键。
但分析CHF3的结构,其中的H原子是不符合形成氢键条件的,因为H是和电负性不太大的C原子相连的。
在CHF3分子中,三个F原子和C相连,F原子电负性很大,是否会由于三个F对C的作用从而诱导H有了较大的正电性而能够形成氢键呢?我们知道,若分子间形成氢键,则同类型化合物的熔沸点将出现异常现象。
因为氢键的形成会使分子间有了较强的结合力,化合物的熔点和沸点会显著升高。
如某些氢化物的沸点递变顺序:NH3>PH3>AsH3>SbH3结构和组成相似的分子型物质,沸点随分子量增大而升高,但这里却出现意外,原因是HF,H2O,NH3分子间形成了氢键。

有机化学基础知识点有机物的氢键和范德华力有机化学基础知识点:有机物的氢键和范德华力有机化学是研究有机物及其反应的科学领域。
在有机化学中,氢键和范德华力是两个重要的概念,它们在分子之间的相互作用中起着关键作用。
本文将介绍有机物的氢键和范德华力的基本概念和特点。
一、有机物的氢键氢键是指由氢原子与一对电负性较高的原子之间的相互作用力。
在有机化学中,氢键的形成主要涉及氢原子和氮、氧、氟等元素的原子之间的作用。
有机物中,氢键通常出现在含有特定官能团的分子中,如羟基(-OH)、胺基(-NH2)、酮基(-C=O)等。
这些官能团中的氧、氮原子能够通过共价键与氢原子结合,并与其他分子中的氧、氮原子形成氢键。
氢键的形成能够增加分子间的相互吸引力,使有机物的沸点、溶解度和表面张力等物理性质发生改变。
同时,氢键也影响有机物的化学性质,例如反应速率和反应路径等。
二、有机物的范德华力范德华力是指分子间由于电子在运动中形成的瞬时偶极子与相邻分子诱导出的即时偶极子之间的作用力。
范德华力是一种较弱的相互作用力,它普遍存在于物质之间。
在有机物中,范德华力是分子之间相互作用的主要力量。
即使是非极性分子,由于电子在运动中出现的瞬时偶极矩,也能够与其他分子诱导出即时偶极子,从而发生范德华力的相互作用。
范德华力对有机物的物理性质起着重要作用。
范德华力的强弱决定了物质的相对稳定性、沸点、溶解度和相变等性质。
在化学反应中,范德华力也参与了反应的进行和反应速率的影响。
三、氢键与范德华力的比较氢键和范德华力都属于分子间的相互作用力,但在性质和强度上存在一定的差异。
1. 性质:- 氢键:涉及氢原子与电负性较高的原子之间的作用,较为特殊且较强的相互作用力。
- 范德华力:涉及分子间由于电子在运动中形成的偶极子之间的作用,是更为普遍的相互作用力。
2. 强度:- 氢键:通常比范德华力要强,能够在官能团中形成较为稳定的氢键网络。
- 范德华力:相对较弱,但随着分子大小的增加,范德华力也会增强。


有机物熔沸点高低的判断规律1. 有机物分子结构影响熔沸点:有机物分子结构包括化学式、分子量、几何变形等要素,它们会直接影响有机物的熔沸点。
分子结构越复杂,有效的分子键越多,摩尔温度越高,因此熔沸点也越高。
例如,含有环状分子结构的伯胺的熔沸点高于明胺,明胺的熔沸点又高于烷胺。
2. 有机物构数及分子量大小与熔沸点的关系:有机物构数,是指分子中原子数量,分子量则指分子中所有原子的质量之和,二者都会影响有机物的熔沸点。
总体而言,当构数增加时,熔沸点会增加;当分子量增加时,熔沸点也会增加。
这是因为随着构数或分子量的增加,分子内部分子间作用力也就增强,分子之间的摩擦力也就增强,从而使分子凝固的能力也增强,熔沸点也就从而增高。
3. 不同氢键类型的影响作用:氢键是有机物的重要结构元素之一,它的类型及强度会直接影响有机物的熔沸点。
不同类型的氢键对熔沸点的影响也是不同的,氢键的类型越多、类型复杂,整体的氢键强度越高,分子形态也越稳定,熔沸点也就会随之增高。
4. 相同的构数但不同的分子结构对熔沸点的影响:即便构数相同,但分子结构却不相同的有机物,它们的熔沸点也会有很大差别。
这是因为分子结构不同,分子中的氢键也就不同,氢键的类型及强度也就不同,对熔沸点的影响也就不同,从而使得熔沸点产生明显的差别。
5. 氢键类型及强度与熔沸点的关系:氢键类型及氢键强度都会直接影响有机物的熔沸点。
氢键类型越多及强度越高,氢键作用于分子内部会更加紧密,分子形态也就更加牢固,熔沸点也就会相对更高。
总结:有机物的熔沸点与它们的分子结构、构数及分子量、氢键类型以及氢键强度等有关。
其中,分子结构的复杂度及氢键的类型及强度是影响有机物熔沸点的主要因素;构数及分子量大小也会影响有机物熔沸点,但程度不及前两者。

有机化学中的氢键问题●氢键旳饱和性:氢原子小,而A和B原子较大,A—H旳氢原子只能和一种B原子形成氢键。
同步负离子之间互相排斥,另个电负性较大旳B1原子就更难接近氢原子。
●氢键键能由静电作用能、离位能、诱导能和色散能构成。
静电作用能:A—H键旳偶极矩和B旳未共用旳成对电子之间旳能量。
离位能:B原子和氢原子之间旳距离不不小于范德华半径,存在斥力;B原子使得氢原子电子云密度增大,削弱了A—H键键能;B原子旳未共用电子对和A—H旳成键电子云共用化后(事实上三个轨道共同形成三个分子轨道),A—H…B获得额外旳键能。
上述三种变化能量总和称为离位能。
诱导能和色散能:(1)诱导能:永久偶极矩(极性分子)诱导临近分子,使其浮现诱导偶极矩。
永久偶极矩和诱导偶极矩旳之间存在吸引,此互相作用旳能量为诱导能。
(2)色散能:瞬时偶极矩(非极性分子)诱导临近分子,使其浮现诱导偶极矩。
瞬时偶极矩和诱导偶极矩旳之间存在吸引,此互相作用旳能量为色散能。
●形成分子内氢键旳驱动力重要是熵增,其生成能不大。
●通过氢键形成旳螯形环内如果不含双键或一种双键,则五元环最稳定;含两个双键,六元环最稳定。
●一般旳分子内氢键,六元环比五元环更稳定,由于张力更小(原则氢键为180°)●在晶体内形成氢键,则晶体变硬;在液体内形成氢键,使液体粘度和表面张力增长。
●湿熔点法:测量化合物干燥时旳熔点和沾有水旳熔点,两者作差。
若差值较大,则形成分子间氢键;若差值较小,形成分子内氢键。
(19N.V.sidgwick首创)●乙酰丙酮可以形成分子内氢键。
●羧酸一般是以两分子之间形成分子间氢键;过氧酸一般是单分子形成分子内氢键(五元环较稳定)●不能互溶旳实质:同种分子之间旳力不小于不同种分子之间旳力。
●亲核试剂容不容易被溶剂化,取决于溶剂化前后电荷与否会更加分散。
若像F-、OH-体积小电荷密度大旳,溶剂化后负电荷更加分散,故容易溶剂化;若像SCN-、I-体积大电荷密度小,就不容易被溶剂化。
第五章 有机化合物的酸碱性酸碱是化学中的重要概念,从广义的角度讲,多数的有机化学反应都可以被看作是酸碱反应。
因此,酸碱的概念在有机化学中有着重要的应用,在学习有机化学的时候,学习与了解有机化合物的酸碱性是十分必要的。
5.1 Brönsted 酸碱理论1923年,为了克服S. A. Arrehenius 依据电离学说,所提出的水溶液中酸碱理论的不足,丹麦的J. N. Brönsted 和英国的J. M. Lowry 分别独立地提出了新的酸碱理论。
该理论给出的酸碱定义为:凡是能给出质子的任何物质(分子或离子),叫做酸;凡是能接受质子的任何物质,叫做碱。
简言之,酸是质子的给予体,碱是质子的接受体。
因此,Brönsted 酸碱理论又称为质子酸碱理论。
依据Brönsted 酸碱理论,酸给出质子后产生的碱,称之为酸的共轭碱;碱接受质子生成的物质就是它的共轭酸。
即:酸碱 +质子CH3CO 2H CH 3CO 2- + H +C2H 5OHC 2H 5O - + H +可以看出,CH 3CO 2H 给出质子是酸,生成的CH 3CO 2―则是碱。
这样的一对酸碱,称为共轭酸碱对。
C 2H 5OH 和C 2H 5O ―也是如此。
酸、碱的电离可以看作是两对酸碱的反应过程。
例如:CH3CO 2H + H 2OCH 3CO 2- + H 3O +酸1 + 碱2碱1 + 酸2H2O + CH 3NH 2OH - + CH 3NH 3+醋酸在水中的电离,CH 3CO 2H 给出一个质子是酸,H 2O 接受一个质子为碱。
这里,CH 3CO 2H/CH 3CO 2―与H 2O/H 3O +分别是两个共轭酸碱对。
但是,甲胺在水中电离时,H 2O 给出一个质子是酸,CH 3NH 2接受一个质子为碱。
H 2O/OH ―与CH 3NH 2/CH 3NH 3+分别是两个共轭酸碱对。
由此可见, Brönsted 理论中的酸碱概念是相对的。
有机化合物的官能团与物理性质有机化合物是由碳和氢元素组成的化合物,其中碳元素与其他元素(如氧、氮、硫等)形成化学键,并具有不同的官能团。
官能团是有机化合物中具有化学反应活性的基团,不仅决定了有机化合物的化学性质,还对其物理性质产生重要影响。
本文将探讨一些常见官能团及其与有机化合物物理性质之间的关系。
一、羟基(-OH)官能团羟基是有机化合物中最常见的官能团之一,也是醇、酚类化合物的特征性官能团。
羟基的存在会显著影响化合物的物理性质。
首先,羟基的极性使得醇类化合物具有较高的溶解度,特别是在极性溶剂中。
这是因为羟基可以与水分子形成氢键,提高溶解度。
其次,羟基还能形成分子内氢键,从而提高醇类化合物的沸点。
同时,羟基的存在使得醇类化合物具有较高的表面张力和比热容,因此醇类化合物通常具有较高的沸点和融点。
二、羰基(C=O)官能团羰基是由碳氧双键连接的碳氧化合物,它是醛、酮类化合物的典型官能团。
羰基的存在会对有机化合物的物理性质产生显著影响。
首先,羰基的极性使得醛、酮类化合物具有较高的沸点和溶解度。
这是因为羰基可以与水分子形成氢键,促进溶解。
其次,羰基的共振结构使醛、酮类化合物具有较高的化学反应活性,容易发生亲核加成和氧化反应。
另外,酮类化合物中的羰基可以极大地增加它们的极性,使得它们与极性溶剂的相容性更好。
三、羧基(-COOH)官能团羧基是由羰基和羟基组成的官能团,是酸类化合物的特征性官能团。
羧基的存在对有机化合物的物理性质产生显著影响。
首先,羧基的极性使得酸类化合物具有较高的沸点和溶解度。
羧基中的羧酸氢可以与水分子形成氢键,促进溶解。
其次,羧基的酸性使得酸类化合物在溶液中呈酸性反应,能够与碱发生酸碱中和反应。
此外,羧基通过与金属离子形成络合物,使得酸类化合物在有机合成中具有催化作用。
四、氨基(-NH2)官能团氨基是由氮和氢元素组成的官能团,是胺类化合物的特征性官能团。
氨基的存在对有机化合物的物理性质产生显著影响。
有机物中氢键对熔沸点的影响英文回答:Hydrogen bonding is a type of intermolecular force that occurs between a hydrogen atom bonded to an electronegative atom (such as oxygen, nitrogen, or fluorine) and another electronegative atom in a different molecule. This type of bonding is responsible for many unique properties of organic compounds, including their melting and boiling points.Firstly, hydrogen bonding can significantly increase the boiling point of a compound. This is because hydrogen bonds are relatively strong compared to other intermolecular forces, such as van der Waals forces. When a compound contains hydrogen bonding, more energy is required to break these bonds and convert the substance from aliquid to a gas. As a result, the boiling point is higher.For example, let's compare two compounds: ethanol andethane. Both compounds have the same molecular formula,C2H6O, but ethanol contains a hydroxyl group (-OH) that can form hydrogen bonds. Ethanol has a boiling point of78.37°C, while ethane, which lacks hydrogen bondin g, has a boiling point of -88.6°C. The presence of hydrogen bonding in ethanol increases its boiling point by over 150 degrees Celsius compared to ethane.Secondly, hydrogen bonding can also affect the melting point of a compound. Similar to boiling point, compounds with hydrogen bonding generally have higher melting points compared to those without hydrogen bonding. This is because hydrogen bonds need to be broken in order for the substance to transition from a solid to a liquid state.For instance, let's consider the comparison between acetic acid and acetone. Both compounds have the same molecular formula, C3H6O, but acetic acid contains a carboxyl group (-COOH) that can form hydrogen bonds. Acetic acid has a melting point of 16.6°C, while aceto ne, which lacks hydrogen bonding, has a melting point of -94.7°C. The presence of hydrogen bonding in acetic acid increasesits melting point by over 100 degrees Celsius compared to acetone.In conclusion, hydrogen bonding plays a significantrole in determining the melting and boiling points of organic compounds. Compounds with hydrogen bonding generally have higher melting and boiling points compared to those without hydrogen bonding. This is due to the stronger intermolecular forces created by hydrogen bonds, which require more energy to break. By understanding the impact of hydrogen bonding on these physical properties, we can better predict and explain the behavior of organic compounds.中文回答:氢键是一种分子间力,它发生在一个氢原子与一个电负性原子(如氧、氮或氟)之间,并与另一个分子中的另一个电负性原子形成键。
一、氢键1、概念:一种特殊的分子间作用力2、形成条件:①与电负性大且半径小的原子(F、O、N)相连的 H;②在附近有电负性大, 半径小的原子(F、O、N) 3、表示方法:X—H... Y—。
氢键氢键是一种静电作用,是除范德华力外的另一种分子间作用力;氢键的大小介于化学键与范德华力间,不属于化学键,但有键长、键能,氢键具有饱和性、方向性。
二、氢键的存在1、分子间氢键。
如:C2H5OH、CH3COOH、H2O 、HF、NH3 相互之间2、分子内氢键。
如:苯酚邻位上有-CHO、-COOH、-OH和-NO2时,由氢键组成环的特殊结构生物大分子中也存在的氢键三、氢键的强弱(1)、X—H ... Y—:X和Y的电负性越大,吸引电子能力越强,则氢键越强。
如:F 电负性最大,得电子能力最强,因而F-H…F是最强的氢键。
(2)、氢键强弱顺序:F-H…F > O-H…O > O-H…N > N-H…N (注意:C原子吸引电子能力较弱,一般不形成氢键)。
氢键强弱比较四、对物质熔沸点的影响分子间能形成氢键的物质,一般都具有较高的熔点和沸点,这是因为固体熔化或液体气化时除了破坏范德华力外,还必须破坏分子间氢键,从而需要消耗更多的能量。
在同类化合物中能形成分子间氢键的物质,其熔沸点比不能形成分子间氢键的高。
如,第VIA 族元素的氢化物,由H2Te、H2Se 到H2S,随相对分子量的递减,分子间作用力递减,熔沸点依次降低;但H2O 分子间形成了O-H…O 氢键,分子间作用力增强,H2O 的熔沸点陡然升高。
分子内氢键的形成使物质的熔沸点降低。
如,邻、间、对硝基苯酚的熔点分别为45℃、96℃、114℃,这是由于间位、对位硝基苯酚中存在分子间氢键,熔化时必须破坏其中的一部分氢键,熔点较高;而邻硝基苯酚中形成分子内氢键,不形成分子间氢键,故熔点较低。
五、对物质溶解性的影响如果溶质分子与溶剂分子之间形成氢键,则溶质的溶解度会骤增。
目录
目录 ---------------------------------------------------------------------------- - 1 -引言------------------------------------------------------------------------ - 2 -1内氢键对取代苯甲酸酸性的影响 ------------------------------------ -3- 2内氢键对取代酚酸性的影响 ------------------------------------------ -4- 3内氢键对顺反丁烯二酸酸性的影响 --------------------------------- -5- 4总结 ------------------------------------------------------------------------ -6- 参考文献: ------------------------------------------------------------------ -7-
引言
影响有机化合物的酸性的因素有很多,除了溶剂,温度等外部条件外,有机化合物自身结构是一个重要因素。
在结构中又存在着原子和原子间,原子和原子团间,原子团和原子团间的诱导效应,共轭效应,场效应,空间效应以及分子间力,氢键的影响。
氢键是分子内或分子间氢原子和两个电负性比较大而原子半径比较小的原子,如O、N、F,有时Cl或S,相互结合形成的键。
分子内含有氢键的化合物具有环状结构,多数为六员环,五员环较少。
在有机化合物的分子结构中,各种院子或基团间的影响往往不是单一的,有些影响甚至是互相矛盾的。
氢键是分子内或分子间氢原子和两个电负性比较大而原子半径比较小的原子,如O、N、F,有时cl或s,相互结合形成的键。
分子内含有氢键的化合物具有环状结构,多数为六员环,五员环较少。
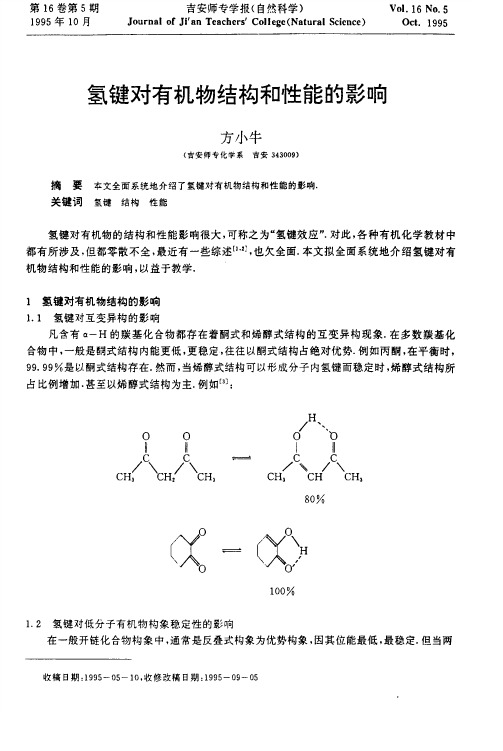
如下面例子中的分子内氢键(虚线表示):
水杨酸乙酰丙酮(烯醇式)水杨醛亚胺
在有机化合物的分子结构中,各种院子或基团间的影响往往不是单一的,有
些影响甚至是互相矛盾的。
例如吸电子的诱导效应(-I)可能和共轭效应(+C)
同时存在;供电子的诱导效应可能和空间位阻效应同时存在;吸电子的诱导效应、
供电子的共轭效应也可以同时和氢键共同存在。
氢键对有机化合物酸性强弱的影
响必须根据其形成情况认真分析才能准确判断[1]。
1 内氢键对取代苯甲酸酸性的影响
苯甲酸分子中苯环上的一个氢原子被羟基取代后有邻、间对三种位置异构
体。
羟基连接到苯环上,既有吸电子的诱导效应,又有供电子的P-π共轭效应。
pKa[2]: 4.20 2.98 4.08 4.58
-OH的吸电子的-I效应使羟基苯甲酸的酸性大于苯甲酸,-OH的供电子的+C效应使羟基苯甲酸的酸性小于苯甲酸。
在对-羟基苯甲酸中-OH处于-COOH的间位,-OH与苯环的P-π共轭的+C 效应不能传递带处于间位的-COOH上,起作用的仅仅是-OH对苯环的吸电子的
-I效应而使间-羟基苯甲酸的酸性大于苯甲酸。
在对-羟基苯甲酸中由于-OH与-COOH的相对位置较远,吸电子的-I效应与间-羟基苯甲酸比较相对较弱,但是更重要的是这时羟基氧上的孤电子对与苯环产生P-π共轭的+C效应能直接传递到对位上-COOH而使对-羟基苯甲酸的酸性减弱。
想比之下,供电子的+C效应大于吸电子的-I效应。
所以总的结果是是对-羟基苯甲酸的酸性小于苯甲酸。
在邻-羟基苯甲酸中由于-OH与-COOH的相对位置最近,吸电子的-I效应也最大,其作用是使酸性增强。
但这时处于邻位上的-OH鱼苯环P-π共轭的+C效应也能直接传递到-COOH上,其左右是使酸性减弱。
单从这两个因素来看,由于邻-羟基苯甲酸中-OH与-COOH的相对位置较近,酸性应该比对-羟基苯甲酸稍强。
然而更重要的是出于邻位上的-OH能与理解出氢原子后的羧基根负离子刑场氢键而使其更稳定。
所以,实施上邻-羟基苯甲酸的酸性比对-羟基苯甲酸强得多,羟基苯甲酸的三个位置异构体中邻-羟基苯甲酸的酸性最强,这就是氢键的影响占主要因素而大大地增强了邻-羟基苯甲酸的酸性。
由上可见,分子内形成氢键的部位越多,对化学性质的影响也越大,如:
酸性———————————————————————→增大
脱羧反映活性———————————————————→增大[3]
2 内氢键对取代酚酸性的影响
苯酚分子中苯环上的一个氢原子被硝基取代后有邻、间、对三种位置异构体。
硝基连接到苯环上既可以吸电子的诱导效应(-I),有可以产生吸电子的P-π共轭效应(-C)。
pKa[4]:9.9 7.2 8.35 7.14
由于硝基的-I效应和-C效应都是吸电子效应,所以硝基苯酚的三个位置异构体的酸性都比苯酚强,这与事实是相符合的。
由于间-硝基苯酚中硝基处于-OH的键位,硝基与苯环的P-π共轭的-C效应对间位上的-OH影响不大,而邻-硝基苯酚和对-硝基苯酚中均同时存在的-I效应和-C效应的共同影响,所以间-硝基苯酚的酸性大于苯酚而小于邻-硝基苯酚和对-硝基苯酚。
这时-I效应和-C效应综合影响的结果。
由于共轭效应不随距离的远近而产生强弱变化,所以在邻-硝基苯酚和对-硝基苯酚中若只考虑-I效应的影响,应该是硝基距-OH越近-I效应就越强,酸性也就越强。
那么邻-硝基苯酚的酸性应该大于对-硝基苯酚。
但由于邻-硝基苯酚中硝基处于-OH邻位,恰好可以与-OH形成氢键而使氢的理解受到阻碍,所以邻-硝基本俸的酸性反而比对-硝基苯酚的酸性弱、
这也是氢键的影响占主要因素而使邻-硝基苯酚的酸性反而比对-硝基苯酚的酸性弱。
3 内氢键对顺反丁烯二酸酸性的影响
pKa1[5]: 1.92 3.02
pKa2: 6.23 4.83
顺-丁烯二酸的pKa1比反-丁烯二酸的pKa1小,即酸性较强,是由于两个羧基相对距离较近,第一个羧基理解出氢离子后形成的羧基负离子恰好可以和另一个羧基更好地形成氢键,使羧基负离子上的负电荷得到分散而更加稳定。
也正是由于形成了这种氢键,才是顺-丁烯二酸的第二个羧基的氢原子难于离解,所以顺-丁烯二酸的pKa2大于反-丁烯二酸的pKa2。
4 总结
综上所述:分子内离解产生氢键对有机化合物酸性强所的影响是不一致的,有时可使酸性增强,有时又可使酸性减弱。
一般情况是离解出氢离子后更有利于形成氢键时,这时的氢键能使有机化合物的酸性增强;未离解出氢离子前就优先形成氢键时,这时的氢键则不利于氢的理解而使有机化合物的酸性减弱[6]。
参考文献:
[1]吴永平等,遵义师范学院报[J],2004,6(4)87-88
[2]曾召琼,有机化学(第三册,下册)[M].北京:高等教育出版社,1993.360.
[3]万新,大学化学[J]1994,10第九卷第五期
[4]沈宏康,有机酸碱[M].北京:高等教育出版社,1983.82.
[5]沈宏康,有机酸碱[M].北京:高等教育出版社,1983.85-86.
[6]曾昭琼,有机化学参考资料[M]北京:高等教育出版社,1989.168~170。