第二章 化学反应热
- 格式:doc
- 大小:133.50 KB
- 文档页数:7

第二章化学反应与能量第1节化学能与热能第1课时【教学目标】⑴知道化学反应的本质是什么?⑵能分析化学反应中能量变化的主要原因⑶掌握从化学键的观点来分析能量的变化(4) 了解能量守恒定律【教学重点】掌握从化学键的观点来分析能量的变化。
【教学难点】运用能量守恒定律公式的简单计算。
【教学过程】[介绍] 能源与材料、信息一起被称为现代社会发展的三大支柱。
能源是人类赖以生存和发展的物质基础,我们每时每刻、分分秒秒都离不开它。
迄今为止,人类所能利用的能源主要是化学能、电能、以及核能等等。
但是,由于人类大量开发和浪费资源,造成了资源的不合理利用从而引发了不可回避的能源危机。
在现代广泛使用的各种能源中,哪些与化学密切相关?面对能源枯竭的危机,提高能源的利用率和开辟新能源是解决这一问题的两个主要方向,在这方面化学能作出什么贡献?本章初步讨论这些问题。
[创设情景] 在一支试管中放入一小块生石灰,加入少量水,让学生观察实验现象,再让学生用手触摸试管外壁,然后要求学生回答观察到了什么现象?触摸试管外壁时有何感觉?说明什么问题?并要求学生写出反应方程式。
[问题] 煤、石油、天然气的主要化学成分是烃类等有机物(煤中含有大量的碳),它们燃烧时放出热能。
你一定想知道,这种能量从何而来?它与化学物质和化学反应有什么关系?石灰石(主要成分是碳酸钙)要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起到什么作用?[板书] 一、化学键与化学反应中能量变化的关系[思考]不同的燃料其组成不同,燃烧后放出的热量也不相等。
为什么不同的燃料燃烧时放出的热量会不同?燃料在燃烧反应中产生的热能来自哪里?1、化学键与化学反应中能量变化的关系⑴化学反应的本质是什么?以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
点燃H2 + Cl2 ==== 2HCl一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
⑵化学反应中能量变化的主要原因点燃H2 + Cl2 ==== 2HCl吸收能量吸收能量放出能量化学键的断裂和形成是化学反应中能量变化的主要原因。




高一化学必修一第二章知识点总结第二章化学反应的热力学一、热力学基础1、热力学定律热力学是研究动力学和热力过程的一门学科,総称为热力学(thermodynamics),定律是热力学最重要的理论基础,可以概括为:第一定律:能量守恒定律,即能量守恒,能量不会凭空消失,也不会凭空而产生,只能从一种形式转换到另一种形式,总量都是不变的。
第二定律:熵守恒定律,即熵守恒,工作、温度及其它能量的变化只能趋于热量流失的方向,熵值随时间的变化只会增大,不会减小。
二、热化学新计量1、热化学热热化学热定义为随着化学反应发生而产生的热量,或者说,当某一反应进行一次能量变化时,会产生固定数量的热量。
这种能量是反应发生时由吸收或放出的能量的总和,它是反应的量的,不受温度变化的影响。
2、热化学分析热化学分析是利用其来测定反应物和生成物的量,以及酸-碱反应,还原离子反应和加成反应的热量放出量,以此确定反应是否满足II定律。
热化学分析只能在室温下进行,必须先准备偏常气体,即使用实验室仪器将反应物保持在正常状态下。
三、熵变和焓变1、熵变熵变是指物质系统遵熵守恒定律发生的物理量变化所导致的物理热效应,它是指室温下反应发生时,总熵的变化量。
反应发生时,总熵会减小,反应结束时,总熵则会增加。
2、焓变焓变是由热化学热产生的热力学热量,它也可以表示物质系统在改变温度时所能吸收或释放的热量。
焓变是由热化学热产生的热力学热量,它可以表示物质系统在改变温度时所能吸收或释放的热量,它可以用热化学热试剂测定出来,也可以用热力学的方法来测定。
焓的正负也决定了反应体系的热稳定性,负焓变表示反应体系具有热稳定性,正焓变表示反应体系具有热不稳定性。
四、电离平衡电离平衡是气体介质中混合能量的变化,也是电离温度(Ionization Temperature)的概念,它是指气体介质中混合电荷的各种形式的混合能量的动态平衡,温度的变化也会影响电离平衡的状态。
电离平衡的偏移会影响气体分子间的能量交换,从而发生化学反应。

《化学反应的热效应》讲义一、什么是化学反应的热效应在我们日常生活和化学研究中,经常会遇到各种化学反应。
而当这些化学反应发生时,往往伴随着能量的变化,这种能量变化在热力学中就被称为化学反应的热效应。
简单来说,化学反应的热效应就是指在化学反应过程中,由于反应物和生成物的能量不同,从而导致的体系与环境之间的能量交换。
这种能量交换通常以热的形式表现出来。
比如,当煤炭燃烧时,会释放出大量的热能,这就是一个明显的化学反应产生热效应的例子。
再比如,电池的放电过程,也是化学反应产生电能的过程,同时也伴随着热的产生。
为了更好地理解化学反应的热效应,我们需要先了解一些基本的概念。
二、相关基本概念1、体系与环境体系是我们研究的对象,而环境则是体系之外与体系有相互作用的部分。
根据体系与环境之间的物质和能量交换情况,体系可以分为敞开体系、封闭体系和孤立体系。
敞开体系:既可以有物质交换,又可以有能量交换。
封闭体系:只有能量交换,没有物质交换。
孤立体系:既没有物质交换,也没有能量交换。
在研究化学反应的热效应时,我们通常将反应体系看作是封闭体系。
2、内能内能是体系内部所有能量的总和,包括分子的动能、分子间的势能、化学键的能量等等。
内能是一个状态函数,只与体系的状态有关,而与变化的途径无关。
3、热力学第一定律热力学第一定律也称为能量守恒定律,其表达式为:ΔU = Q + W 。
其中,ΔU 表示体系内能的变化,Q 表示体系从环境吸收的热量,W 表示体系对环境所做的功。
当体系从环境吸收热量时,Q 为正值;当体系向环境放出热量时,Q 为负值。
当体系对环境做功时,W 为负值;当环境对体系做功时,W 为正值。
三、化学反应热效应的分类化学反应的热效应主要分为以下两种:1、恒容反应热在恒容条件下,体系的体积不变,此时反应的热效应称为恒容反应热(Qv)。
由于ΔV = 0 ,所以 W = 0 ,根据热力学第一定律,ΔU= Qv 。
这意味着恒容反应热等于体系内能的变化。

第二章化学反应热效应教材:《普通化学》(第五版)浙江大学普通化学教研组编王明华徐端钧周永秋张殊佳修订高等教育出版社,北京出版年:2002年7月绪论化学是一门既古老又年轻的科学。
化学是研究和创造物质的科学,同工农业生产和国防现代化,同人民生活和人类社会等都有非常密切的关系。
化学是一门中心性的、实用的和创造性的科学,主要是研究物质的分子转变规律的科学。
化学与物理一起属于自然科学的基础学科。
研究现状(2000年)化合物>2000万种时间分辨率:1f空间分辨率:0.1nm分析所需最小量:10-13ug。
2化学的定义与分支学科定义:化学是在原子和分子水平上研究物质的组成、结构和性质及其变化规律和变化过程中能量关系的科学化学的分支学科无机化学:无机物有机化学:碳氢化合物及衍生物分析化学:测量和表征物理化学:所有物质系统高分子化学:高分子化合物若干新分支:环境化学、核化学等等3COOHOCCH3O2-(乙酰氧基)苯甲酸。
分子式:C9H8O4阿司匹林ApirinTablet分子量:180.16H2NNNNNH2NH2三聚氰胺(Melamine)三嗪类含氮杂环有机化合物,重要的氮杂环有机化工原料。
简称三胺,又叫2,4,6-三氨基-1,3,5-三嗪、蜜胺、氰尿酰胺、三聚氰酰胺,分子式C3N6H6、C3N3(NH2)3,分子量126.125化学的地位和作用化学仍是解决食物短缺问题的主要学科之一化学继续推动材料科学发展化学是提高人类生存质量和生存安全的有效保障化学在能源和资源的合理开发和高效安全利用中起关键作用化学是生命科学的重要支柱6学习的目的、内容和要求学习目的了解当代化学学科的概貌用化学的观点分析、认识生活和工作中的化学问题学习内容理论化学:两条“主线”应用化学:化合物知识;化学在相关学科中的应用实验化学学习要求辨证的思维发展的眼光实践的方法7第1章学习要求:热化学与能源了解定容热效应(qv)的测量原理。
熟悉qv的实验计算方法。


第二章 化学反应与能量变化 班级 姓名 第一节 化学能与热能1、化学反应的本质:旧化学键的断裂,新化学键的生成过程。
化学键的断裂需要吸收能量,化学键的形成会释放能量。
任何化学反应都会伴随着能量的变化。
①放出能量的反应:反应物的总能量 > 生成物的总能量②吸收能量的反应:反应物的总能量 < 生成物的总能量2、能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量形式可以不同,但是体系包含的总能量不变。
化学反应中的能量变化通常表现为热量的变化,即吸热或者放热。
3、常见的放热反应:①所有的燃烧反应;②酸碱中和反应;③活泼金属与酸(或水)的反应;④绝大多数的化合反应;⑤自然氧化(如食物腐败)。
常见的的吸热反应:①铵盐和碱的反应;②绝大多数的分解反应。
第二节 化学能与电能1、一次能源:直接从自然界取得的能源。
如流水、风力、原煤、石油、天然气、天然铀矿。
二次能源:一次能源经过加工,转换得到的能源。
如电力、蒸汽等。
2、原电池:将化学能转化为电能的装置。
右图是铜锌原电池的装置图。
①锌片(负极反应):22Zn e Zn -+-=,发生氧化反应;铜片(正极反应):222H e H +-+=↑,发生还原反应。
总反应:Zn+2H +=Zn 2++H 2↑②该装置中,电子由锌片出发,通过导线到铜片,电流由铜片出发,经过导线到锌片。
③该装置中的能量变化:化学能转化为电能。
④由活泼性不同的两种金属组成的原电池中,一般比较活泼的金属作原电池的负极(发生氧化反应),相对较不活泼的金属作原电池的正极(发生还原反应,正极电极本身不反应!)。
⑤构成原电池的四个条件:1、自发的氧化还原反应;2、活泼性不同的两个电极(导体);3、有电解质溶液;4、形成闭合回路。
第三节 化学反应速率和限度1、化学反应速率:通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
浓度常以mol/L 为单位,时间常以min 或s 为单位。

第二章 化学热力学基础本章总目标:1:掌握四个重要的热力学函数及相关的计算。
2:会用盖斯定律进行计算。
3:理解化学反应等温式的含义,初步学会用吉布斯自由能变化去判断化学反应的方向。
各小节目标:第一节:热力学第一定律了解与化学热力学有关的十个基本概念(敞开体系、封闭体系、孤立体系、环境、状态、状态函数、过程、途径、体积功、热力学能),掌握热力学第一定律的内容(△U=Q-W )和计算。
第二节:热化学1:掌握化学反应热的相关概念:○1反应热——指恒压或恒容而且体系只做体积功不做其它功的条件下,当一个化学反应发生后,若使产物的温度回到反应物的起始温度,这时体系放出或吸收的热量称为反应热。
()。
○2标准生成热——某温度下,由处于标准状态的各元素的指定单质生成标准状态的1mol 某纯物质的热效应。
符号f m H θ∆,单位:1J mol -•或1kJ mol -•)。
○3燃烧热——在100kPa 的压强下1mol 物质完全燃烧时的热效应。
符号:c m H θ∆;单位:1kJ mol -•。
2:掌握恒容反应热△U=Q v -W;恒压反应热Q p =△H恒容反应热和恒压反应热的关系:p V Q Q nRT =+∆3:掌握盖斯定律内容及应用○1内容:一个化学反应若能分解成几步来完成,总反应的热效应等于各步反应的热效应之和。
○2学会书写热化学方程式并从键能估算反应热。
第三节:化学反应的方向1:了解化学热力学中的四个状态函数——热力学能、焓、熵、吉布斯自由能。
2:重点掌握吉——赫公式r m r m r m G H T S θθθ∆=∆-∆的意义及计算。
3;建立混乱度、标准摩尔反应焓、标准摩尔反应自由能和标准熵以及标准摩尔反应熵的概念,并学会对化学反应的方向和限度做初步的讨论会运用吉布斯自由能判断反应的自发性。
Ⅱ 习题一 选择题1.如果反应的H 为正值,要它成为自发过程必须满足的条件是( ) A.S 为正值,高温 B.S 为正值,低温 C.S 为负值,高温 D.S 为负值,低温2.已知某反应为升温时rG 0值减小,则下列情况与其相符的是( ) A.rS 0<0 B.rS 0>0 C.rH 0>0 D.rH 0<03.该死定律认为化学反应的热效应与途径无关。
作业16——17页7,11 (2)第一章化学反应热1.1 几个基本概念1.1.1 系统(体系)和环境(外界)为了明确研究对象,人为地将一部分物质与其余物质分开,被划定的研究对象称为系统;系统之外,与系统密切相关,影响所能及的部分称为环境。
在烧杯中加入稀H2SO4和几粒Zn粒(图),如把H2S04+Zn粒当成研究对象,则H2SO4+Zn 粒就是体系,而烧杯等就是环境;如把烧杯和H2SO4+Zn粒当成体系,则周围的空气就是环境等。
按照系统和环境之间物质和能量的交换情况,通常可将系统分为以下三类:1.敞开系统(图)系统和环境之间既有能量交换,又有物质交换,则该体系就是敞开体系。
2.封闭系统(图)系统与环境之间没有物质交换,但可以有能量交换。
如将上述烧杯放入一个不绝热的密闭容器内,则是封闭体系。
3. 孤立系统(图)系统和环境之间没有任何物质和能量的交换。
就象上例,如将盛H2SO4+Zn粒的烧杯装如一绝热的密闭容器内,则烧杯、H2SO4+Zn粒、和绝热容器所组成的体系就是孤立体系。
若将化学反应(包括作用物和产物)作为研究对象,应该属于什么系统?那就属于封闭体系了。
注意!在研究化学反应时,不加特殊说明,都是按封闭体系处理。
1.1.2 状态与状态函数系统的状态就是系统宏观性质(例如压力、温度、体积、能量、密度、组成等)的综合表现。
或者说系统的宏观性质的总合确定了系统的状态。
由于系统的宏观性质是状态的单值函数,亦称状态函数。
即用来描述系统宏观状态的物理量称为状态函数。
状态函数的变化值只决定于系统的始态和终态,与变化的途径无关。
如一杯水的始态是20℃、100kPa、50克,其终态是60℃、100kPa、50克。
不管采取什么途径,其温度的改变量ΔT都是40℃。
1.2 热力学第一定律在任何过程中(当然也包括化学反应)能量不会自生自灭,只能从一种形式转化为另一种形式,在转化过程中能量的总值不变,这就是能量守恒定律。
将能量守恒定律应用于热力学就是热力学第一定律。
在化学热力学中,研究的是宏观静止系统,不考虑系统整体运动的动能和系统在外力场(如电磁场、离心力场等)中的位能,只着眼于系统的热力学能(内能)。
热力学能是指系统内分子的平动能、转动能、振动能、分子间势能、原子间键能、电子运动能、核内基本粒子间核能等能量的总和。
1.2.1 热力学第一定律的内容假设系统由始态(热力学能为U1)变为终态(热力学能为U2),若在此过程中,系统从环境吸热为q,环境对系统作功为W,则系统热力学能变化是ΔU = U2-U1= q + W (1.1)式(1.1)就是热力学第一定律的数学表达式。
它表明变化过程中系统内能的增量等于系统所吸收的热加上系环境对系统所作的功。
这也是能量守恒定律。
热力学能是状态函数,与温度、压强等状态函数一样,系统的热力学能增量ΔU只与始末状态有关,与所经历的过程无关。
1.2.2 功和热是系统和环境间能量的交换形式,它们都不是状态函数,其数值与途径有关。
热力学中规定,系统吸热q为正值;系统放热q为负值。
系统对环境作功时,W取负值;环境对系统作功时,W取正值(某些书上是将系统对环境作功为正,环境对系统作功为负,这时第一定律的数学表达式为ΔU = q-W)。
热力学中将功分为体积功(膨胀功)和非体积功(有用功),即W=W体+W有。
热力学中把除体积功以外的功统称为有用功(或称非体积功),以W有表示,如电功、表面功等。
化学反应如要做有用功,则需要特别的按排或者需要一定的装置。
热力学系统体积变化时对环境(外界)所作的功称为体积功。
体积功对于化学过程有特殊意义,因为许多化学反应是在敞口容器中进行的。
如果外压p不变,这时的体积功为W体=-PΔV。
1.3 化学反应的反应热[课上演示实验]:安全火柴为什么为什么不安全?所谓安全火柴是相对第二代不安全火柴而言的。
第二代火柴是1816年由法国人德鲁逊发明的。
这种火柴头上涂有硫磺,再覆以白磷,铅丹(Pb3O4)或二氧化锰(MnO2)及树胶的混合物。
白磷受热后容易熔化,在40℃就会起火燃烧。
白磷是巨毒的物质,人误服0.1~0.2克就会死亡。
用白磷制成的火柴,在较粗糙的物体上一擦就着。
虽然很方便,但容易引起火灾,很不安全。
所以这种火柴问世不久就被世界各国普遍禁止制造。
红磷要到260℃才开始燃烧,也不象白磷那样有巨毒。
但红磷单靠摩擦是不能起火的。
可是当它与氯酸钾混合后,比白磷更容易起火,发生燃烧或爆炸。
1855年,伦塔斯脱姆运用其独特的思维方法,想出了一个巧妙而简单的方法,解决了上述难题。
他把引火剂分成两部分,用可燃物氯酸钾、二氧化锰等及树胶调成浆糊沾在浸过石蜡的小木棒上制成火柴头;把红磷、细沙做成胶粘涂在火柴盒的侧面做成火柴皮。
火柴头只有在火柴盒的侧面上摩擦时才会点着。
这种火柴既没有毒,又不易引起火灾,因此被称为“安全火柴”。
KClO3+H2SO4(浓)=KHSO4+HClO3,HClO3不稳定又分解成O2和Cl2等。
同时上述反应又放出大量的热,所以火柴自然。
化学反应热是指有用功为0,等温过程的反应热,通常还要有等容或等压的条件。
因此有等容反应热和等压反应热两种。
1.3.1 等容反应热在恒容、不作有用功的条件下,热力学第一定律中W体+W有=0。
所以ΔU =q v(1.2)式中q v就是等容反应热,左下脚标字母v表示等容过程。
式(1.2)表明,等容反应热全部用于改变系统的内能。
q v只与始态和终态有关,而与途径无关。
1.3.2 等压反应热在等压,不作有用功的条件下,热力学第一定律中W体=-PΔV=-p(V2-V1),故ΔU=U2-U1=q p- p(V2-V1)q p=(U2+PV2)-(U1+PV1)如令H ≡U+Pv (1.3)q p=H2-H1=ΔH(1.4)式中q p就是等压反应热。
H就是物理学中提到的焓,式(1.3)是焓的定义式。
H是状态函数U、p、V的组合,所以焓H 也是状态函数。
式(1.4)中ΔH 是焓的改变量,称为焓变。
由(1.4)式还可以看出,等压反应热也与途径无关,在数值上等于焓变。
因为我们遇到的化学反应,大部分是在100kPa 下,在敞口容器中进行的,而且许多反应都伴有明显的体积变化。
所以,我们遇到的反应大部分是在等压下进行的,其反应热是等压反应热,刚好和焓变数值相同。
故通过焓变值ΔH 就可以知道恒压反应热的大小了。
因此就用ΔH 表示等压反应热。
今后我们提到化学反应热,不加特殊说明都指等压反应热。
例1.1 在等温T 、压力p 及非体积功W 有=0的条件下,要实验测得反应C+1/2O 2=CO的反应热是很困难的。
因为无法保证只生成CO ,而没有CO 2生成。
但我们可以设计如下反应,如下图所式 :因为ΔH 与途径无关,故有:Δr H m ,1=Δr H m ,2+Δr H m ,3式中的下脚标r 表示是化学反应的热效应,m 表示是1mol 反应(1mol 反应先可以简单理解为按所给的反应方程式进行的反应)。
在100kPa 和298K 下,已经测得反应(1)和反应(3)的等压反应热(这应是可以做到的)分别是(1) C (s )+O 2(g )→CO 2(g )Δr H m ,1=-393.5kJ ·mol -1(3) CO (g )+21O 2(g )→CO 2(g ) Δr H m ,3=-283.0kJ ·mol -1 反应(2) C (s )+21O 2(g )→CO (g )的Δr H m ,2=Δr H m ,1-Δr H m ,3=-393.5kJ ·mol -1-(-283.0kJ ·mol -1)=-110.5 kJ ·mol -1。
盖斯定律是19世纪中叶俄国科学家盖斯综合分析大量实验数据总结出来的,所以叫盖斯定律,又叫反应热加和定律。
利用盖斯定律可由分步反应的Δr H m ,i ,求总反应的Δr H m ;当然也可以从已知的n-1反应(n 是总反应和所有分步反应数的总和),求另一个未知反应的Δr H m 。
例1.2试求以下反应(1)CO (g )+ H 2O (g )= CO 2(g )+ H 2(g ) 在298K ,100Kpa 条件下的反应热是多少(该反应是工业制氢的重要反应)?已知下列反应在298K ,100KPa 时的Δr H θm 为(2)C (石墨)+21O 2(g ) = CO (g ) Δr H θm = -110.5 kJ ·mol -1 (3)H 2(g )+ 21O 2(g )= H 2O (g ) Δr H θm = -242kJ ·mol -1 (4)C (石墨)+ O 2(g )= CO 2(g ) Δr H θm = -393.5kJ ·mol -1解:从分析四个反应可知,(3)-(1)+(2)=(4)代入有关数据,可得反应(4)的Δr H m = -41 kJ ·mol -1。
3 m r H ∆ 2.m r H ∆1.m r H ∆1.3.3 热力学标准态所谓标准状态是指在温度T 和标准压力ΘP (100kPa )下该物质的状态,简称标准态。
纯理想气体的标准态是指该气体处于标准压力ΘP (100kPa )下的状态。
而混合理想气体中任一组分的标准态是指该气体组分的分压力为 Θ时P 的状态。
纯液体(或纯固体)物质的标准态是指压力ΘP 下的纯液体(纯固体)的状态。
关于溶液中溶质的标准态的选择问题,较为复杂,这里选其浓度1mol •L -1为标准态。
应注意的是,标准态只规定了标准压力ΘP (100kPa ),而没有限定温度。
但通常我们从手册或专著查到的有关热力学数据一般都是298.15K 时的数据(我们书后的数据也是如此)。
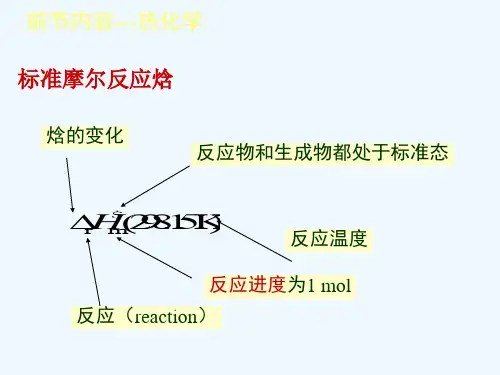
在标准态时,化学反应热(严格讲应是恒压反应热)用Δr H Θm 表示。
下标“r ”表示反应,“ θ”表示标准态,“m ”表示进行1mol 反应。
1.3.4 单质和化合物的标准(摩尔)生成焓所谓标准摩尔生成焓,就是在一定温度、标态下,由最稳定单质生成单位物质的量的纯物质时反应的焓变称为该物质的标准(摩尔)生成焓,以符号Δf H m Θ表示。
常用单位是kJ ·mol -1。
由定义可知,最稳定单质的标准生成晗为0。
在标准条件下石墨和金刚石,石墨是最稳定单质。
当石墨转化为1mol 金刚石时需要吸收1.91kJ 的热量,即C (石墨)→C (金刚石) Δf H m Θ(金刚石)=1.91kJ ·mol -1如果是氯化氢(HCl )和硫酸钠(Na 2SO 4)这类电解质,它们在水中将解离成正、负离子,而各种正、负离子在水溶液中都有不同程度的水合,形成水合离子。
显然,这些水合离子总是正、负离子同时存在。