实验7 硝酸钾在水中的溶解 初中化学实验报告
- 格式:doc
- 大小:28.50 KB
- 文档页数:1

§19 测定硝酸钾在水里的溶解度并绘制它的溶解度曲线图请你先说通过课本学习,谈谈你对溶解度的认识。
不同的物质在相同的温度下,它们的溶解度基本上是不同的;相同的物质在不同的温度下,它们的溶解度也是不同。
硝酸钾在不同的温度下,溶解度是不同的,随着温度的升高,硝酸钾的溶解度增大;相反,随着温度的降低,硝酸钾的溶解度也减小。
我们可以用实验的方法,测出硝酸钾在各种温度时在水里的溶解度。
之后,以纵坐标表示溶解度,横坐标表示温度,根据硝酸钾在不同温度时的溶解度,画出硝酸钾的溶解度曲线图。
实验探究接下来,我们就通过实验来测定硝酸钾的溶解度,以加深我们对溶解度概念的理解;并且能够学会溶解度曲线图的绘制方法。
仪器:(根据需要自选)____________________________________。
药品:硝酸钾、蒸馏水动手做实验:1.在托盘天平上分别称量硝酸钾2.5克、3.5克、5.0克、7.0克、9.0克,然后依次放入已经编好号的干燥的试管里。
注意不要把硝酸钾粘在试管壁上。
2.用量筒量取10mL蒸馏水。
在5个试管里分别加入10mL蒸馏水。
3.在每个试管里插入一根玻璃棒,然后依次把每个试管放在水浴里进行加热,边加热边搅拌,使硝酸钾固体全部溶解。
在加热过程中,要用温度计测水温。
注意不要使温度上升过高,以致下一步结晶析出需要的时间太长。
(可以进行粗略计算。
例如,20℃时硝酸钾溶解度为31.6克,那么20℃时,在10mL水里最多能溶解3.16克硝酸钾。
2号试管中有3.5克硝酸钾,大约在略高于20℃时能全部溶解,因此加热温度不要高于30℃,以此类推。
)4.当硝酸钾全部溶解后,可把试管拿出水面,插入一根干净的温度计,一边用玻璃棒轻轻地摩插管壁,一边观察温度计的读数。
这时,一定要耐心、细心,当有晶体析出时,立即读取温度,并作记录。
5.把试管再放入水浴里加热,使硝酸钾溶解。
然后重复上面的操作,再测定晶体析出时的温度。
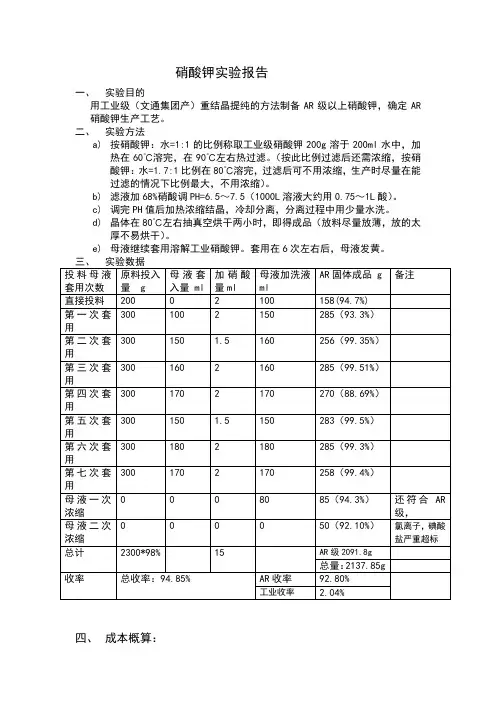
硝酸钾实验报告一、实验目的用工业级(文通集团产)重结晶提纯的方法制备AR级以上硝酸钾,确定AR 硝酸钾生产工艺。
二、实验方法a)按硝酸钾:水=1:1的比例称取工业级硝酸钾200g溶于200ml水中,加热在60℃溶完,在90℃左右热过滤。
(按此比例过滤后还需浓缩,按硝酸钾:水=1.7:1比例在80℃溶完,过滤后可不用浓缩,生产时尽量在能过滤的情况下比例最大,不用浓缩)。
b)滤液加68%硝酸调PH=6.5~7.5(1000L溶液大约用0.75~1L酸)。
c)调完PH值后加热浓缩结晶,冷却分离,分离过程中用少量水洗。
d)晶体在80℃左右抽真空烘干两小时,即得成品(放料尽量放薄,放的太厚不易烘干)。
e)母液继续套用溶解工业硝酸钾。
套用在6次左右后,母液发黄。
四、成本概算:通过试验可知,生产1吨AR硝酸钾需1.078吨工业级硝酸钾,AR硝酸1公斤,纯水(按硝酸钾:纯水=2:1算)需0.539公斤。
则生产1吨硝酸钾成本如下:工业硝酸钾:7500×1.078=8085元(文通带税价格)。
纯水:0.539×200=107.8元硝酸1公斤×1.6=1.6元蒸汽:200元水电费:500元人工:180元(两人)生产成本总计:9074.4元市场硝酸钾西陇1.4万元/吨,其他厂家最高1.6万元/吨最低1.1万元/吨,按1.2万元/吨计算利润如下:12000-9074.4+7500×0.022=3090.6元。
五、试验总结1.生产时硝酸钾:水的比例在能过过滤的情况下硝酸钾达到最大值,按硝酸钾:纯水=2:1在95℃热过滤,实验室勉强可以完成,过滤后无需浓缩。
车间按实际情况而定。
2.成品必须单独储存,必须放于通风干燥阴凉处,温度不超过30度。
3.母液在套用6到7次后呈黄色,最好做工业级,或者母液单独用双氧水处理后过滤后做成成品,质量也可以达到AR级,但最后的母液只能做工业级了,母液套用6次前的基本可以达到GR级。

---实验报告一、实验名称由海盐制备试剂级氯化钠二、实验目的1. 学习由海盐制备试剂级氯化钠的方法。
2. 掌握溶解、过滤、蒸发、结晶和气体等基本操作。
3. 了解试剂级氯化钠的制备过程及质量控制。
三、实验原理海盐中的主要成分是氯化钠,通过溶解、过滤、蒸发、结晶等步骤,可以去除杂质,得到纯净的试剂级氯化钠。
四、实验仪器与试剂仪器:1. 烧杯2. 玻璃棒3. 过滤器4. 蒸发皿5. 天平6. 酒精灯7. 研钵8. 研杵试剂:1. 海盐3. 碳酸钠4. 氢氧化钠5. 盐酸6. 硫酸钠五、实验步骤1. 称取一定量的海盐,加入适量的纯水,搅拌溶解。
2. 将溶液过滤,去除不溶性杂质。
3. 将滤液倒入蒸发皿中,加热蒸发,直至溶液浓缩。
4. 待溶液浓缩至一定程度时,停止加热,自然冷却。
5. 将结晶的试剂级氯化钠收集起来,晾干。
六、实验结果与分析1. 通过实验,成功制备了试剂级氯化钠。
2. 在制备过程中,发现过滤和蒸发是关键步骤,需要严格控制操作条件。
3. 制备的试剂级氯化钠纯度较高,符合实验要求。
七、实验总结1. 通过本次实验,掌握了由海盐制备试剂级氯化钠的方法。
2. 熟练掌握了溶解、过滤、蒸发、结晶等基本操作。
3. 认识到试剂级氯化钠的制备过程及质量控制的重要性。
八、注意事项1. 在溶解海盐时,要控制好温度,避免过热。
2. 过滤时要选择合适的滤纸,确保过滤效果。
3. 蒸发过程中要控制好温度,避免溶液过快蒸发。
---以上是一份实验报告的模板,您可以根据自己的实验情况进行修改和补充。
在撰写实验报告时,请注意以下几点:1. 实验报告要简洁明了,条理清晰。
2. 实验步骤要详细,便于他人复现实验。
3. 实验结果与分析要准确,结合实验数据进行分析。
4. 注意事项要提醒他人,避免实验中出现意外情况。
第2篇一、实验目的1. 了解不同试剂在水中的溶解特性。
2. 掌握实验操作步骤,提高实验技能。
3. 分析影响试剂溶解度的因素。
二、实验原理溶解度是指在一定温度下,某物质在一定量的溶剂中达到饱和状态时所能溶解的最大量。

硝酸钾实验报告实验目的本实验旨在通过合成硝酸钾的过程熟悉化学实验操作技巧,掌握如何进行溶液的稀释和浓缩,以及学习到硝酸盐的合成反应。
实验原理硝酸钾(化学式:KNO3,英文名:Potassium nitrate)是一种重要的无机化合物,也是实验室中经常使用的试剂之一。
硝酸钾是由钾离子和硝酸根离子组成的盐类化合物,在化学实验中常用于制备其他无机化合物或者用作火药、肥料等。
硝酸钾的合成反应如下:KOH + HNO3 → KNO3 + H2O实验步骤1.将一定量的氢氧化钾(KOH)溶解于适量的蒸馏水中,搅拌均匀,待其完全溶解。
2.另外取一定量的硝酸(HNO3),逐滴加入含有氢氧化钾溶液中,并同时加热,保持沸腾。
加入硝酸的速度应缓慢,避免溶液剧烈泛沸。
3.完全加入硝酸后,继续加热溶液,使其持续沸腾一段时间,以充分反应。
4.关闭加热设备,将溶液放置冷却至室温,待其逐渐结晶。
5.将结晶的硝酸钾用玻璃棒或者滤纸过滤出来,并用少量蒸馏水洗涤,以去除杂质。
6.将过滤后的硝酸钾晾干至完全干燥。
实验记录在本实验中,我们使用了指定比例的氢氧化钾和硝酸来合成硝酸钾。
具体操作步骤如下:1.准备了所需的实验器材,包括烧杯、滴管、加热设备等。
2.称取了适量的氢氧化钾固体,约为X克。
3.将氢氧化钾固体溶解于Y mL的蒸馏水中,搅拌均匀。
4.取一定量的硝酸,逐滴加入氢氧化钾溶液中,并同时加热设备加热,保持溶液沸腾。
5.随着硝酸的加入,溶液逐渐变浓,出现白色悬浊液。
6.在继续加热的过程中,悬浊液逐渐减少,逐渐转变为无色透明液体。
7.关闭加热设备,将溶液冷却至室温,观察到结晶物逐渐形成。
8.使用玻璃棒将结晶物捞出,并用适量的蒸馏水洗涤,去除杂质。
9.将洗涤后的结晶物晾干至完全干燥,并记录其质量为Z克。
实验结果和讨论通过本实验,我们成功地合成了硝酸钾,并得到了Z克的硝酸钾晶体。
根据实验记录,我们可以计算该次实验得到硝酸钾的产率,即实际合成的硝酸钾质量与理论计算的硝酸钾质量之比。

溶解热的测定一.实验目的1.了解热效应测定的基本原理2.学会使用电热补偿法测定硝酸钾在水中的积分溶解热3.学会用作图法求出硝酸钾在水中的微分溶解热,积分冲淡热和微分冲淡热4.掌握溶解热测定仪的使用二.实验原理溶解热:物质溶解于溶剂过程的热效应,有积分溶解热和微分溶解热两种。
积分溶解热:指定温定压下把 1mol 物质溶解在 nmol 溶剂中时所产生的热效应。
由于在溶解过程中浓度不断改变,因此又称为变浓溶解热,以 Qs 表示。
微分溶解热:指在定温定压下把1mol物质溶解在无限量某一定浓度溶液中所产生的热效应。
在溶解过程中浓度可视为不变,因此又称为定浓溶解热,以表示(定温,定压,定浓状态下,由微小的溶质增量所引起的热量变化)。
冲淡热:又称稀释热。
把溶剂加到溶液中使之稀释,在稀释过程中的热效应称为冲淡热。
它也有积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。
积分冲淡热:在定温定压下把原为含 1mol 溶质和 n01 mol 溶剂的溶液冲淡到含有 n02mol溶剂时的热效应。
它为两浓度的积分溶解热之差。
以 Qd 表示。
微分冲淡热:1mol 溶剂加到某一浓度的无限量溶液中所产生的热效应,以表示(定温,定压,定溶质状态下,由微小溶剂增量所引起的热量变化)。
积分溶解热的大小与浓度有关,而且不具备线性关系。
积分溶解热由实验测定,在测定时可画出一条积分溶解热 Qs 与溶剂浓度 n之间的关系曲线。
其它三种热效应由 Qs~n曲线求得。
溶解过程的焓变为:ΔH = H ' - H = n1ΔH1 + n2ΔH2式中的n1ΔH1 为溶剂在指定浓度溶液中溶质与纯溶质摩尔焓的差,即为微分溶解热。
由于积分溶解热为:(偏微分)。
该切线在纵坐标上的截矩,即为该浓度溶液的微分溶解热。
在两个浓度之间积分溶解热的差值,就是积分冲淡热。
硝酸钾在水中溶解过程是个吸热过程,一定量的硝酸钾溶解在水中会使得水的温度下降。
用一个电热丝对溶液进行加热,在温度回到加入硝酸钾前原来温度值时,这段时间所消耗的电能为:Q = I 2 R t = I V t单位为焦。


物理化学实验报告实验名称溶解热的测定一.实验目的及要求1.了解电热补偿法测定热效应的基本原理。
2.通过用电热补偿法测定硝酸钾在水中的积分溶解热;用作图法求硝酸钾在水中的微分冲淡热、积分冲淡热和微分溶解热。
3.掌握电热补偿法的仪器使用要点。
二.实验原理1.物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1mol溶质溶解在nomol溶剂中时所产生的热效应,以Qs表示。
后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应。
即溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1mol溶质和nomol溶剂的溶液稀释到含溶剂nogmol时所产生的热效应,以Q。
表示,显然。
后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应2.积分溶解热由实验直接测定,其它三种热效应则需要通过作图来求:设纯溶剂,纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为Hm,A和Hm,B,若由nA摩尔溶剂和nB摩尔溶质混合形成溶液,则混合前总焓为混合后总焓为此混合(即溶解)过程的焓变为根据定义,△Hm,A即为该浓度溶液的微分稀释热,△Hm,B 即为该浓度溶液的微分溶解热,积分溶解热则为:故在Qs~n0图上,某点切线的斜率即为该浓度溶液的微分溶解热,截距即为该浓度溶液的微分溶解热,如图所示:3.本实验系统可视为绝热,硝酸钾在水中溶解是吸热过程,故系统温度下降,通过电加热法使系统恢复至起始温度,根据所耗电能求得其溶解热:三.实验仪器及药品1.仪器:NDRH-2S型溶解热测定数据采集接口装置(含磁力搅拌器、加热器、温度传感器)1套;计算机1台;杜瓦瓶1个;漏斗1个;毛笔1支;称量瓶8只;电子天平1台;研钵1个。
2.药品:硝酸钾(分析纯)。
四.实验注意事项1.杜瓦瓶必须洗净擦干,硝酸钾必须在研钵中研细。

一、实验目的1. 了解溶解焓的概念及其测定方法;2. 掌握溶解焓测定的原理和操作步骤;3. 通过实验,验证溶解焓的规律性。
二、实验原理溶解焓是指在等温、等压条件下,1mol溶质溶解于溶剂中所产生的热效应。
溶解过程分为两个阶段:溶质从固态转变为溶液,以及溶质分子与溶剂分子之间的相互作用。
这两个阶段的热效应分别为溶解热和溶剂化热。
根据热力学第一定律,溶解焓可以表示为:ΔH = Q + W其中,ΔH为溶解焓,Q为溶解过程中所吸收的热量,W为溶解过程中所做的功。
在实验中,通常使用量热计来测定溶解过程中所吸收的热量。
量热计由内筒和外筒组成,内筒用于溶解溶质,外筒用于与内筒进行热交换。
通过测量内筒和外筒的温度变化,可以计算出溶解焓。
三、实验材料1. 量热计2. 溶质(如硝酸钾)3. 溶剂(如水)4. 温度计5. 烧杯6. 电子天平7. 玻璃棒8. 搅拌器四、实验步骤1. 准备量热计,将内筒和外筒清洗干净,并用蒸馏水冲洗干净;2. 称取一定量的溶质,准确到0.01g;3. 将溶质放入内筒中,用玻璃棒搅拌使其充分溶解;4. 使用电子天平称取一定量的溶剂,加入外筒中;5. 将内筒和外筒放入搅拌器中,开始搅拌;6. 使用温度计测量内筒和外筒的温度,记录起始温度;7. 当内筒和外筒的温度达到平衡时,记录平衡温度;8. 计算溶解焓,公式如下:ΔH = m c ΔT其中,ΔH为溶解焓,m为溶质的质量,c为溶剂的比热容,ΔT为温度变化。
五、实验结果与分析1. 实验数据:| 溶质质量 (g) | 溶剂质量 (g) | 起始温度(℃) | 平衡温度(℃) | 温度变化(℃) | 溶解焓 (J/mol) || :----------: | :----------: | :----------: | :----------: | :----------: | :------------: || 1.00 | 100.0 | 25.0 | 29.5 | 4.5 | -58.3 |2. 结果分析:根据实验数据,计算得出溶解焓为-58.3J/mol。

实验二硝酸钾的溶解与结晶一实验目的熟悉溶解度的测定方法及结晶法的技巧。
二实验原理一﹑溶解度1.溶解度的定义:在定温﹑定压下﹐饱和溶液中所含溶质的量﹐称为该溶质在此温度时的溶解度。
(1)溶解度常用的表示法:○1以每100 克溶剂中所含溶质的克数表示。
(单位:溶質 g溶劑 100 g)○2以每升溶液中所含溶质的莫耳数。
(单位:溶質 mol 溶液 L)○3以重量百分率浓度(%)表示。
(2)饱和溶液﹑不饱和溶液与过饱和溶液的定义:○1饱和溶液:溶剂中所能溶解的溶质已达最大量﹐此时的溶液称为饱和溶液;是一种动平衡。
○2不饱和溶液:溶剂中所能溶解的溶质未达最大量﹐此时的溶液称为不饱和溶液;再加入少许固体溶质时﹐固体溶质继续溶解。
○3过饱和溶液:溶剂中所能溶解的溶质超过最大量﹐此时的溶液称为过饱和溶液;过饱和溶液是一种不稳定状态﹐加入一些微小晶体当作晶种﹐或利用搅拌﹐都可使过量溶质结晶析出而成为饱和溶液。
○4配制法:在较高的温度时﹐配制成饱和溶液﹐而后缓慢或迅速降低温度﹐使过剩的溶质不结晶析出。
(3)溶解度的分类:○1可溶:溶解度大于10-1 M。
○2微溶:溶解度介于10-1~10-4 M。
○3难溶或不溶:溶解度小于10-4 M。
2.溶解的实例:(1)在溶液里进行化学反应通常较快。
在实验室里或化工生产中﹐要使两种能反应的固体起反应﹐先将它们溶解后﹐再混合﹑振荡或搅动﹐以加快反应进行。
(2)溶液对动﹑植物生理活动的影响:○1动物摄取食物里的养分﹐经消化变成溶液后再吸收。
○2动物体内﹐氧和二氧化碳先溶解在血液中﹐再循环进出。
○3医疗用眼药水﹑葡萄糖溶液﹑生理食盐水及注射液……等﹐按一定比例﹐先配成溶液后再使用。
○4许多有机堆肥﹐在施用前先经腐熟;其目的之一是使复杂﹑难溶的有机物﹐变成简单﹑易溶物﹐使其能溶解于水中﹐供农作物吸收。
二﹑结晶1.结晶的定义:结晶是指从饱和溶液或气体中﹐凝聚出具有一定几何形状固体的过程。

,p ,nsT n Q ∂⎛⎫⎪∂⎝⎭实验七:溶解热的测定一、实验目的1、掌握电热补偿法测定热效应的基本原理;2、通过用电热补偿法测定KNO3在水中的积分溶解热,并用作图法求KNO3在水中的微分冲淡热、积分冲淡热和微分溶解热;3、掌握电热补偿法的仪器使用。
二、实验原理1、溶解热 在恒温恒压下,1摩尔溶质溶于n0摩尔溶剂中产生的热效应,溶解热可分为积分(或称变浓)溶解热和微分(或称定浓)溶解热。
积分溶解热 在恒温恒压下,1摩尔溶质溶于n0摩尔溶剂中产生的热效应,用Qs 表示,(浓 度改变)。
微分溶解热 在恒温恒压下,1摩尔溶质溶于某一确定浓度的无限量的溶液 中产生的热效应,以表示。
冲淡热 把溶剂加到溶液中使之稀释所产生的热效应。
冲淡热也可分为积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。
积分稀释热 在恒温恒压下,把原含1摩尔溶质及n01摩尔溶剂的溶液冲淡到含溶剂为n02时的热效应,即为某两浓度溶液的积分溶解热之差,以Qd 表示。
微分稀释热 在恒温恒压下,1摩尔溶剂加入某一确定浓度的无限量的溶液中产生的热效应,以表示。
2.积分溶解热(QS)可由实验直接测定,其它三种热效应由QS —n0曲线求得。
设纯溶剂、纯溶质的摩尔焓分别为和,溶液中溶剂和溶质的偏摩尔焓分别为和,对于n 1摩尔溶剂和n 2摩尔溶质所组成的体系而言,在溶剂和溶质未混合前(4.1)当混合成溶液后(4.2)因此溶解过程的热效应为(4.3)式中△H 1为溶剂在指定浓度溶液中溶质与纯溶质摩尔焓的差。
即为微分溶解热。
根据积分溶 解热的定义:(4.4)所以在Q s ~n 01图上,不同Q s 点的切线斜率为对应于该浓度溶液的微分冲淡热,即0,p ,sT nQ n ⎛⎫∂ ⎪∂⎝⎭,该切线在纵坐标的截距OC,即为相应于该浓度溶液的微分溶解热.而在含有1摩尔溶质的溶液中加入溶剂使溶剂量由n 02摩尔增至n 01摩尔过程的积分冲淡热Q d =(Q s )n 01一(Q s )n 02= BG —EG 。

12级科学教育朱潇1220440110硝酸钾溶解度的测定和溶解度曲线的绘制一、实验目的:1、学习溶解度的粗略测定方法;2、了解硝酸钾溶解度与温度的关系;3、学习绘制溶解度曲线。
二、实验仪器:烧杯(1个500ml,1个250ml,1个100ml),大试管,玻璃棒,温度计(100℃),酒精灯,量筒(10ml),铁架台(带铁圈),石棉网,药匙,试管刷布氏漏斗,吸滤瓶,滤纸,循环真空泵,硝酸钾,蒸馏水,电子天平,蒸发皿。
三、实验原理:(一)溶解度的定义及影响因素:定义:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
发生溶解的物质叫溶质,溶解他物的液体(一般过量)叫溶剂,或称分散剂,生成的混合物叫溶液。
固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。
溶解度是指在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的克数。
特别注意:溶解度的单位是克(或者是克/100克水)而不是没有单位。
影响溶解度的因素:一种物质在某种溶剂中的溶解度主要决定于溶剂和溶质的性质。
溶解度明显受温度的影响,大多数固体物质的溶解度随温度的升高而增大;气体物质的溶解度则与此相反,随温度的升高而降低。
溶解度与温度的依赖关系可以用溶解度曲线来表示。
氯化钠NaCL的溶解度随温度的升高而缓慢增大,硝酸钾KNO3的溶解度随温度的升高而迅速增大,而硫酸钠Na2SO4的溶解度却随温度的升高而减小。
固体和液体的溶解度基本不受压力的影响,而气体在液体中的溶解度与气体的分压成正比。
(二)溶解度曲线的意义1、点溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
即曲线上的任意一点都对应有相应的温度和溶解度。
硝酸钾实验报告导言:硝酸钾是一种常见的化学物质,在实验室中广泛应用于不同领域的研究中。
本实验选取了硝酸钾作为研究对象,主要目的是通过实验了解硝酸钾的性质和特点、观察实验过程中的现象和反应,从而进一步深化对硝酸钾的理解和应用。
实验目的:1. 了解硝酸钾的性质和特点;2. 观察实验过程中的现象和反应;3. 学习合理操作和实验记录的方法。
实验原理和方法:硝酸钾(化学式为KNO3)是一种白色结晶固体,在常温下易溶于水。
本实验中,我们将使用硝酸钾与其他化学物质进行反应,观察并记录实验过程中产生的现象和反应产物。
实验材料和设备:1. 硝酸钾2. 烧杯3. 实验室试剂4. 显微镜5. 酒精灯6. 实验记录表实验步骤:1. 取一定量的硝酸钾溶解于适量的水中,搅拌均匀;2. 将溶液转移到烧杯中,并进行观察;3. 使用显微镜观察溶液中的晶体形态和结构;4. 在适当的条件下,使用酒精灯加热硝酸钾溶液,并记录观察到的现象;5. 根据实验结果进行记录和总结。
实验结果与讨论:在本实验中,经过观察和实验记录,我们得到了以下几个结果。
首先,在与水混合时,硝酸钾能够迅速溶解,形成溶液。
溶液呈现无色透明的状态,说明硝酸钾在水中具有很好的溶解性。
其次,在观察硝酸钾溶液中的晶体时,使用显微镜发现晶体呈现均匀的方形结构。
这可以说明硝酸钾晶体具有比较规则的晶体形态。
在使用酒精灯加热硝酸钾溶液时,观察到了明显的现象。
首先,溶液中的温度升高,伴随着气泡的生成。
接着,在继续加热的过程中,溶液发生了沸腾现象,并产生了白色烟雾。
这是因为硝酸钾被加热分解产生了氧气,与空气中的水蒸气反应形成白色烟雾。
通过以上实验结果可以得出,硝酸钾具有较好的溶解性和不稳定性。
在加热过程中,硝酸钾发生分解反应,产生氧气和一氧化氮。
这些产物是硝酸钾的典型反应产物,也是研究硝酸钾性质的重要依据。
结论:本实验通过观察和记录硝酸钾的溶解性、晶体形态以及加热分解反应等现象,加深了对硝酸钾性质和特点的理解。
溶解热的测定 实验报告姓名/学号:何一白/2012011908 班级:化22 同组实验者姓名:苏剑晓 实验日期:2014年12月4日 提交报告日期:2014年12月10日带实验的老师姓名:王溢磊1 引言(简明的实验目的/原理)1.1 实验目的1.测量硝酸钾在不同浓度水溶液的溶解热,求硝酸钾在水中溶解过程的各种热效应。
2。
掌握量热装置的基本组合及电热补偿法测定热效应的基本原理。
3。
复习和掌握常用的测温技术.1。
2 实验原理物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热 在恒温恒压下,溶质B 溶于溶剂A (或溶于某浓度溶液)中产生的热效应,用sol H ∆表示。
摩尔积分溶解热 在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用sol m H ∆表示.sol sol m BHH n ∆∆=(1) 式中, B n 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热 在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以,,()A sol T P n B H n ∂∆∂表示,简写为()A sol n BHn ∂∆∂。
稀释热 在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热 在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以dil m H ∆表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中,2sol m H ∆、1sol m H ∆为两种浓度的摩尔积分溶解热。
摩尔微分稀释热 在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以,,()B sol T P n A Hn ∂∆∂表示,简写为()B sol n AHn ∂∆∂. 在恒温恒压下,对于指定的溶剂A 和溶质B,溶解热的大小取决于A 和B 的物质的量,即 (,)sol A B H n n ∆=⎰ (3)由(3)式可推导得:,,,,()()B A sol sol sol A T P n B T P n A B H HH n n n n ∂∆∂∆∆=+∂∂ (4) 或 ,,,,()()B Asol sol A sol m T P n T P n B A BHH n H n n n ∂∆∂∆∆=+∂∂(5) 令0/A B n n n =,(5)改写为:0,,,,()()B A sol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂ (6) (6)式中的sol m H ∆可由实验测定,0n 由实验中所用的溶质和溶剂的物质的量计算得到。
实验五硝酸钾溶解度的测定一、实验目的1、了解饱和溶解度的概念以及影响饱和溶解度的因素;3、掌握溶液的制备、热力学变化和测定方法;4、培养实验操作和数据处理的能力,提高实验技能。
二、实验原理1、饱和溶解度物质溶解在溶剂中的过程是一个动态平衡过程,当溶液中的溶质量达到一定数量时,剩余溶质量不溶解,此时称为饱和溶液。
在一个有限的系统中,只能有一种饱和溶液。
饱和溶液中溶质的浓度与沉淀的浓度成为平衡浓度。
饱和溶液的温度、压力和溶剂种类等因素都会影响平衡浓度。
硝酸钾在水中的饱和溶解度与温度有关。
一般情况下,溶解度随着温度的增高而增大。
其水溶液容易吸湿,在空气中易变质。
另外,硝酸钾在水中的溶解度还与气压等因素有关,但影响不够明显。
利用过量饱和法测定硝酸钾的溶解度。
所谓过量饱和法,就是在冷水中加入较多的溶质,进而热化,使得其中的部分回溶。
此时,比溶液中的溶质多一点的量即不能溶解,就称为过量。
在此情况下,需要密闭容器,将其沉淀。
然后用玻璃棒把沉淀吸出来,在室温下过滤去液。
液体和沉淀分别测定浓度,即可计算溶解度。
三、实验步骤1、制备硝酸钾溶液称取5g的硝酸钾样品,并加入50mL无菌的蒸馏水中搅拌溶解。
加入时最好慢慢加入,以免产生泡沫,化学反应过程迅速。
最后,将溶液过滤并丢弃沉淀。
2、制备饱和溶液分别取10mL、20mL、30mL、40mL、50mL、60mL,6个样品,装入50mL容量瓶中,并加入硝酸钾配制好的溶液,装满瓶子。
摇晃,并加入氩气,盖上瓶塞。
3、计算和检测溶液的浓度和饱和度将室温下沉淀液体过滤至0.22μm,然后滴定液体的浓度,通过硝酸盐的化学反应计算浓度,即可算出饱和度。
四、实验注意事项1、安全注意硝酸钾为易爆炸易燃物质,加入时需要小心。
实验过程要严格实行安全操作规程,穿好实验室标准的实验服,建议戴上防护眼镜进行化学实验。
2、操作注意尊重操作的程序,佩戴适当的防护装备,保证实验操作的正确性、快速性和准确性。
溶解热的测定一、实验目的1、用量热法测定KNO 3在水中的溶解热。
2、掌握测温量热的基本原理和测量方法。
3、了解量热法测定积分溶解热的基本原理。
二、实验原理物质溶解时常伴有热效应,此热效应称为该物质的溶解热。
物质的溶解热通常包括溶质晶格的破坏和溶质分子或离子的溶剂化。
其中,晶格的破坏常为吸热过程,溶剂化作用常为放热过程,溶解热即为这两个过程的热量的总和。
而最终是吸热或放热则由这两个热量的相对大小所决定。
温度、压力以及溶质和溶剂的性质、用量、是影响溶解热的显著因素,根据物质在溶解过程中溶液浓度的变化,溶解热分为变浓溶解热和定浓溶解热,变浓溶解热又称积分溶解热,为定温定压条件下一摩尔物质溶于一定量的溶剂形成某浓度的溶液时,吸入或放出的热量,定浓溶解热又称微分溶解热,为定温定压条件下一摩尔物质溶于大量某浓度的溶液时,产生的热量。
积分溶解热可用量热法直接测得,微分溶解热可从积分溶解热间接求得。
方法是,先求出在定量溶剂中加入不同溶质时的积分溶解热,然后以热效应为纵坐标,以溶质摩尔数为横坐标绘成曲线,曲线上的任何一点的斜率即为该浓度时的微分溶解热。
量热法测定积分溶解热,通常在被认为是绝热的量热计中进行,首先标定该量热系统的热容量,然后通过精确测量物质溶解前后因吸热或放热引起量热体系的温度变化,来计算溶解过程的热效应,并据此计算物质在该溶液温度、浓度下的积分溶解热。
1.量热系统热容量的标定用一已知积分溶解热的标准物质,在量热计中进行溶解,测出溶解前后量热系统的温度变化值ΔT S ,则量热系统的热容C 可以根据下式计算:式中m S 和M S 分别为标准物质的质量和摩尔质量,ΔH S 为标准物质在某溶液温度及浓度下的积分溶解热,此值可由手册上查得,C 为量热系统的热容。
2.积分溶解热的测定 将上式用于待测物质即得:SS S S T M H m C ∆⋅∆⋅=mTM C H ∆⋅⋅=∆式中m和M分别为待测物质的质量和摩尔质量,ΔT为待测物质溶解前后量热系统的温度变化值;C为已标定的量热系统的热容。
华南师范大学实验报告学生姓名 学 号____ 专 业 化学(师范) 年级、班级___ 课程名称 物理化学实验 实验项目 实验类型 □验证 □设计 □综合 实验时间 年 月 日 实验指导老师 实验评分 【实验目的】1. 设计简单量热装置测定某物质在水中的积分溶解热。
2. 复习和掌握常用的量热技术与温度测定与校正方法。
3. 由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。
【实验原理】溶解热,即为一定量的物质溶解于一定量的溶剂中所产生的热效应。
溶解热除了与溶剂量及溶质量有关外,还与体系所处的温度及压力有关。
溶解热分为积分溶解热和微分溶解热。
积分溶解热是指在等温等压下把1mol 溶质溶解在一定量的溶剂中时所产生的热效应。
它是溶液组成的函数,若形成溶液的浓度趋近于零,积分溶解热也趋近于一定值,称为无限稀释积分溶解热。
积分溶解热是溶解时所产生的热量的总和,可由实验直接测定。
微分溶解热是等温等压下,在大量给定浓度的溶液里加入1mol 溶质时所产生的热效应,它可以表示为0,,)(np T sol n H∂∆∂,因溶液的量很大,所以尽管加入1mol 溶质,浓度仍可视为不变。
微分热难以直接测量,但可通过实验,用间接的方法求得。
溶解热的测量可通过绝热测温式量热计进行,它是在绝热恒压而且不做非体积功的条件下,通过测定量热系统的温度变化,而推算出该系统在等温等压下的热效应。
本实验采用标准物质法进行量热计能当量的标定。
利用1molKCl 溶于200mL 水中的积分溶解热数据进行量热计的标定。
当上述溶解过程在恒压绝热式量热计中进行时,可设计如下途径:在上述途径中,ΔH1为KCl(s)、H2O(l)及量热计从T1等压变温至T2过程的焓变,ΔH2则为在T2温度下,物质的量为n1 mol的KCl(s)溶于n2 mol H2O(l)中,形成终态溶液的焓变。
因为ΔH=ΔH1 +ΔH2=0ΔH2 =-ΔH1所以ΔH1=[ n1 C p,m(KCl,s)+ n2C p,m(H2O,l)+K]×(T2-T1)ΔH2=n1Δsol H mK=-[n1 C p,m(KCl,s)+ n2C p,m(H2O,l)]+ n1Δsol H m/( T2-T1)=-[m1 C p (KCl,s)+ m2 C p (H2O,l)]+ m1Δsol H m/M1ΔT (1)式中,m1、m2分别为溶解过程加入的KCl(s)和H2O(l)的质量;C p,m为物质的恒压比热容;C p (KCl,s)=0.699kJ/(kg·K),C p (H2O,l)=4.184 kJ/(kg·K);M1为KCl的摩尔质量;ΔT= T2-T1,即为溶解前后系统温度的差值;Δsol H m为1mol KCl溶解于200mL H2O的积分溶解热,其不同温度下的积分溶解热值见附录。
实验7 硝酸钾在水中的溶解
实验类型:
验证性实验
实验目的:
1.认识硝酸钾在一定量的水中的溶解是有限度的;
2.初步认识硝酸钾饱和溶液和不饱和溶液在一定条件下可以相互转化。
实验用品:
烧杯、量筒、胶头滴管、玻璃棒、药匙、滤纸、天平,铁架台(带铁圈)、石棉网、酒精灯、火柴;
硝酸钾、蒸馏水。
实验过程:
问题与讨论:
1.用托盘天平称取5g硝酸钾,硝酸钾能直接放在托盘上吗?为什么?
2.如何正确加热烧杯中的物质?
3.该实验中,如何判断硝酸钾固体在水中不再继续溶解了?。