高考新突破物质结构与性质选修大题:杂化类型及分子空间构型的判断方法
- 格式:ppt
- 大小:700.50 KB
- 文档页数:12
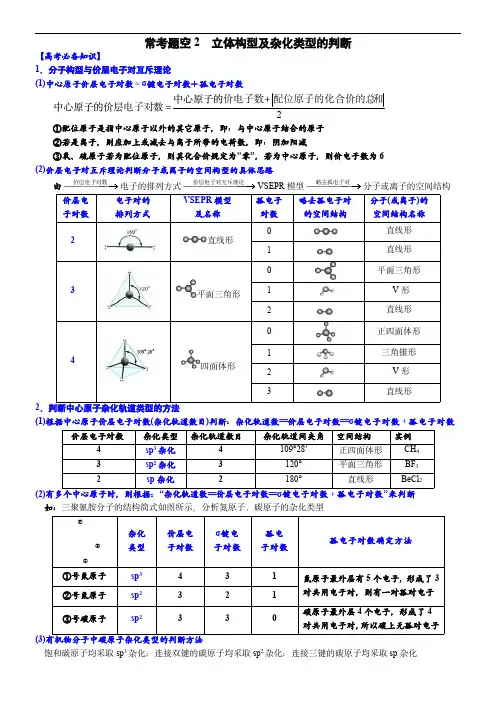
常考题空2立体构型及杂化类型的判断【高考必备知识】1.分子构型与价层电子对互斥理论(1)中心原子价层电子对数=σ键电子对数+孤电子对数2中心原子的数中心原子的价层和配位原子的化合价的总价电子数电子对 ①配位原子是指中心原子以外的其它原子,即:与中心原子结合的原子②若是离子,则应加上或减去与离子所带的电荷数,即:阴加阳减③氧、硫原子若为配位原子,则其化合价规定为"零”,若为中心原子,则价电子数为6(2)价层电子对互斥理论判断分子或离子的空间构型的具体思路由 价层电子对数电子的排列方式 价层电子对互斥理论VSEPR 模型 略去孤电子对分子或离子的空间结构价层电子对数电子对的排列方式VSEPR 模型及名称孤电子对数略去孤电子对的空间结构分子(或离子)的空间结构名称2直线形0直线形1直线形3平面三角形0平面三角形1V 形2直线形4四面体形0正四面体形1三角锥形2V 形3直线形2.判断中心原子杂化轨道类型的方法(1)根据中心原子价层电子对数(杂化轨道数目)判断:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化类型杂化轨道数目杂化轨道间夹角空间结构实例4sp 3杂化4109°28′正四面体形CH 43sp 2杂化3120°平面三角形BF 32sp 杂化2180°直线形BeCl 2(2)有多个中心原子时,则根据:“杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型jk l杂化类型价层电子对数σ键电子对数孤电子对数孤电子对数确定方法①号氮原子sp 3431氮原子最外层有5个电子,形成了3对共用电子对,则有一对孤对电子②号氮原子sp 2321③号碳原子sp 2330碳原子最外层4个电子,形成了4对共用电子对,所以碳上无孤对电子(3)有机物分子中碳原子杂化类型的判断方法饱和碳原子均采取sp 3杂化;连接双键的碳原子均采取sp 2杂化;连接三键的碳原子均采取sp 杂化3.分子或离子的空间结构及杂化类型判断【真题演练】1.(2022·全国甲卷)CF2=CF2和ETFE分子中C的杂化轨道类型分别为_______和_______;2.(2022·全国乙卷)一氯乙烯(C2H3Cl)分子中,C的一个_______杂化轨道与Cl的3p x轨道形成C-Cl_______键,并且Cl的3p z轨道与C的2p z轨道形成3中心4电子的大 键(43 )3.(2022·湖南卷)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为NH-2,反应过程如图所示:产物中N原子的杂化轨道类型为_______4.(2022·广东卷)硒的两种含氧酸的酸性强弱为H2SeO4_______H2SeO3(填“>”或“<”)。

热点04 物质结构与性质(选择题)物质结构与性质的选择题是江苏高考的必考内容,属于热点问题,本题考查化学选修3《物质结构与性质》的相关知识,常涉及如下高频考点:原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)命题形式有两种:一是直接给出元素,围绕给出元素的原子结构、形成的物质等进行考查;二是给出元素的原子的一些结构特点等,首先判断出元素,然后再进行相应的考查。
一、有关基态原子的核外电子排布1. 四种表示方法S:2.1. 价层电子对互斥模型说的是价层电子对的空间构型,而分子的空间构型指的是成键电子对的空间构型,不包括孤电子对。
①当中心原子无孤电子对时,两者的构型一致。
①当中心原子有孤电子对时,两者的构型不一致。
对AB m 型分子或离子,其价层电子对数的判断方法为:21=n ×(中心原子的价电子数+每个配位原子提供的价电子数×m ±电荷数) 三、杂化轨道模型的判断 (1)看中心原子形成的价键类型(2)价电子对法四、“两角度”1. 不同类型晶体熔、沸点的比较(1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2. 同种类型晶体熔、沸点的比较(1)原子晶体原子半径越小→键长越短→键能越大→熔、沸点越高如熔点:金刚石>碳化硅>硅。
(2)离子晶体①一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力越强,其晶体的熔、沸点越高,如熔点:MgO>MgCl2,NaCl>CsCl。
①衡量离子晶体稳定性的物理量是晶格能。
晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
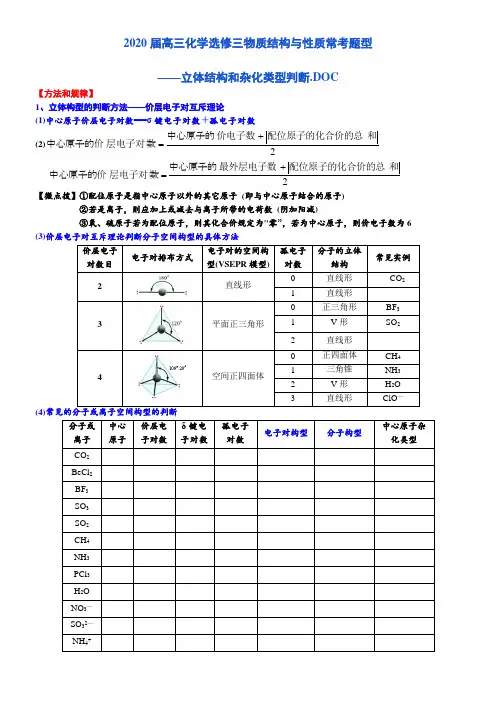
2020届高三化学选修三物质结构与性质常考题型——立体结构和杂化类型判断.DOC【方法和规律】1、立体构型的判断方法——价层电子对互斥理论 (1)中心原子价层电子对数===σ键电子对数+孤电子对数 (2)2中心原子的数中心原子的价层和配位原子的化合价的总价电子数电子对+=2中心原子的数中心原子的价层和配位原子的化合价的总最外层电子数电子对+=【微点拨】①配位原子是指中心原子以外的其它原子 (即与中心原子结合的原子) ②若是离子,则应加上或减去与离子所带的电荷数 (阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为"零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法价层电子对数目 电子对排布方式电子对的空间构型(VSEPR 模型)孤电子对数 分子的立体结构 常见实例2直线形0 直线形 CO 2 1 直线形 3平面正三角形0 正三角形 BF 3 1 V 形 SO 2 2 直线形 4空间正四面体正四面体 CH 4 1 三角锥 NH 3 2 V 形 H 2O 3直线形ClO —(4)分子或离子 中心原子 价层电子对数 δ键电子对数孤电子对数 电子对构型分子构型中心原子杂化类型 CO 2 BeCl 2 BF 3 SO 3 SO 2 CH 4 NH 3 PCl 3 H 2O NO 3— SO 32— NH 4+PO 43— H 3O +2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式 4 sp 3杂化 3 sp 2杂化 2sp 杂化技巧1:ABn 型的分子或离子,用2中心原子的数中心原子的价层和配位原子的化合价的总价电子数电子对+=,来迅速判断 (见上表)技巧2:若有多个中心原子时,则根据:“杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断 如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型 价层电子对数 σ键电子对数 孤电子对数孤电子对数确定方法环外氮原子 sp 3 4 3 1 氮原子最外层有5个电子,形成了3对共用电子对,则有一对孤对电子 环上氮原子 sp 2 3 2 1 环上碳原子sp 233碳原子最外层4个电子,形成了4对共用电子对,所以碳上无孤对电子①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp 3杂化 ②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp 2杂化 ③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化 技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp 3杂化 ②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp 2杂化 ③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化 技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N -3与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化 技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp 3杂化,含一个π键为sp 2杂化,含两个π键为sp 杂化 【真题感悟】1、[2019·全国卷Ⅰ·节选] 乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是_______2、[2019·全国卷Ⅱ·节选] 元素As 与N 同族。

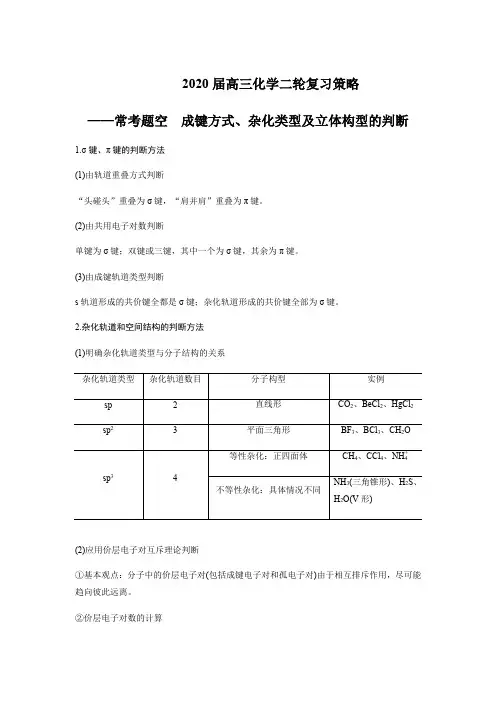
2020届高三化学二轮复习策略——常考题空成键方式、杂化类型及立体构型的判断1.σ键、π键的判断方法(1)由轨道重叠方式判断“头碰头”重叠为σ键,“肩并肩”重叠为π键。
(2)由共用电子对数判断单键为σ键;双键或三键,其中一个为σ键,其余为π键。
(3)由成键轨道类型判断s轨道形成的共价键全都是σ键;杂化轨道形成的共价键全部为σ键。
2.杂化轨道和空间结构的判断方法(1)明确杂化轨道类型与分子结构的关系(2)应用价层电子对互斥理论判断①基本观点:分子中的价层电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能趋向彼此远离。
②价层电子对数的计算价层电子对数=成键电子对数+中心原子的孤电子对数=中心原子的价电子数+每个配位原子提供的电子数×m±电荷数2③价层电子对互斥理论在判断分子构型中的应用。
题组一σ键、π键的判断1.高考题组合(1)[2018·江苏,21(4)]N2分子中σ键与π键的数目比n(σ)∶n(π)=________。
(2)[2017·江苏,21(2)]丙酮()分子中碳原子轨道的杂化类型是________,1 mol 丙酮分子中含有σ键的数目为________。
(3)[2015·全国卷Ⅰ,37(3)节选]CS2分子中,共价键的类型有________________。
答案(1)1∶2(2)sp2和sp39N A(3)σ键和π键解析(2)丙酮中—CH3中碳原子形成4个单键,为sp3杂化,羰基中碳原子形成3个σ键,1个π键,为sp 2杂化。
丙酮的结构式为有9个σ键(6个C—H 键,2个C—C 键,1个C—O 键)。
题组二 杂化方式、立体构型的判断 2.高考题组合(1)[2017·全国卷Ⅲ,35(2)]CO 2和CH 3OH 分子中C 原子的杂化形式分别为________和________。
(2)[2016·全国卷Ⅱ,37(2)①][Ni(NH 3)6]SO 4中阴离子的立体构型是________。
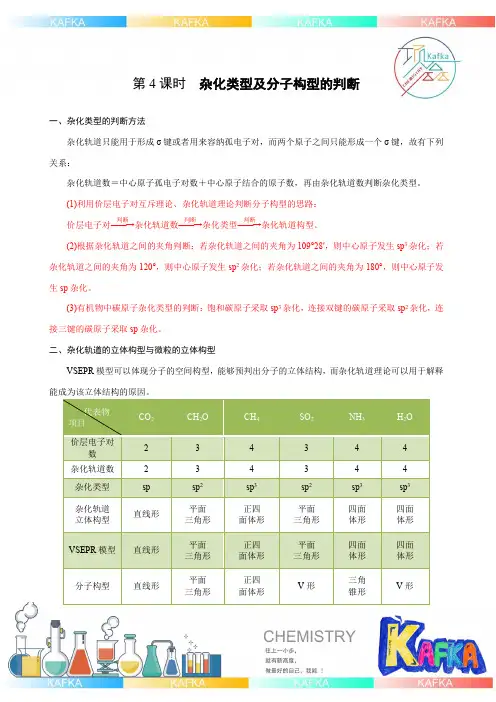
第4课时 杂化类型及分子构型的判断一、杂化类型的判断方法杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。
(1)利用价层电子对互斥理论、杂化轨道理论判断分子构型的思路: 价层电子对――→判断杂化轨道数――→判断杂化类型――→判断杂化轨道构型。
(2)根据杂化轨道之间的夹角判断:若杂化轨道之间的夹角为109°28′,则中心原子发生sp 3杂化;若杂化轨道之间的夹角为120°,则中心原子发生sp 2杂化;若杂化轨道之间的夹角为180°,则中心原子发生sp 杂化。
(3)有机物中碳原子杂化类型的判断:饱和碳原子采取sp 3杂化,连接双键的碳原子采取sp 2杂化,连接三键的碳原子采取sp 杂化。
二、杂化轨道的立体构型与微粒的立体构型VSEPR 模型可以体现分子的空间构型,能够预判出分子的立体结构,而杂化轨道理论可以用于解释能成为该立体结构的原因。
代表物 项目 CO 2 CH 2O CH 4 SO 2 NH 3 H 2O 价层电子对数 2 3 4 3 4 4 杂化轨道数 2 3 4 3 4 4 杂化类型 sp sp 2 sp 3 sp 2 sp 3 sp 3 杂化轨道 立体构型 直线形平面 三角形 正四 面体形 平面 三角形 四面 体形 四面 体形 VSEPR 模型直线形平面 三角形 正四 面体形 平面 三角形 四面 体形 四面 体形 分子构型 直线形平面 三角形正四 面体形V 形三角 锥形V 形三、杂化轨道类型与分子的立体构型关系价层电子数VSEPR(理想模型)杂化类型理想键角分子立体构型2直线型sp180°直线型3平面(正)三角形sp2120°视有无孤电子对4(正)四面体型sp3109°28′视有无孤电子对注意:1.孤电子对的排斥能力比σ电子对排斥能力强,因此含有孤电子对的键角小于理想键角。

分子或离子空间构型的判断方法在高考试题中,分子或离子空间构型的判断是一种常考的问题,要求“能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构”。
现将几种判断粒子空间构型的简单方法总结如下。
一、根据杂化理论判断。
即中心原子的杂化方式的判断方法。
杂化轨道数=中心原子所结合的原子数+(中心原子的价电子数﹣周边原子未成对电子总数)/2(ABm型)说明:若是离子,中心原子的价电子数还应加上负离子的电荷数或减去正离子的电荷数。
判断思路:先判断中心原子杂化方式,然后根据中心原子所结合的原子数和孤电子对数再判断分子的空间构型。
例1.推测常见分子的杂化方式与空间构型:CO2、BF3、CH4、NH3、H2O。
O2:2+(4-4)/2=2BF3:3+(3-3)/2=3CH4:4+(4-4)/2=4NH3:3+(5-3)/2=4H2O:2+(6-2)/2=4中心原子是分别采用sp、sp2、sp3、sp3、sp3杂化,杂化轨道形状分别为直线形(夹角为180º)、平面正三角形(夹角为120º)、正四面体形(夹角为109º28′)、正四面体形、正四面体形。
由于CO2、BF3、CH4中没有孤对电子,分子的空间构型与杂化轨道的空间形状一致。
由于NH3、H2O分别有1对、2对孤对电子,分子的空间构型与杂化轨道的空间形状不一致,所以NH3呈三角锥形,受1对孤对电子的排斥,键角变小,键角是107º18′;H2O呈V形,受2对孤对电子的排斥,排斥作用比NH3更强,键角变得更小些,键角是104.5º。
例2.推测下列微粒的杂化方式与空间构型:SO3、SO2、CO32-、O4。
SO3:3+(6-6)/2=3SO2:2+(6-4)/2=3CO32-:3+(6-6)/2=3O4:3+(6-6)/2=3(O4以其中1个O原子作为中心原子,其余3个O原子作为配位原子)。
杂化轨道数全是3,中心原子均是采用sp2杂化;由于SO3、O4、CO32-均没有孤对电子,均呈平面正三角形,键角等于120º。

如何判断分子的空间构型和原子的杂化如何判断分子的空间构型和一个分子的中心原子究竟采取哪种类型的杂化是高考的一个重点也是一个难点。
可以用“价层电子对互斥理论(VSEPR)”判断分子的空间构型,也可以借助“杂化轨道理论”来判断分子的空间构型。
这里来介绍“价层电子对互斥理论”的应用及判断一个分子的中心原子杂化类型的方法。
“价层电子对互斥理论(VSEPR)”认为:ABx型分子的空间构型总是采取中心原子A 价层电子对相互排斥最小的那种几何构型。
第一步:确定中心原子A的价层电子对数目。
中心原子A的价层电子对是指分子中的中心原子上的电子对,包括δ键电子对(也称成键电子对)和中心原子上的孤电子对。
δ键电子对数有分子式确定:对ABx型分子,x就是中心原子A的δ键电子对数目。
如BCl3分子中,中心原子B的δ键电子对数= 3;H2O中O的δ键电子对数= 4 SO3中S的δ键电子对数=3而中心原子的孤电子对数=(a-xb)/2式中的a为中心原子的价电子数,对主族元素来说,价电子数等于原子的最外层电子数;x为与中心原子结合的原子数(即ABx分子中的x);b为与中心原子结合的原子最多结合的电子数,H为1,其它原子等于“8-该原子的价电子数”如果讨论的是离子,对阳离子a为中心原子的价电子数减去离子的电荷数,对阴离子a为中心原子的价电子数加上离子的电荷数;例如CCl4中δ键电子对数为4,孤电子对数=(4-4 ×1)/2=0C的价层电子对数= 4 + 0 = 4SO3中δ键电子对数为3;孤电子对数=(6-3×2)/2=0S的价层电子对数=3 + 0 = 3H2O中δ键电子对数为2;孤电子对数=(6-2×1)/2=2O的价层电子对数= 2 +2 = 4NH4+中δ键电子对数为4;孤电子对数=(5-1-4×1)/2=0N的价层电子对数= 4 + 0 = 4SO42—中δ键电子对数为4;孤电子对数=(6+2-4×2)/2=0S的价层电子对数= 4 + 0 = 4PO43—中δ键电子对数为4;孤电子对数=(5+3-4×2)/2=0P的价层电子对数=4 + 0 = 4如果价层电子对数出现小数,可把这个单电子当作电子对看待四,如果对分子空间构型比较清楚的话,也可以根据分子的空间构型判断中心原子的杂化,直线型的中心原子发生SP杂化,如CO2、乙炔中的碳原子发生SP杂化;平面三角形结构的中心原子发生SP2杂化,如烯烃中形成的C=C、苯环、醛基、羧基、羰基、石墨、石墨烯中的C原子发生SP2杂化;呈正四面体结构,以SP3杂化方式。

分子的立体构型及杂化方式的判断方法1.VSEPR理论:VSEPR理论是根据分子中的电子对的排斥效应来预测分子的立体构型。
根据这一理论,分子中的电子对(包括原子间键合电子对和孤对电子对)会尽量远离彼此,从而使得分子呈现出一定的几何形状。
通过确定分子中原子的中心原子、其他原子和孤对电子对的数量,可以用VSEPR理论预测分子的构型。
2.分子对称性:分子的对称性可以提供有关分子构型的重要信息。
通过观察分子的对称轴、平面反转中心、镜面反射面等,可以推断分子的几何结构。
例如,如果一个分子具有旋转轴,那么该分子很可能是线性的;若分子具有反射面,则可能是平面的。
3. 分子轨道理论:分子轨道理论描述了分子中电子的分布情况,指出原子轨道会经过一个或多个杂化过程而形成分子轨道。
通过观察分子中的化学键及相关杂化轨道的形状,可以推断出分子的杂化方式。
例如,如果分子中存在 sigma 键,则可判断该分子中原子的杂化方式为 sp 杂化;如果分子中存在 pi 键,则可判断杂化方式为 sp2 或 sp3 杂化。
4.光谱学方法:光谱学方法可以通过分析分子在不同波长下吸收和发射的电磁辐射来研究分子的构型和杂化。
例如,红外光谱可以提供分子中不同键弯曲、拉伸等振动模式的信息,从而帮助确定分子的立体构型;核磁共振光谱可以提供分子中不同核磁共振信号的信息,从而揭示出分子中不同原子的环境和构型。
5.计算化学方法:计算化学方法可以通过理论计算来预测分子的构型和杂化。
例如,量子力学方法(如密度泛函理论)可以计算分子的电子结构和能量,从而推测分子的构型和杂化方式。
总之,分子的立体构型和杂化方式可以通过VSEPR理论、分子对称性、分子轨道理论、光谱学方法和计算化学方法等多种途径来判断。
这些方法的使用取决于具体分子的性质和研究目的。


2021-2022学年高二化学重难点专题突破模块二分子结构与性质专题05 分子的空间结构及中心原子杂化轨道类型的判断方法一.选择题1.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是()A.乙醛[] B.丙烯腈[]C.甲醛[] D.丙炔[]解析A[答案]乙醛中甲基的碳原子采取sp3杂化,醛基中的碳原子采取sp2杂化;丙烯腈中碳碳双键的两个碳原子均采取sp2杂化,另一个碳原子采取sp杂化;甲醛中碳原子采取sp2杂化;丙炔中甲基的碳原子采取sp3杂化,碳碳三键中两个碳原子均采取sp杂化。
2.BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF-4,则BF3和BF-4中B原子的杂化轨道类型分别是()A.sp2、sp2B.sp3、sp3C.sp2、sp3D.sp、sp2解析C[答案]BF3中B原子的价层电子对数为3,所以为sp2杂化,BF-4中B原子的价层电子对数为4,所以为sp3杂化。
3.在BrCH===CHBr分子中,C—Br采用的成键轨道是()A.sp—p B.sp2—sC.sp2—p D.sp3—p解析C[答案]BrCH===CHBr分子中的两个碳原子都采取sp2杂化,溴原子的价层电子排布为4s24p5,4p轨道上有一个未成对电子,与碳原子的一个sp2杂化轨道成键,C项正确。
4.氨分子的空间结构是三角锥形,而甲烷是正四面体形,这是因为()A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一个未成键的孤电子对,它对成键电子对的排斥作用较强D.氨气分子是极性分子而甲烷是非极性分子解析C[答案]氨分子中的N原子和甲烷分子中的C原子都是sp3杂化,C原子的四个杂化轨道全部参与成键,而N 原子的杂化轨道中有3个参与成键,还有一个孤电子对,孤电子对对成键电子对的排斥作用较强,从而使得两种分子的结构不同,C项正确。
判断分⼦空间构型及中⼼原⼦杂化类型的简易⽅法在⾼中化学选修模块《物质结构与性质》中,为了确定分⼦的空间构型,不同版本的教材介绍了不同的⽅法,主要都跟价电⼦有关。
如鲁教版⽤的是算中⼼原⼦上的孤电⼦对数:⽽苏教版则主要算价电⼦对数:其实⼆者最终都是⼀致的,都要综合考虑价电⼦对数和孤电⼦对数的影响,⽐如对CO2来讲,按鲁教版的⽅法,成键电⼦对数(n)等于与中⼼原⼦成键的原⼦数,即n=2,孤电⼦对数为(4—2×2)/2=0,n=2⼜不受孤电⼦对的影响,所以其分⼦为直线型。
⽽按苏教版则是确定价电⼦对数n=(4 + 0×2)/2=2,所以为直线型。
由于列了计算式,有的还设定氧族元素算作0,学⽣在理解和应⽤上会有些不便,在教学中,我想可以简化⼀下判断的⽅法,将它们和常⽤的化合价结合起来。
在⾼中阶段主要的任务是学会s和p轨道的三种杂化类型,所以⼀般就是判断AB2、AB3、AB4这三种分⼦的空间构型,我想请学⽣注意的是成键的电⼦对数(即与中⼼原⼦成键的原⼦数)和有⽆孤电⼦对。
⽽孤电⼦对则可以⽤中⼼原⼦的价电⼦数减去化合价的价数除以2。
如H2O中的氧原⼦的孤电⼦对数是(6—2)/2=2,CH4中碳原⼦的孤电⼦对数是(4—4)/2=0。
对AB2型分⼦,其可能有的构型就是直线形和V字形,没有孤电⼦对时为直线形,是sp1杂化,有孤电⼦对时为V字形,是SP2(⼀对孤电⼦对)或SP3杂化(两对孤电⼦对)。
对AB3型分⼦,其可能的构型就是平⾯三⾓形和三⾓锥形,没有孤电⼦对时为平⾯三⾓形,是sp2杂化,有孤电⼦对时为三⾓锥形,是SP3杂化。
对AB4型分⼦,构型基本就是四⾯体了。
在s和p轨道杂化中,最多也就四个杂化轨道,四个电⼦对,所以外围的四个成键原⼦,构成⼀个四⾯体的结构。
下⾯以硫和氧结合的⼏种结构为例:如SO2,⾸先判断其可能的结构为直线形或V字形,⽽中⼼原⼦硫价电⼦数是6,在化合物中为+4价,所以孤电⼦对数是(6—4)/2=1,可确定其为V字形,是sp2杂化。
《物质结构与性质》重难点突破--杂化类型和微粒空间构型的
判断
苗慧霞
【期刊名称】《高中数理化》
【年(卷),期】2022()11
【摘要】在《物质结构与性质》模块的考题中,杂化类型的判断和分子的空间构型是每年的必考点.解决这类问题的关键首先是需要弄清楚一些基本概念,然后在理解
概念的基础上结合情境进行练习,形成解题的思路和模型.这是突破这类问题行之有
效的方法,同时也是对证据推理与模型认知化学核心素养的落实.
【总页数】3页(P87-89)
【作者】苗慧霞
【作者单位】河南省三门峡市外国语高级中学
【正文语种】中文
【中图分类】G63
【相关文献】
1.上位学习中应用支架式教学模式的研究——以苏教版《物质结构与性质》"分子
的空间构型"为例2.基于物质结构判断多中心原子的杂化类型3.新课程高考中中心原子杂化类型与分子的空间构型的判断方法4.关于元素原子杂化轨道及空间构型
判断方法的几点探讨5.群论方法在配位化学中的应用(Ⅱ)—判断配合物的杂化类型、空间构型、顺反异构和单合、二合配体
因版权原因,仅展示原文概要,查看原文内容请购买。
常考题空二 立体结构和杂化类型判断【方法和规律】1、立体构型的判断方法——价层电子对互斥理论 (1)中心原子价层电子对数===σ键电子对数+孤电子对数 (2)2中心原子的数中心原子的价层和配位原子的化合价的总价电子数电子对+=2中心原子的数中心原子的价层和配位原子的化合价的总最外层电子数电子对+=【微点拨】①配位原子是指中心原子以外的其它原子 (即与中心原子结合的原子) ②若是离子,则应加上或减去与离子所带的电荷数 (阴加阳减)③氧、硫原子若为配位原子,则其化合价规定为"零”,若为中心原子,则价电子数为6 (3)价层电子对互斥理论判断分子空间构型的具体方法价层电子对数目 电子对排布方式电子对的空间构型(VSEPR 模型)孤电子对数 分子的立体结构 常见实例2直线形0 直线形 CO 2 1 直线形 3平面正三角形0 正三角形 BF 3 1 V 形 SO 2 2 直线形 4空间正四面体正四面体 CH 4 1 三角锥 NH 3 2 V 形 H 2O 3直线形ClO —(4)分子或离子 中心原子 价层电子对数 δ键电子对数孤电子对数 电子对构型分子构型中心原子杂化类型 CO 2 BeCl 2 BF 3 SO 3 SO 2 CH 4 NH 3 PCl 3 H 2O NO 3— SO 32— NH 4+ PO 43— H 3O +2、中心原子的杂化类型判断规律:杂化轨道数==价层电子对数==σ键电子对数+孤电子对数价层电子对数杂化方式 4 sp 3杂化 3 sp 2杂化 2sp 杂化 技巧1:ABn型的分子或离子,用2中心原子的数中心原子的价层和配位原子的化合价的总价电子数电子对+=,来迅速判断 (见上表)技巧2:若有多个中心原子时,则根据:“杂化轨道数==价层电子对数==σ键电子对数+孤电子对数”来判断 如:三聚氰胺分子的结构简式如图所示,分析氮原子、碳原子的杂化类型杂化类型 价层电子对数 σ键电子对数 孤电子对数孤电子对数确定方法环外氮原子 sp 3 4 3 1 氮原子最外层有5个电子,形成了3对共用电子对,则有一对孤对电子环上氮原子 sp 2 3 2 1 环上碳原子sp 233碳原子最外层4个电子,形成了4对共用电子对,所以碳上无孤对电子①若杂化轨道在空间的分布为正四面体形或三角锥形,则分子的中心原子发生sp 3杂化 ②若杂化轨道在空间的分布呈平面三角形,则分子的中心原子发生sp 2杂化 ③若杂化轨道在空间的分布呈直线形,则分子的中心原子发生sp 杂化 技巧4:根据杂化轨道之间的夹角判断①若杂化轨道之间的夹角为109°28′,则分子的中心原子发生sp 3杂化 ②若杂化轨道之间的夹角为120°,则分子的中心原子发生sp 2杂化 ③若杂化轨道之间的夹角为180°,则分子的中心原子发生sp 杂化 技巧5:根据等电子原理进行判断CO 2是直线形分子,CNS -、N -3与CO 2是等电子体,所以分子构型均为直线形,中心原子均采用sp 杂化 技巧6:根据分子或离子中有无π键及π键数目判断没有π键为sp 3杂化,含一个π键为sp 2杂化,含两个π键为sp 杂化 【真题感悟】1、[2019·全国卷Ⅰ·节选] 乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是_______2、[2019·全国卷Ⅱ·节选] 元素As 与N 同族。