高中化学氧化还原反应整理版
- 格式:pdf
- 大小:427.15 KB
- 文档页数:9


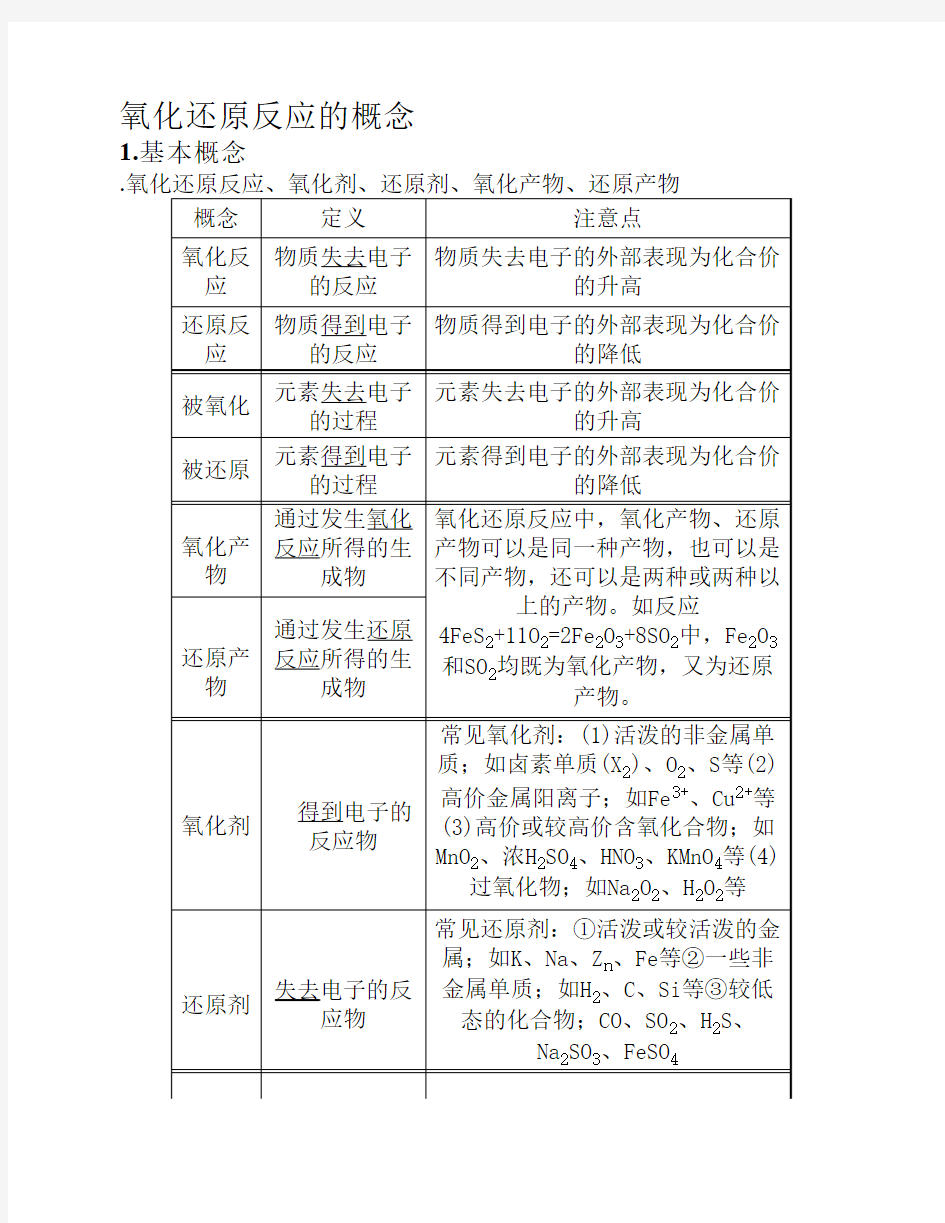
氧化还原反应的概念1.基本概念
.
2.基本概念之间的关系:
氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物标电子转移的方向和数目(双线桥法、单线桥法)①单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
2e-——
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例:
得2e-——
失2e-——
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
两类特殊的化学反应
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
失5e
得5×e
3Cl2+6KOHKClO3+5KCl+3H2O
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
失5×e-
得5e-
KClO3+6HCl3Cl2+ 6KCl↑ +3H2O
1.根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
2.根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
3.根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:
规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,
反应物中还原剂的还原性强于生成物中还原产物的还原性。
[例2]常温下,在下列溶液中发生如下反应
①16H++10Z-+2XO4-=2x2++5Z2+8H2O ②2A2+ +B2=2A3++2B-
③2B-+Z2=B2+2Z-由此判断下列说法错误的是()
A.反应Z2+2A2+=2A3++2Z-可以进行。
B.Z元素在①③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
[例2]金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+ bCl2+ cC
aTiCl4+ cCO ……反应①
TiCl4+2Mg
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是()
①TiCl4在反应①中是还原产物,在反应②中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
[解析]②中C、Mg在反应中均为还原剂,被氧化;经计算知⑤中每生成19.2 g Ti,反应①、②中共转移3.2 mol e-
[答案]D
3. 用双线桥表示下列氧化还原反应,标出反应前后化合价升降情况和被氧化、被还原情况及电子转移的方向和数目
(1)MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑还原剂还原产物。
(2)2K+2H2O=2KOH+H2↑氧化剂,氧化产物。
[答案](1)还原剂是HCl;还原产物是MnCl2;
失去2e-,化合价升高,被氧化
MnO2+4HCl(浓) === MnCl2+2H2O+Cl2↑
得到2e-,化合价降低,被还原
(2)氧化剂是H2O;氧化产物是KOH ; 2K +2H2O=
2KOH+H2↑
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
4` 已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、
FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是(
)
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.2Fe3++2I—=
2Fe2++I2
[解题思路]反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。故要发生反应,必须是反应物的氧化性强于氧化产物的氧化性。
[解析]A中因I-的还原性强于Fe2+,Cl2应先氧化I-,只有当I-氧化完全后才会氧化Fe2+,故A不正确,B正确。C、D中的物质的氧化性顺序都符合题给要求,也是正确的。
[答案]A
5. 下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是()
A.F2、K、HCl
B.Cl2、Al、H2
C.NO2、Na、Br2
D.O2、SO2、H2O
[解析]A中F的化合价只能降低,单质F2只有氧化性,K的化合价只能升高,单质K只有还原性,HCl中H的化合价可以降低,而Cl的化合价可以升高,HCl既有氧化性,又有还原性;B中Cl2既有氧化性,又有还原性,H2只有还原性;C中NO2、Br2都既有氧化性,又有还原性;D中SO2既有氧化性,又有还原性。
[答案]A
1/ 已知
均有还原性,它们在酸性溶液中还原性的强弱顺序为
。则下列反应不能发生的是()