生物化学 蛋白质的二级结构
- 格式:ppt
- 大小:9.12 MB
- 文档页数:76


蛋白质一级结构二级结构三级结构四级结构解释【摘要】蛋白质是生物体内重要的大分子,负责许多生物学功能。
蛋白质的结构可分为四个级别:一级结构指的是氨基酸的简单线性排列,二级结构是氨基酸的局部区域形成α螺旋或β折叠,三级结构是整个蛋白质分子的空间构象,四级结构是多个蛋白质分子相互组装在一起形成的复合物。
蛋白质的结构决定了其功能,例如酶的特异性和亲和力。
蛋白质的结构与功能高度相关,对于研究蛋白质功能和疾病治疗有着重要意义。
蛋白质的结构从简单到复杂,具有多种不同层次的组织关系,这些不同级别的结构相互作用,共同决定了蛋白质的生物学功能。
【关键词】蛋白质,一级结构,二级结构,三级结构,四级结构,解释,总结1. 引言1.1 蛋白质概述蛋白质是生物体内功能性非常重要的大分子,它们参与了生物体内的几乎所有生物过程。
蛋白质是由氨基酸分子通过肽键连接而成的多肽链,具有多种结构和功能。
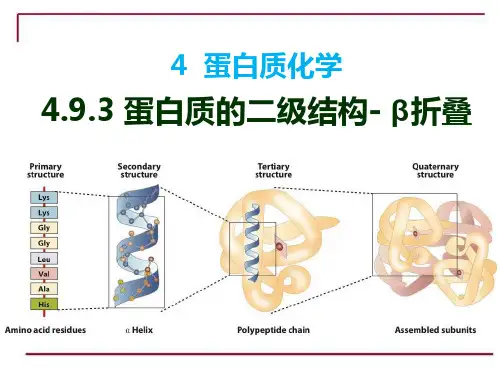
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质的氨基酸序列,即多肽链的线性排列方式。
二级结构是指多肽链中氨基酸的局部空间构象,包括α-螺旋和β-折叠等。
三级结构是指整个多肽链的立体空间结构,由各个二级结构元素的折叠方式决定。
四级结构则是由多个多肽链之间的相互排列和交互作用所形成的整体结构。
通过这四个层次的结构,蛋白质可以实现其特定的生物功能,如催化化学反应、传递信号等。
蛋白质的结构和功能密切相关,任何一个层次的结构改变都可能影响到其功能。
对蛋白质结构的深入理解对于揭示其功能机制具有重要意义。
2. 正文2.1 蛋白质一级结构蛋白质的一级结构指的是它的氨基酸序列。
氨基酸是组成蛋白质的基本单位,共有20种不同的氨基酸,它们通过肽键连接在一起形成多肽链。
蛋白质的氨基酸序列是由基因决定的,不同的基因编码不同的氨基酸序列,从而确定了蛋白质的结构和功能。
在蛋白质的一级结构中,氨基酸序列的特定顺序决定了蛋白质的二级结构。

蛋白质的结构层级蛋白质是生物体中最基本的大分子之一,它在维持生命活动中发挥着重要作用。
蛋白质的结构层级描述了蛋白质分子从原子级别到整体结构的组织和排列方式。
本文将从最基本的一级结构开始,逐层介绍蛋白质的结构层级。
一级结构:氨基酸序列蛋白质的一级结构是指由氨基酸组成的线性序列。
氨基酸是蛋白质的构建单元,共有20种不同的氨基酸。
它们以特定的顺序连接在一起,形成多肽链,通过脱水缩合反应形成肽键。
不同的氨基酸序列决定了蛋白质的功能和特性。
二级结构:α-螺旋和β-折叠蛋白质的二级结构是指多肽链中氨基酸的局部排列方式。
其中最常见的二级结构包括α-螺旋和β-折叠。
α-螺旋是一种螺旋状的结构,多肽链围绕中心轴形成螺旋,每转一圈约有 3.6个氨基酸残基。
β-折叠是由多个β-折叠片段相互连接而成,形成一种折叠的结构。
α-螺旋和β-折叠是由氢键和内部相互作用力稳定的。
三级结构:立体构型蛋白质的三级结构是指整个多肽链的立体构型。
它是由一级结构中相邻氨基酸残基之间的相互作用力和二级结构之间的相互作用力所决定的。
蛋白质的三级结构可以是球状、螺旋状或片状等不同的立体构型。
这种立体构型的形成主要依赖于静电相互作用、氢键、疏水效应和范德华力等力的作用。
四级结构:多个多肽链的组装一些蛋白质由多个多肽链组装而成,这种组装形成了蛋白质的四级结构。
四级结构的形成是通过多个多肽链之间的非共价相互作用力,如离子键、氢键和范德华力等稳定的。
四级结构可以使蛋白质形成复杂的功能结构,例如酶和抗体等。
蛋白质的结构层级是相互关联、相互作用的。
一级结构决定了二级结构的形成,而二级结构决定了三级结构的形成,最终四级结构决定了蛋白质的整体功能和特性。
蛋白质的结构层级对于理解蛋白质的功能和性质具有重要意义。
总结:蛋白质的结构层级包括一级结构、二级结构、三级结构和四级结构。
一级结构是指氨基酸的线性序列,二级结构是指氨基酸的局部排列方式,三级结构是指整个多肽链的立体构型,四级结构是指多个多肽链的组装。

蛋白质的一二三四级结构名词解释生物化学引言蛋白质是生物体中重要的基础分子,参与了几乎所有生命活动的调控和实现。
蛋白质的结构决定了其功能和性质,在生物化学中,蛋白质的结构可分为一级、二级、三级和四级结构。
本文将对这四个层次的蛋白质结构进行详细解释。
一级结构蛋白质的一级结构是指由氨基酸残基组成的线性多肽链序列。
每个氨基酸残基通过肽键连接,形成多肽链。
在一级结构中,通过不同的氨基酸残基的排列顺序,蛋白质可以具有不同的序列,从而决定了蛋白质的独特性质和功能。
氨基酸的种类和排列顺序决定了蛋白质的信息内容。
二级结构蛋白质的二级结构是由蛋白质中氨基酸间的氢键作用而形成的局部空间结构。
常见的二级结构有α-螺旋和β-折叠。
α-螺旋是由多肽链在一定的角度下形成螺旋状的结构,而β-折叠是由多肽链形成平行或反平行的β片层结构。
这两种二级结构形式不同,给蛋白质带来了不同的物理和化学性质,从而影响了蛋白质的功能。
三级结构蛋白质的三级结构是指蛋白质中氨基酸残基间的相对空间排列。
这种排列是由蛋白质中的各种化学键(如氢键、离子键、疏水作用等)以及局部和全局的构象约束所决定的。
三级结构的形成使蛋白质获得了空间结构上的稳定性和独特的形状。
不同的氨基酸残基相互作用形成了螺旋、折叠和环等形状,进而塑造了蛋白质的功能。
四级结构蛋白质的四级结构是由多个多肽链和其他非氨基酸成分(如金属离子、辅基、配体等)相互作用而形成的复合物。
这种相互作用使多个多肽链形成互相配对或组装的结构,从而形成一个功能完整的蛋白质分子。
四级结构的形成不仅受到一二三级结构的影响,还可能受到环境因素的调控。
结论蛋白质的一级、二级、三级和四级结构相互作用,共同决定了蛋白质的功能和性质。
一级结构是蛋白质的线性多肽链序列,二级结构是形成的局部空间结构,三级结构是氨基酸残基间的相对空间排列,四级结构是多个多肽链和其他非氨基酸成分的复合物。
深入理解和研究蛋白质的一二三四级结构,对于揭示生命活动的分子机制、疾病发生机理以及药物设计等领域具有重要的意义。
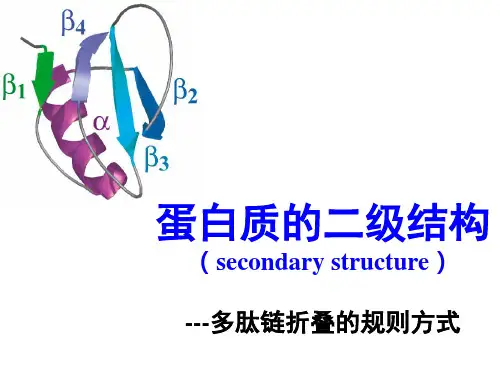



蛋白质是生物体内构成细胞结构和参与生物代谢的重要物质,它在生命体内起着至关重要的作用。
而蛋白质的结构形式多种多样,其中二级结构和超二级结构是构成蛋白质的基本组成部分,对蛋白质的功能和性质具有重要影响。
一、蛋白质的二级结构蛋白质的二级结构是指不同氨基酸残基之间的空间排布和相互作用形成的结构。
常见的二级结构包括α螺旋、β折叠和无规卷曲。
其中,α螺旋是最常见的二级结构之一,其特点是氢键的形成使得氨基酸残基呈螺旋状排列,这种结构不仅稳定,而且在细胞膜上起着支撑和通道的作用。
而β折叠则是由氢键结合使得氨基酸残基形成平行或反平行的折叠排列,这种结构通常存在于蛋白质的折叠区域,提高了蛋白质的稳定性和功能性。
蛋白质的二级结构还包括一些无规卷曲的区域,这些区域不具有特定的空间排布,但在蛋白质的功能中起着重要的作用。
二、蛋白质的超二级结构蛋白质的超二级结构是指由多个二级结构相互作用和组合而成的更大的结构。
常见的超二级结构包括β转角、螺旋转角、结节螺旋和逆转角等。
其中,β转角是由两种β折叠区域之间的连接形成的结构,这种结构常见于蛋白质的连接区域,具有重要的功能。
螺旋转角是由α螺旋区域与β折叠区域之间的连接形成的结构,这种结构在蛋白质的功能和稳定性中发挥着关键作用。
结节螺旋和逆转角也是蛋白质中常见的超二级结构,它们在蛋白质的空间排布和功能性中具有重要的作用。
在总体上来看,蛋白质的二级结构和超二级结构是构成蛋白质的基本组成部分,它们对蛋白质的功能和性质有着重要的影响。
深入地了解和掌握蛋白质的二级结构和超二级结构对于深入研究蛋白质的功能和应用具有重要的意义。
个人观点和理解:蛋白质的二级结构和超二级结构是构成蛋白质的基本组成部分,它们对蛋白质的功能和性质具有重要的影响。
而对于生命科学和生物化学领域的研究者来说,深入地了解和掌握蛋白质的二级结构和超二级结构对于揭示生物体内的生命活动过程和疾病机制具有重要的意义。
我认为蛋白质的二级结构和超二级结构是一个非常值得深入探讨的话题,也是一个具有广泛应用前景的研究领域。

蛋白质常见的二级结构-概述说明以及解释1.引言1.1 概述蛋白质是生物体内最重要的有机大分子之一,它们是构成细胞的基本组成部分,并在体内执行各种重要的生物学功能。
为了实现这些功能,蛋白质需要具备特定的空间结构。
蛋白质的结构可以分为四个级别,即一级、二级、三级和四级结构。
其中,二级结构是指蛋白质链上局部区域内氢键的形成导致的局部结构,常见的二级结构包括α-螺旋、β-折叠和β-转角。
α-螺旋是最常见的蛋白质二级结构之一。
在α-螺旋中,多肽链以螺旋形式延伸,其中每个氨基酸残基占据螺旋的一个角度位置。
螺旋的形成主要依赖于氢键的作用,其中螺旋中的氢键使得多肽链呈螺旋形状稳定存在。
α-螺旋的结构紧密,稳定性较高,常见于蛋白质中的内部区域,起到支撑和稳定蛋白质结构的作用。
β-折叠是另一种常见的蛋白质二级结构。
在β-折叠中,多肽链以折叠的形式延伸,形成多个折叠片段。
相邻折叠片段之间通过氢键连接,使得整个结构稳定存在。
β-折叠的结构松散,常见于蛋白质的表面区域,具有较高的灵活性。
β-折叠可以形成平行或反平行的排列方式,其中平行排列中折叠片段的N-末端和C-末端位于同一侧,而反平行排列则位于相对侧面。
β-转角是连接α-螺旋和β-折叠的区域,通常由3个残基组成。
β-转角的结构较为灵活,可以使蛋白质具有更多的构象自由度。
它在蛋白质中起到链接不同区域的作用,使得蛋白质形成完整的三维结构。
总而言之,蛋白质的二级结构对于其空间结构和功能具有重要影响。
通过对蛋白质二级结构的进一步研究,我们可以更好地理解蛋白质的结构与功能之间的关系,为药物设计和生物技术的发展提供基础。
在接下来的章节中,我们将详细介绍常见的蛋白质二级结构及其特点。
1.2 文章结构文章结构部分介绍了整篇文章的组织和安排。
本文将按照以下结构进行展开:第一部分为引言。
在引言中,对蛋白质的二级结构进行概述,包括其重要性和研究意义。
同时,引言还介绍了本文的结构和目的。
第二部分是正文。

蛋白质二级结构的稳定性研究作为生命体中最重要的物质之一,蛋白质的结构和功能一直以来都是生物化学和生物学领域的研究热点。
其中,蛋白质二级结构的稳定性研究,是了解蛋白质折叠和功能实现机理的重要途径之一。
本文将从多个方面深入探讨蛋白质二级结构的稳定性研究。
一、蛋白质二级结构的基本特征蛋白质的三级结构包括了其二级结构、三级结构和四级结构。
其中,蛋白质的二级结构是由氢键和范德华力等化学键相互作用而形成的。
蛋白质二级结构主要包括α-螺旋和β-折叠。
其中,α-螺旋是由多个氢键相互作用而形成的螺旋状结构;β-折叠则是由蛋白质链的两个或多个区域互相折叠而形成的片状结构。
在生物体内,蛋白质的二级结构基本保持稳定,具有重要的功能和生物学意义。
二、蛋白质二级结构的稳定性影响因素1. 氨基酸序列蛋白质的氨基酸序列是其折叠过程和结构稳定性的关键。
一些氨基酸在特定环境下可能会发生构象变化,影响相邻氨基酸的共价键形成和二级结构的形成。
此外,氨基酸的极性、电荷和侧链大小等特性也会对二级结构稳定性产生影响。
2. 环境条件环境条件对蛋白质二级结构的影响主要体现在温度、pH值、溶液浓度和离子强度等方面。
在不同的环境条件下,蛋白质的螺旋和片状结构的比例会发生改变,从而影响结构的稳定性和功能。
3. 蛋白质相互作用在生物体内,蛋白质之间通过各种相互作用相互配合,形成复杂的功能网络。
蛋白质之间的相互作用会导致蛋白质结构的改变,从而影响其稳定性和功能。
三、蛋白质二级结构稳定性的评估方法评估蛋白质二级结构稳定性的方法主要包括圆二色谱、NMR和X射线晶体结构学等。
其中,圆二色谱可以通过测量蛋白质分子的旋光性来评估蛋白质的二级结构稳定性。
NMR技术可以通过对蛋白质的核磁共振信号进行分析,得出蛋白质的三维结构和分子间相互作用信息。
X射线晶体结构学则可以直接观测蛋白质分子的原子三维空间排列,获得高分辨率的结构信息。
四、蛋白质二级结构的稳定性与功能的关系蛋白质的折叠形态是其功能的基础。
肽键:一个氨基酸的a-羧基与另一个氨基酸的a-氨基缩合脱去一份子水形成的化学键叫肽键。
蛋白质的一级结构:蛋白质肽链中氨基酸的排列顺序称为蛋白质的一级结构。
蛋白质的二级结构:多肽链主链的局部空间结构即主链构象,称为蛋白质的二级结构。
蛋白质的三级结构:指蛋白质分子中的各个二级结构的空间位置以及与氨基酸侧链基团之间的相对空间位置关系,也即多肽链的整体构象。
蛋白质的四级结构:许多蛋白质分子是由两条或两条以上具有独立三级结构的多肽链组成。
这些多肽链之间借次级键缔合在一起,蛋白质分子的这种结构形式称为蛋白质分子的四级结构。
蛋白质别构效应:凡蛋白质(或亚基)因与某小分子物质相互作用而发生构想变化,导致蛋白质(或亚基)功能变化,称为蛋白质别构效应。
分子病:犹豫遗传物质DNA突变而导致某蛋白质一级结构变化所引起的疾病称为分子病。
蛋白质的等电点:当蛋白质溶液处于某一PH值时,蛋白质分子解离成正负离子的趋势相等成为兼性离子,此时,该溶液的PH值称为该蛋白质的等电点(PI)。
蛋白质变性:在某些理化因素作用下,使蛋白质严格的空间结构收到破坏但不包括肽键的断裂,从而引起蛋白质理化性质改变,生物学活性丧失,称为蛋白质的变性。
蛋白质组:蛋白质组是指一种细胞或一种生物锁表达的全部蛋白质,即“一种基因组所表达的全套蛋白质”。
增色效应:增色效应是指与天然DNA相比,变性DNA因其双螺旋破坏,使碱基充分外露,因此紫外吸收增加。
减色效应:减色效应是指变性DNA复性形成双螺旋结构后,其紫外吸收会降低。
分子杂交:两条来源不同但有碱基互补关系的DNA单链分子,或DNA单链分子与RNA分子,在去掉变性条件后互补的区域能够退火复性形成双链DNA分子或DNA/RNA异质双链分子,这一过程叫分子杂交。
Tm:DNA解链曲线的重点,即DNA变性达50%时的温度。
核小体:是染色质的基本组成单位,有DNA和5种组蛋白共同构成。
非mRNA小RNA:细胞的不同部位存在的许多其他种类的小分子RNA,统称为非mRN小RNA(small non-messenger RNAs,snmRNAs)。
生物化学中的蛋白质结构及其功能在生命体内,蛋白质是一类非常重要的有机化合物,它们在生命的各个方面都起到着重要的作用,如酶催化、信号传导、运输、结构维持等等。
蛋白质的结构决定了它们的活性和功能,因此,研究蛋白质结构及其功能具有极其重要的意义。
下面我们将从蛋白质的结构、折叠、构象以及功能几个方面进行详细介绍。
1. 蛋白质的结构蛋白质是由氨基酸通过肽键相连而构成的长链分子,在生命体内通常以特定的三维结构存在。
蛋白质的结构主要可以划分为四级结构:一级结构(原始序列)、二级结构(α螺旋、β折叠)、三级结构(多肽折叠)、四级结构(复合物)。
其中,α螺旋和β折叠是最为普遍的二级结构,它们通过氢键将氨基酸残基组织成一定的空间结构。
α螺旋是一种螺旋状结构,由一个有规则的氢键网捆绑而成。
每个氨基酸残基的羧基带有负电荷,而氨基带有正电荷,两者之间可以形成氢键。
α螺旋的骨架围绕着中央的轴线旋转,使得氢键网保持恒定不变。
β折叠则是由两个或多个β片层组成的,β片层中的所有残基都有着相同的空间构象,每层之间的残基则沿水平方向连接。
β折叠的氢键也是通过氨基酸残基上的羧基和氨基之间的相互作用而形成。
除了α螺旋和β折叠外,还有很多种不同类型的二级结构。
例如左旋螺旋、β卷曲、转角、半胱氨酸桥等等。
不同的二级结构通过不同类型的氢键和范德华力相互作用,最终将蛋白质的一级结构巧妙地折叠为复杂的三维空间结构。
2. 蛋白质折叠蛋白质折叠是指蛋白质在生命体内构成其三维空间结构的过程。
蛋白质的折叠过程对于维持其生物学功能至关重要。
寻找如何预测蛋白质的折叠是生物学和计算科学领域的一个重要难题。
蛋白质折叠的过程可以理解为一种多维贝叶斯优化,即在构象空间中寻找最稳定的结构。
在蛋白质折叠过程中,许多因素会影响蛋白质的构象,如环境条件、其它蛋白质的作用、化学结构中氢键和疏水效应等等。
因此,蛋白质折叠是一个带有很高复杂性的生物过程,其具体机制目前还没有完全揭示清楚。
蛋白质二级结构类型及特征
蛋白质的二级结构是指蛋白质中多肽链局部区域的空间构象,主要由α-螺旋、β-折叠和无规卷曲三种类型组成。
首先,让我们来谈谈α-螺旋结构。
α-螺旋结构是蛋白质中最常见的二级结构类型之一。
在α-螺旋结构中,多肽链以螺旋形式紧密卷曲,螺旋之间由氢键连接。
这种结构稳定,通常由氨基酸的主链形成,侧链朝向螺旋外部。
α-螺旋结构具有一定的刚性和稳定性,这使得它在蛋白质结构中起着重要作用。
其次,我们来看β-折叠结构。
β-折叠结构是由多肽链中相邻的β-氨基酸残基形成的平行或反平行的β-链。
这些β-链通过氢键相互连接,形成一个平面的结构。
β-折叠结构通常比较柔软,同时也具有一定的稳定性。
在蛋白质中,β-折叠结构常常与α-螺旋结构相互作用,共同构成蛋白质的空间结构。
最后,我们来讨论无规卷曲结构。
无规卷曲结构是指蛋白质中没有明显规律的结构,主要由氨基酸的侧链构象决定。
这种结构通常出现在蛋白质的连接区域或者某些特定的功能区域,起着连接不同二级结构域的作用。
总的来说,蛋白质的二级结构类型各具特点,α-螺旋结构具有较高的稳定性和刚性,β-折叠结构具有柔软性和稳定性,而无规卷曲结构则起着连接和调节的作用。
这些不同类型的二级结构相互作用,共同构成了蛋白质的复杂空间结构,决定了蛋白质的功能和性质。