第五章物质结构元素周期律知识点讲解
- 格式:doc
- 大小:181.00 KB
- 文档页数:7
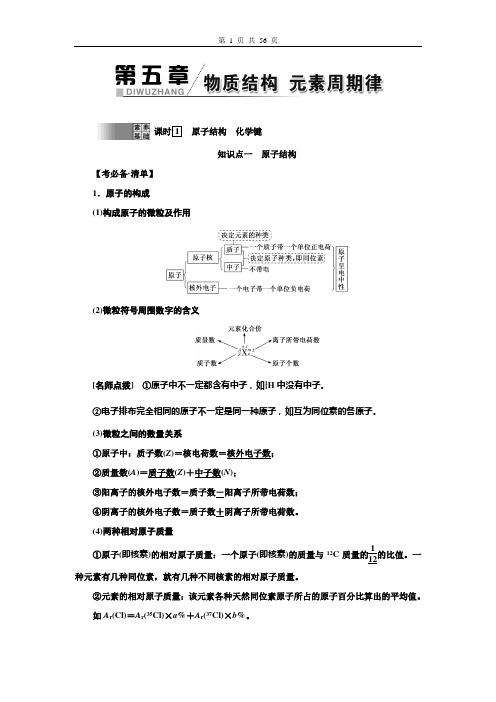
课时1原子结构化学键知识点一原子结构【考必备·清单】1.原子的构成(1)构成原子的微粒及作用(2)微粒符号周围数字的含义[名师点拨]①原子中不一定都含有中子,如11H中没有中子。
②电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子。
(3)微粒之间的数量关系①原子中:质子数(Z)=核电荷数=核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-阳离子所带电荷数;④阴离子的核外电子数=质子数+阴离子所带电荷数。
(4)两种相对原子质量①原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的112的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
②元素的相对原子质量:该元素各种天然同位素原子所占的原子百分比算出的平均值。
如A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
2.元素、核素、同位素(1)元素、核素、同位素的关系(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素的各核素所占的原子百分数一般不变。
[名师点拨]①由于同位素的存在,核素的种数远大于元素的种类。
②不同核素可能具有相同的质子数,如21H和31H;也可能具有相同的中子数,如146C和168O;也可能具有相同的质量数,如146C和147N。
(3)常见的重要核素及其应用核素235 92U 14 6C 21H(D) 31H(T) 18 8O用途核燃料用于考古断代制氢弹示踪原子【夯基础·小题】1.在当前空气污染日益严重,人们的健康受到来自空气威胁的情况下,“空气罐头”应运而生。
16O和18O是氧元素的两种核素,下列说法正确的是()A.16O2与18O2互为同素异形体B.16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.16O与18O互为同位素解析:选D同素异形体是指同一元素形成的结构不同的单质,A错误;16O和18O质子数相同,核外电子数相同,所以两者的核外电子排布方式相同,但两种核素的中子数不同,则16O和18O互为同位素,B错误;D正确;16O 和18O都是氧原子,而化学变化中的最小微粒是原子,所以化学变化不能实现16O与18O间的转化,C错误。

专题05 物质结构元素周期律考点热度★★★★★【化学素养要求】【考纲导向】1.了解元素、核素和同位素的含义。
2.依据原子构成了解原子序数、核电核数、质子数、核外电子数的彼此关系和质子数、中子数、质量数之间的相互关系。
3.了解原子核外电子排布。
4.了解元素周期表的结构。
5.通过同周期、同主族元素性质的递变规律与原子结构的关系,理解元素周期律的实质。
6.通过金属、非金属在元素周期表中的位置及其性质递变规律,理解位、构、性三者之间的关系。
7.通过离子键、共价键的形成过程认识化学键。
【命题分析】对原子结构、化学键的考查主要集中在各微粒数量间的关系,微粒的结构示意图、电子式的表示方法及化学键、化合物类型的判断等方面上,试题难度不大,一般属于了解层次。
元素周期表和元素周期律这一部分内容主要以元素周期表为工具考查“位、构、性”三者的关系,该部分内容既能对原子结构、元素周期表和元素周期律进行单独考查,同时也能将元素及其化合物联系起来进行综合考查,试题的综合度较高,命题的空间大。
题型以选择题为主,难度适中。
该部分内容是过去命题的热点,未来将是一个必考点。
题型依然会以选择题为主,难度变化不大。
核心考点一微粒结构与化学键1.抓住描述对象判断“四同”(1)同位素——原子,如11H、21H、31H。
(2)同素异形体——单质,如O2、O3。
(3)同系物——有机化合物,如CH3CH3、CH3CH2CH3。
(4)同分异构体——有机化合物,如正戊烷、新戊烷。
2.原子结构中易混淆的4个问题(1)同种元素,可以有若干种不同的核素,即核素种类远大于元素种类。
(2)元素有多少种核素,就有多少种原子。
(3)同位素是同一元素不同原子的互相称谓,不指具体原子。
(4)同一元素的不同同位素原子其质量数不同,核外电子层结构相同,其原子、单质及其构成的化合物的化学性质几乎完全相同,只是某些物理性质略有差异。
3.理清化学键与物质类别的关系(1)从图中可以看出,离子化合物一定含有离子键,离子键只能存在于离子化合物中。


一、原子的组成1.原子的组成第一章物质结构元素周期律质子(Z个)——决定元素种类原子核——决定同位素种类中子 (A-Z) 个原子(Z A X)核外电子 (Z 个 )——最外层电子数决定元素的化学性质2.微粒间数目关系质子数( Z)= 核电荷数= 原子数序=原子的核外电子数原子序数:按质子数由小大到的次序给元素排序,所得序号为元素的原子序数。
质量数( A)= 质子数( Z)+ 中子数( N)中性原子:质子数= 核外电子数阳离子:质子数 = 核外电子数+所带电荷数阴离子:质子数 = 核外电子数-所带电荷数A ±bc±3.原子表达式及其含义Z X dA表示 X 原子的质量数; Z 表示元素 X 的质子数;d表示微粒中 X 原子的个数; c±表示微粒所带的电荷数;±b 表示微粒中 X 元素的化合价。
二、原子及原子团1.原子:是化学变化中的最小微粒。
在化学反响中,核外电子数可变,但原子核不变。
2.原子团:两个或两个以上原子结成的企业,作为一个整体参加化学反响。
它能够是中性的基(如— CH3),也能够是带正电的阳离子(如 NH+4)或带负电的阴离子(如 NO-3)。
三、原子核外电子运动的特点(1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能够同时正确地测定电子在某一时刻所处的地址和运动的速度,也不能够描绘出它的运动轨迹.在描绘核外电子的运动时,只能指出它在原子核外空间某处出现机遇的多少.(2)描绘电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表示了电子在核外空间单位体积内出现几率的多少.(3)在平时情况下,氢原子的电子云呈球形对称。
在离核越近的地方电子云密度越大,离核越远的地方电子云密度越小.四、原子核外电子的排布规律(1)在多电子原子里,电子是分层排布的.电子层数( n)1234567表示符号K L M N O P Q各周期元素2 8 8 18 18 32 26实质数目离核远近能量n 值越大,电子离原子核越远,电子拥有的能量越高高低(2)能量最低原理:电子总是尽先排布在能量最低的电子层里,而只有当能量最低的电子层排满后,才依次进入能量较高的电子层中.因此,电子在排布时的次序为:K→L→M(3)各电子层容纳电子数规律:①每个电子层最多容纳2n2个电子 (n= 1、 2).②最外层容纳的电子数≤ 8 个(K 层为最外层时≤ 2 个),次外层容纳的电子数≤ 18 个,倒数第三层容纳的电子数≤32 个.比方:当 M 层不是最外层时,最多排布的电子数为 2× 32=18 个;而当它是最外层时,则最多只能排布 8 个电子.(4)原子最外层中有8 个电子 (最外层为 K 层时有 2 个电子 )的结构是牢固的,这个规律叫“八隅律”.但如 PCl5中的 P 原子、BeCl2中的 Be 原子、XeF4中的 Xe 原子,等等,均不满足“八隅律” ,但这些分子也是牢固的.五.元素周期律和元素周期表:俄国化学家门捷列夫(一)元素周期律:元素的性质随着原子序数的递加而呈周期性变化,这个规律叫做元素周期律.1、[原子序数 ]按核电荷数由小到大的次序给元素编的序号,叫做该元素的原子序数.原子序数=核电荷数=质子数=原子的核外电子数2、[元素原子的最外层电子排布、原子半径和元素化合价的变化规律 ] 关于电子层数相同(同周期)的元素,随着原子序数的递加:(1)最外层电子数从 1 个递加至 8 个(K 层为最外层时,从 1 个递加至 2 个)而表现周期性变化.(2)元素原子半径从大至小而表现周期性变化 ( 注:稀有气体元素的原子半径因测定的依照不相同,而在该周期中是最大的 ).(3)元素的化合价正价从 +1 价递加至 +5 价(或+7 价),负价从- 4 价递加至- 1 价再至 0 价而呈周期性变化.3、[三素 ] 的比较(1)元素:拥有相同的核电荷数(即质子数)的同类原子的总称核电荷数决定元素种类(2)核素:拥有必然数目的质子和必然数目的中子的一种原子,叫做一种核素.也就是说,每一种原子即为一种核素,如11 H、21 H、126 C、136 C 等各称为一种核素.(核素是一种详尽原子的另一称呼)( 3)同位素:拥有相同质子数和不相同中子数的同种元素的原子,互称同位素。

第五章物质结构和元素周期律第一节原子结构1.原子核(1)质子数:指原子核内质子的个数,决定元素的种类。
质子数==__________==__________ (2)中子数:指原子核内中子的个数,与质子数一起决定某元素同位素的种类。
(3)质量数:质量数(A)==_________(___)+_______(___)__________(4)原子组成__________原子(A Z X)_________2.原子核外电子的运动特点(1)电子运动的特点是:质量很小,带负电荷;运动的空间范围小;运动的速率很快(2) 电子云:电子在核外空间一定范围内出现,好像带负电荷的云雾笼罩在原子核周围,形象的称之为电子云。
电子云中的每一个小黑点____(不代表, 代表)一个电子,只是表示电子曾经在此处出现过,而且小黑点的_____可以表示电子出现的概率的_________。
3.原子核外电子的排布(1)在含有多个电子的原子里,核外电子是分层排布的。
(2)电子层:根据电子具有的能量的高低,即离核远近,把电子在核外的排布分成不同的电子层。
电子层数一二三四五六七电子层符号K L M N O P Q电子离核远近近远电子能量高低低高(3)核外电子排布规律1)核外电子总是尽先排布在能量_____(较低,较高)的电子层,然后由内向外,依次排布在能量逐渐升高的电子层里(K→L→M)层,即______________原理。
2)各电子层最多容纳的电子数目是____个。
即:K层最多容纳___个电子,L为___个,M为___个,N层为__个,O层为___个,P层为___个,Q层为___个。
3)最外层电子数目不能超过___个(K层为最外层时不超过两个),次外层电子数目不超过____个,倒数第三层电子数目不超过____个。
以上规律相互联系,相互牵制,不能孤立,片面理解。
如: 画出Br、及K的原子结构示意图_______________(4)原子结构示意图和离子结构示意图1)原子结构示意图:核电荷数____(=,<,>)核外电子数。

高一必修1化学第五章重要知识点:元素周期律元素周期律指元素的性质随元素的原子序数(即核电荷数或核外电子数)的增加而呈现周期性变化的规律。
以下是查字典化学网为大家整理的高一必修1化学第五章重要知识点,希望可以解决您所遇到的相关问题,加油,查字典化学网一直陪伴您。
热点一物质结构元素周期律【必备知识规律总结】一、原子结构1.几个量的关系(X)质量数(A)=质子数(Z)+中子数(N)质子数=核电荷数=原子序数=原子的核外电子数离子电荷数=质子数-核外电子数2.同位素(1)要点:同质子数相同,异中子数不同,微粒原子。
(2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
3.核外电子排布规律(1).核外电子是由里向外,分层排布的。
(2).各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
(3).以上几点互相联系。
4.微粒半径大小比较规律(1).同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2).同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
(3).电子层结构相同的离子,核电荷数越大,则离子半径越小。
(4).同种元素的微粒半径:阳离子原子阴离子。
(5).稀有气体元素的原子半径大于同周期元素原子半径.二、元素周期律和周期表1.几个量的关系周期数=电子层数主族序数=最外层电子数=最高正价数|最高正价|+|负价|=82.周期表中部分规律总结(1).最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
(2).在周期表中,第ⅡA与ⅢA族元素的原子序数差分别有以下三种情况:①第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3).同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA~ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
第23讲原子结构核外电子排布[课程标准] 1.了解元素、核素和同位素的含义。
2.了解原子序数、核电荷数、质子数、中子数、核外电子数,以及它们之间的关系。
3.了解核外电子排布规律,驾驭原子结构示意图。
考点一原子结构与核素、同位素1.原子结构(1)构成原子的微粒原子(AZ X)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(Z个)——确定元素的种类中子[(A-Z )个]在质子数确定后确定核素种类同位素核外电子(Z 个)——最外层电子数确定元素的化学性质(2)微粒之间的数量关系①原子中:质子数(Z)=核电荷数=核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-电荷数;④阴离子的核外电子数=质子数+电荷数。
(3)符号ba X+cd+e中各数字的含义2.元素、核素、同位素(1)元素、核素、同位素的关系(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②自然存在的同一元素各核素所占的原子百分数一般不变。
(3)氢元素的三种核素11 H :名称为氕,不含中子;21 H :用字母D 表示,名称为氘或重氢; 31H :用字母T 表示,名称为氚或超重氢。
(4)几种重要核素的用途 核素 235 92U14 6C21H31H18 8O用途核燃料 用于考古断代 制氢弹 示踪原子3.两种相对原子质量(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C 质量的1/12的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
(2)元素的相对原子质量:是按该元素各种自然同位素原子所占的原子百分比算出的平均值。
如:A r (Cl)=A r (35Cl )×a %+A r (37Cl )×b %。
[正误辨析](1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同( ) (3)核聚变如21 H +31 H ―→42 He +10 n ,因为有新微粒生成,所以该变更是化学变更( ) (4)中子数不同而质子数相同的微粒确定互为同位素( ) 学生用书第109页(5)通过化学变更可以实现16O 与18O 间的相互转化( ) (6)3517 Cl 与3717 Cl 得电子实力几乎相同( )答案: (1)√ (2)√ (3)× (4)× (5)× (6)√一、元素、核素、同位素概念辨析1.现有下列9种微粒:11 H 、21 H 、136C 、146C 、147N 、5626 Fe 2+、5626Fe 3+、16 8O 2、168O 3。
第五章物质结构元素周期律第一课时原子结构一、原子的构成1.原子的构成(2)元素符号周围各个数字的含义(3)组成原子的各种微粒及其相互关系①核电荷数(Z)=________________=_______________=________________ ②质量数(A)=_________+________③阳离子的核外电子数=质子数-所带电荷数④阴离子的核外电子数=质子数+所带电荷数2.元素、核素、同位素注意:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。
3.相对原子质量(1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。
它是相对质量,单位为1,可忽略不写。
(2)元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。
元素周期表和相对原子质量表中的数值就是元素的相对原子质量,而非核素(或原子)的相对原子质量。
(3)目前已发现的110多种元素中,大多数都有同位素。
(4)一种天然存在的元素的各种核素分占的比例不一定相同,但所占的百分比不变。
【注意】同位素原子间的物理性质不同,但化学性质是相同的。
三、原子核外电子排布1.电子层的划分电子层数1234567符号K L M N O P Q离核距离近―→远能量高低低―→高(1)各电子层最多容纳的电子数是____ 个(n表示电子层)。
(2)最外层电子数不超过___个(K层是最外层时,最多不超过2个);次外层电子数不超过_____个;倒数第三层不超过32个。
(3)核外电子总是先排布在能量____的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布(即排满K层再排L层,排满L层再排M层)。
3.原子(或离子)结构示意图(1)原子:核电荷数=核外电子数,如Si的原子结构示意图:____(2)阳离子:核电荷数>核外电子数,如Na+的结构示意图:_______ (3)阴离子:核电荷数<核外电子数,如Cl-的结构示意图:_______方法规律技巧1.元素相对原子质量、近似相对原子质量、同位素相对原子质量①如:氯元素的同位素35Cl37Cl 质量数35 37 同位素相对原子质量34.699 36.966原子百分组成75.77% 24.23%氯元素相对原子质量34.699×75.77%+36.966×24.23%=35.45 近似相对原子质量35×75.77%+37×23.23%=35.5②同位素相对原子质量:是国际上统一的用某种元素的某种同位素原子的绝对质量与12C原子绝对质量的112比较而得的比值。
例1:下列叙述错误..的是( ) A.13C 和14C 属于同一种元素,它们互为同位素B. 1H 和2H 是不同的核素,它们的质子数相等C. 14C 和14N 的质量数相等,它们的中子数不等D. 6Li 和7Li 的电子数相等,中子数也相等解析:解决这类问题的关键是知道质量数等于质子数中子数之和,质子数决定元素种类,质子数与中子数决定核素种类。
答案:D【变式训练1】U 23592是重要的核工业原料,在自然界的丰度很低。
U 23592的浓缩一直为国际社会关注。
下列有关U 23592说法正确的是 ( )A.U 23592原子核中含有92个中子 B.U 23592原子核外有143个电子C.U 23592与U 23892互为同位素 D.U 23592与U 23892互为同素异形体【变式训练2】32S 与33S 互为同位素,下列说法正确的是 ( )A.32S 与33S 原子的最外层电子数均为2B.32S 与33S 具有相同的中子数C.32S 与33S 具有不同的电子数D.32S 与33S 具有相同的质子数C 、D例2:从某微粒的原子结构示意图反映出 ( )A.质子数和中子数B.中子数和电子数C.核电荷数和各电子层排布的电子数D.质量数和各电子层排布的电子数解析:微粒的原子结构示意图可表示出核电荷数和核外电子的分层排布情况,但不能表示其中子数。
由于核电荷数=核内质子数=原子的核外电子数,质量数=质子数+中子数。
这两个公式具有很广泛的应用,故选项A 、B 、D 都不正确答案:C【变式训练4】-n b X 和+m a Y 两离子的电子层结构相同,则a 等于 ( )A .b-m-nB .b+m+nC .b-m+nD .m-n+b解析:两离子的电子层结构相同,意味着两离子核外电子层数相同,各层上的电子数也相同,因此核外电子总数必相同。
b+n=a-m 选B 。
例3:两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有A.1对B.2对C.3对D.4对解析:分析此题时首先要明确两元素不可能在同一周期,如在同一周期则是一种元素。
即只能是一种元素在第一周期,另一元素在第二周期。
所以两元素最外层电子数之比为1∶2。
第一周期的元素的最外层电子数是1或2,则另一元素的最外层电子数为2或4。
选B【变式训练5】下列各组给定原子序数的元素,不能..形成原子数之比为1:1稳定化合物的是 A .3 和 17B .1 和 8C .1 和 6D .7 和 12D例4 X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。
X、Y、Z三种元素原子序数的关系是A.X>Y>ZB.Y>X>ZC.Z>X>YD.Z>Y>X解析:根据原子序数和元素周期律推测原子和离子半径大小,这是正向思维。
而本题是已知原子和离子半径的大小,要判断原子序数大小的关系,这是逆向思维。
已知电子层结构相同的阳离子,核电荷数大的则半径小,具有相同的电子层数的原子,随着原子序数增大,原子半径递减。
根据题意,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z元素的原子序数大于Y元素。
由此得出三种元素原子序数的关系为Z>Y>X答案:D。
已知1-18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同的电子层结构,下列关系正确的是()A.质子数c>bB.离子的还原性Y2->Z-C.氢化物的稳定性H2Y>HZD.原子半径X<WB例5:周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者4倍的是()A.电子数 B.最外层电子数 C.电子层数 D.次外层电子数解析:本题比较全面的考查了原子核外电子的排布。
16号元素电子数为16、电子层数为3、最外层电子数为6、次外层电子数为8,4号元素电子数为4、电子层数为2、最外层电子数为2、次外层电子数为2,电子数和次外层电子数前者是后者的四倍。
答案:AD【变式训练7】(2008广东卷)下列有关原子结构和元素周期律的表述正确的是()①原子序数为15的元素的最高化合价为+3②ⅦA族元素是同周期中非金属性最强的元素③第二周期ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第三周期ⅡA族A.①②B.①③C.②④D.③④【变式训练8】若短周期中的两种元素可形成原子个数比为3:2的化合物,则这两种元素的原子序数之差不可能是()A. 1B. 3C. 5D. 6C D例6:同主族两种元素原子的核外电子数的差值可能为()A.6 B.12 C.26 D.30解析:根据周期表的结构可知:第1、2、3、4、5、6、7、……周期所包含的元素种类数依次为2、8、8、18、18、32、32……,同一主族的两种元素的原子序数相差等于2、8、8、18、18、32、32之某一个数或相邻几个数之和。
A、B项明显不对,对C项:26=8+18;而D项中的30不能用2、8、8、18、18、32、32相邻几个数组成。
答案:C【变式训练9】同主族两种元素原子序数的差值不可能为()A.16 B.26 C.36 D.46D例7:有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。
下列说法正确的是( )A.若X(OH)n为强碱,则Y(OH)n也一定为强碱B.若H n XO m为强酸,则X的氢化物溶于水一定显酸性C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2D.若Y的最高正价为+ m,则X的最高正价一定为+ m答案:A解析:抓住“规律”的共性和特殊性,是解决好此问题的关键【变式训练10】R、W、X、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m,n均为正整数)()A.若 R (OH)n为强碱,则W(OH)n+1也为强碱B.若HnXOm为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z得最高正化合价为+6D.若X的最高正化合价为+5,则五种元素都是非金属元素答案:B例8:2007年3月21日,我国公布了111号元素Rg的中文名称。
该元素名称及所在周期是( )A.钅仑第七周期B.镭第七周期C.铼第六周期D.氡第六周期解析:第六周期最后一种元素氡的原子序数是86,第七周期如果排满,最后一种元素的原子序数应该是118,根据元素周期表的结构可知111号元素,Rg应位于第七周期、第IB族,而镭是第七周期、第IIA族元素。
A例9:下列说法正确的是()A.IA族元素的金属性比IIA族元素的金属性强B.VIA族元素的氢化物中,稳定性最好的其沸点也最高C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强D.第三周期元素的离子半径从左到右逐渐减小解析:A项,不同周期时可能IA族元素的金属性比IIA族元素的金属性弱。
答案:B。
C项没有说明是否最高价氧化物D项同周期非金属阴离子半径比金属阳离子半径大例10:下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语....回答下列问题:(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO 2b.FeCl 3c.Na 2SO 3d.KMnO 4(5)由表中元素形成的常见物质X 、Y 、Z 、M 、N 可发生以下反应:X 溶液与Y 溶液反应的离子方程式为_____________________,N→⑥的单质的化学方程式为________________。
常温下,为使0.1 mol/L M 溶液中由M 电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y 溶液至_________________。
答案:解析:本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。
(1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。
(2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。
(3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。
(4)液态H 2O 2可以在MnO 2、FeCl 3等催化剂作用下发生分解反应。
(5)⑥为Al ,可推断Z 为Al(OH)3,受热分解可产物Al 2O 3,再电解即可得单质铝。
M 仅含非金属的盐,显然铵盐,所以X 与Y 应为AlCl 3与NH 3·H 2O 的反应,生成NH 4Cl 。
由于NH 4+ 水解,故要使其浓度与Cl -相等,则要补充NH 3·H 2O 。
由电荷守恒知:C (+4NH )+ C (H +) C (-Cl )+C (-OH ),若C (+4NH ) C (-Cl ),则C (H +)= C (-OH ),即pH=7。
【变式训练】已知①A 、B 、C 、D 四种物质均含元素X ,有的还可能含有元素Y 、Z 。
元素Y 、X 、Z 的原子序数依次递增。
② X 在A 、B 、C 、D 中都不呈现它的最高化合价。
③ 室温下单质A 与某种常见一元强碱溶液反应,可得到B 和C 。
④ 化合物D 受热催化分解,可制得元素Y 的单质。
(1)元素X 是 ,Z 是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式:答:(1)Cl K (或写氯、钾)(2)O H KClO KCl KOH Cl 222++=+(3)∆232MnO KClO ↑+232O KCl【变式训练】制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。
人们曾经采用过乙醚、NH 3、CH 3Cl 等作制冷剂,但它们不是有毒,就是易燃。
于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性:第二周期: > >H 2O>HF第三周期:SiH 4>PH 3> >(2)化合物的毒性:PH 3>NH 3;H 2S>H 2O ;CS 2 CO 2;CCl 4>CF 4,于是科学家们开始把注意力集中在含F 、Cl 的化合物上。