5.3 汽液平衡的计算(2)
- 格式:ppt
- 大小:1.26 MB
- 文档页数:63




《化工热力学》过程论文题目: 气液平衡的计算方法系别:化学材料与工程系班级:13级化工卓越班姓名:学号: 1303022014教师:日期:2016-1—12气液平衡的计算方法摘要本文综合分析了多组分相平衡理论特点,主要介绍了利用Peng Robinson ( PR)立方型状态方程进行氧、氮、氩系统气液平衡计算的方法(泡点、露点和闪蒸计算),对该计算方法的准确性进行分析和验证。
关键词立方型状态方程;气液平衡计算;泡点;露点;闪蒸目录1 前言 .................................................................................................................. - 3 -2 状态方程的选择 ........................................................................................... - 4 -3 混合规则 .................................................. - 5 -4 气液平衡的计算 ........................................................................................... - 6 -4.1 泡点计算[3] ............................................................................................ - 6 -4.2 露点计算[3]............................................ - 7 -4。
3 等温闪蒸的计算....................................... - 8 -5 结论 .................................................................................................................. - 8 -6 参考文献 ......................................................................................................... - 8 -1前言精馏计算是空分流程计算的关键环节,而气液平衡计算又是精馏计算中最基础的,其精确与否直接影响到流程计算的准确性。


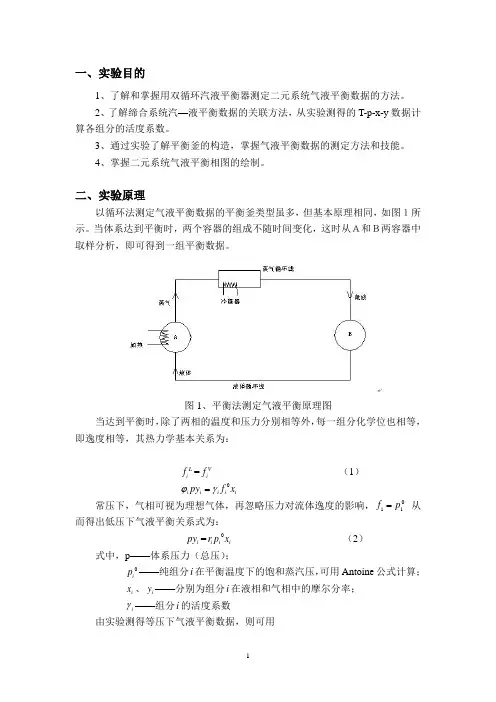
一、实验目的1、了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。
2、了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。
3、通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4、掌握二元系统气液平衡相图的绘制。
二、实验原理以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
图1、平衡法测定气液平衡原理图当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:L i f =V i f (1)0i i i i i py f x ϕγ=常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为:i py =0i i i r p x (2) 式中,p ——体系压力(总压);0i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; i x 、i y ——分别为组分i 在液相和气相中的摩尔分率; i γ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用i y =ii ipy x p (3) 计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为: ln γ1=-ln(x 1+Λ12x 2)+x 2(212112x x Λ+Λ -121221x x Λ+Λ) (4)ln γ2=-ln(x 2+Λ21x 1)+x 1(121221x x Λ+Λ -212112x x Λ+Λ) (5)Wilson 方程二元配偶函数Λ12和Λ21采用非线性最小二乘法,由二元气液平衡数据回归得到。
目标函数选为气相组成误差的平方和,即F =2221211((j mj j y y y y ))计实计实-+-∑= (6)三、实验装置和试剂1、实验的装置:平衡釜一台、阿贝折射仪一台、超级恒温槽一台、50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支、1ml 注射器4支、5ml 注射器1支。

第五章 气体吸收气体吸收操作的主要目的是分离气体混合物的组分。
气体吸收是气体溶解于液体的过程。
解吸操作中溶质气体的转移方向是自液相至气相。
吸收↔解吸对一定的气、液体系,温度升高,气体溶解度减小。
↓↑t p 有利于吸收↑↓t p 有利于解吸五、溶剂的选择p229吸收操作对吸收剂的要求是对欲吸收的溶质气体的溶解度大,选择性好,溶解度随温度改变的变化大,挥发度小,无毒,价廉易得。
5.2气液相平衡亨利定律稀溶液p *=Exp *=c/Hy *=mxm=E/P如总压1atm (绝压),20℃的空气与水长期接触,则水中O 2的摩尔分数x=5.24×10-6,E=4.01×104atm ,空气中O 2的摩尔分数y= 0.21如含有79%(体积)N 2的空气与水接触,温度为25℃,总压为100kP a ,查得亨利系数E =8.76×105kP a ,则液相中N 2的平衡浓度C *=5.01×10-4 kmol/m 3。
5.2.2 相平衡与吸收过程的关系(y -y *)以气相浓度差表示的吸收推动力;若相平衡常数为m ,塔内某截面的气液相含易溶组分的摩尔分数为y 及x ,当以y-y*表示总推动力,y*= mx 。
(x *-x )以液相浓度差表示的吸收推动力。
对塔内任一气液浓度分别为y,x 的截面,相际传质推动力为(x*-x),x*=y/m5.3 分子扩散费克定律T 、P 一定的一维定态:dZdC D J A AB A -= 对于二元物系,设A 为溶质气体,B 为惰气,二者摩尔浓度之和为常量,C A +C B =恒值,则分子扩散系数D AB 与D BA 的关系是D AB =D BA ,由费克定律算出A 与B 的分子扩散速率J A 与J B 。
二者关系是A J = BJ 。
非电解质稀溶液,液相分子扩散系数DAB 与绝对温度的1次方成正比对非电解质稀溶液,液相分子扩散系数D 与黏度μ的1次方成反比。

气液平衡条件(一)气液平衡条件什么是气液平衡条件?气液平衡条件指的是在一定温度和压力下,气体和液体之间达到平衡状态的条件。
这种平衡状态可以通过一系列维持压强、温度和组分的平衡条件来实现。
气液平衡条件的重要性了解和掌握气液平衡条件对于许多领域是至关重要的。
在化学工程、环境科学、石油工业等领域中,气液平衡条件的研究可以用于设计和优化各种过程和设备。
例如,石油工业中的油气分离过程、化学工程中的溶剂提取和吸附分离等。
气液平衡条件的主要要素要实现气液平衡,需要满足以下主要要素:•温度:气液两相之间的温度要一致,才能达到平衡状态。
•压力:气相和液相的压强要相等,以保持平衡。
•组分:气液两相的组分要具备一定的关系,例如摩尔分数。
气液平衡条件的计算方法计算气液平衡条件可以通过不同的方法和模型。
常用的方法包括经验模型、理论模型和实验方法。
•经验模型:经验模型是基于大量实验数据的经验公式,适用于某些特定条件下的气液平衡计算。
•理论模型:理论模型基于物理原理建立,可以较准确地预测气液平衡。
常用的理论模型包括热力学模型和动力学模型。
•实验方法:实验方法是通过实验测量来确定气液平衡条件。
常用的实验方法有摩尔分数测定、压力-温度相图测定等。
气液平衡条件的应用气液平衡条件的应用广泛。
以下是一些常见的应用:•气体吸附分离:利用气体在吸附剂上的吸附特性,通过调节温度和压力实现气体吸附分离。
•溶剂提取:通过选择合适的溶剂、温度和压力条件,实现对混合物中某些组分的选择性提取。
•油气分离:在石油工业中,通过控制温度和压力条件,实现原油中油气的分离。
结论气液平衡条件是实现气液相平衡的关键要素。
通过理解和应用气液平衡条件,我们可以更好地设计和优化各种化工过程和设备,提高操作效率和产品质量。
通过不断研究和改进,我们可以在各个领域中充分利用气液平衡条件的优势,并为相关产业的发展做出贡献。
气液平衡条件的实验方法摩尔分数测定摩尔分数是指气液混合物中各组分的摩尔比例。

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载完全互溶双液系统气-液平衡相图的绘制(2) 误差分析地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容大学化学实验Ⅱ实验报告(物理化学部分)(贵州大学化学与化工学院——大学化学教学与示范中心)班级专业:环境科学091姓名:岳凡耀学号: 0908100121指导教师:谭蕾实验成绩:实验编号:十四实验项目名称:完全互溶双液系统气-液平衡相图的绘制报告人:岳凡耀同组人:赵安娜、赵芳、吴红、陈彦霖、孙腾实验时间:2011年4 月 28 日实验目的:掌握阿贝折射仪的使用方法通过测定混合物的折射率确定其组成。
学习常压下完全互溶双液系统气-液平衡相图的测绘方法,加深对相律、恒沸点的理解。
实验原理:相图是描述相平衡系统温度、压力、组成之间关系的图形,可以通过实验测定相平衡系统的组成来绘制。
两种液体物质混合而成的两组分体系称为双液系。
若两液体能以任意比例互溶,称其为完全互溶双液系统;若两液体只能部分互溶,称其为部分互溶双液系统。
当纯液体或液态混合物的蒸气压与外压相等时,液体就会沸腾,此时气-液两相呈平衡,所对应的温度就是沸点。
双液系统的沸点不仅取决于压力,还与液体的组成有关。
表示定压下双液系统气-液两相平衡时温度与组成关系的图称为T-XB 图或沸点-组成图。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-X),根据体系对乌拉尔定律的偏差情况,可分为三类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(а)所示。
(2)最大负偏差:混合物存在着最高沸点,如盐酸-水体系,如图1(b)所示。
(3)最大正偏差:混合物存在着最低沸点,如正丙醇-水体系,如图1(c)所示。

汽液平衡数据的测定汽液平衡数据是最常用的化工基础数据。
许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。
有热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。
现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。
所以汽液平衡数据的测定及研究深受化工界人士的重视一、实验目的:通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。
从而既加深对理论知识的理解和掌握,又提高了动手的能力。
二、汽液平衡测定和种类:由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。
按压力分,有常减压汽液平衡和高压所液平衡测定。
高压汽液平衡测定的技术相对比较复杂,难度较大。
常减压汽液平衡测定则相对较易。
按形态分,有静态法和动态法。
静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。
在动态法里又有单循环法和双循环法。
双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。
在一般情况下,常减压汽液平衡都采用双循环,而在高压所液平衡中,只让汽相强制循环。
循环的好处是易于平衡、易于取样分析。
根据对温度及压力的控制情况,有等温法与等压法之分。
一般,静态法采用等温测定,动态法的高压汽液平等多采用等温法。
总之汽液平衡系统特点各异,而测定的方法亦丰富多彩。
本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。
三、实验原理:以循环法测定汽液平衡数据的平衡釜有多种形式,但基本原理是一样的。
如图书馆所示,当体系达到平衡时,A 和B 两容器中组成不随时间布景为化,这时从A 和B 两容器中取样分析可以得到一组汽液平衡实验数据。
根据下平衡原理,当所液两相达到相平衡时,汽液两相温度压力相等,同时任一组分在各相中的逸度相等,即:v L i i f f =))这里 v v i i i f y P =Φ)) 0L i i i i f r x f =))对低压汽液平衡,其汽相可以视为理想气体混合物,即1v i Φ=),忽略压力对液体逸度的影响,即0i i f P =),从而得出低压下汽液平衡关系式:i i i i Py r x P =式中 P ——体系压力(总压)i P ——纯组分i 在平衡温度下的饱合蒸汽压。
第二节 两组分理想物系气液平衡5-2-1 两组分理想物系的气液平衡关系所谓理想物系是指液相和气相应符合以下条件:(1)液相为理想溶液,遵循拉乌尔定律。
根据溶液中同分子间与异分子间作用力的差异,可将溶液分为理想溶液和非理想溶液。
严格地说,理想溶液是不存在的,但对于性质极相近、分子结构相似的组分所组成的溶液,例如苯—甲苯、甲醇—乙醇、烃类同系物等都可视为理想溶液。
(2)气相为理想气体,遵循道尔顿分压定律。
当总压不太高(一般不高于104kPa )时气相可视为理想气体。
一、两组分理想物系的相律相律是研究相平衡的基本规律。
相律表示平衡物系中的自由度数、相数及独立组分 数间的关系,即F=C -φ+2 (5-1) 式中 F ——自由度数;C ——独立组分数;φ——相数。
式5-1中的数字2表示外界只有温度和压强这两个条件可以影响物系的平衡状态。
对两组分的气液平衡,其中组分数为2,相数为2,故由相律可知该平衡物系的自由度数为2。
由于气液平衡中可以变化的参数有四个,即温度t 、压强P 、一组分在液相和气相中的组成x 和y (另一组分的组成不独立),因此在t 、P 、x 和y 四个变量中,任意规定其中二个变量,此平衡物系的状态也就被唯一地确定了。
又若再固定某个变量(例如压强,通常蒸馏可视为恒压下操作),则该物系仅有一个独立变量,其它变量都是它的函数。
所以两组分的气液平衡可以用一定压强下的t —x (或y )及x —y 的函数关系或相图表示。
气液平衡数据可由实验室测定,也可由热力学公式计算得到。
二、用饱和蒸汽压和相平衡常数表示气液平衡关系根据拉乌尔定律,理想溶液上方的平衡分压为p A =p A ° x A (5-2) p B =p B °x B =(1-x A ) (5-2a ) 式中 p ——溶液上方组分的平衡分压,Pa ;p °——在溶液温度下纯组成的饱合蒸气压,Pa ;x ——溶液中组成的摩尔分率。
合肥学院Hefei University 《化工热力学》过程论文题气液平衡的计算方法目:系化学与材料工程系别:专化学工程与工艺业:学1303021001号:姓于晓飞名:教高大明师:气液平衡的计算方法摘要:气液平衡计算是化学过程中一项十分重要的计算。
气液平衡的计算方法有几种,活度系数法,状态方程法(EOS法),GEMC和GDI方法计算流体气液相平衡。
在气液平衡的计算中有三种泡点计算、露点计算和闪蒸计算,这里我们对闪蒸计算不做研究。
关键词:气液平衡计算方法GEMC GDI正文:气液平衡计算的基本公式及计算类型:相平衡的判据应用于气液平衡,即为:=fV iˆf L iˆ(i=1,2,3,…,N)式中,fiˆ为混合物中组分i 的逸度;上标V 指的是气相;上标L指的是液相。
上式既是气液平衡的准则,有事气液平衡计算的基本公式。
具体应用时,需要建立混合物中组分的逸度fV iˆ、fL iˆ与体系的温度、压力以及气液相平衡组成关系。
1.1活度系数法根据溶液热力学力论,将液相中组分的逸度与组分的活度系数相联系,简称活度系数法。
对液相,由活度与活度系数的定义式得出f L iˆ=fx iiiθγ式中,fiθ为标准态的逸度,以取Lewis-Randall 定则为基准的标准态,即纯液体i在体系的温度下的逸度。
fiθ=fL i=dp p p RTsi V p LiSi S i ⎰exp φ 式中,指数项dp pp RTs i V Li ⎰exp 称为Poynting 因子,其意义是压力对fiθ影响的校正。
对气相 将f L iˆ与f V iˆ表达式带入式中,得φˆV ip y i =dp p RTpL iS iSiiisiVp x ⎰expφγ (i=1,2,…,N)式中,y i 和x i 分别为汽、液相中组分i 的摩尔分数;φˆV i为气相混合物中组分i 在体系温度T ,体系压力p 下的逸度系数;γi 为液相中组分i 的活度系数;p Si 为纯组分i 在体系温度T 时的饱和蒸气压;φSi 为纯组分i 在体系温度T 与其饱和蒸气压p Si 时的逸度系数;V L i 为纯组分i 在体系温度T 时液相的摩尔体积。