第二章 滴定分析法概论
- 格式:ppt
- 大小:340.00 KB
- 文档页数:26









滴定分析法概论范文滴定分析法的基本原理是滴定液与待测溶液发生定量反应,滴定液的化学计量反应与待测物质的化学计量反应成正比。
在滴定过程中,通过向待测溶液中滴加滴定液,并同时使用指示剂来指示滴定的终点。
当滴定反应接近完成时,指示剂的颜色会发生明显的变化,通过记录滴定液的用量来计算出待测溶液中的含量或浓度。
1.准备滴定液和指示剂:选择适当的滴定液和指示剂,使其能够满足滴定反应的要求,并注意滴定液的稳定性和浓度。
2.准备待测溶液:将待测溶液按照一定的方法和条件准备好,并记录其体积和浓度。
3.滴定操作:在滴定过程中,首先将滴定液与待测溶液迅速混合,在溶液中加入一定量的指示剂。
然后使用滴定管滴加滴定液,直到观察到指示剂颜色发生明显变化。
在滴加过程中,要注意滴定液的滴下速度,避免滴下过快或过慢造成误差。
4.记录滴定数据:记录滴定液的滴加体积,并进行必要的数据处理和计算。
5.结果分析:根据滴定液的用量和待测物质的计量关系,计算出待测溶液的含量或浓度。
滴定分析法具有灵敏度高、准确度较高的优点,不仅适用于定量分析,还可以用于质量分析。
滴定分析法可以进行实时分析,方便快捷,且操作简单,不需要复杂的仪器设备。
此外,滴定分析法具有广泛的适用性,可以应用于不同类型的分析中。
然而,滴定分析法也存在一定的局限性。
滴定分析法对滴定液和指示剂的准确度要求较高,选择不当可能会导致结果的偏差。
滴定分析法在样品制备过程中容易受到环境条件的影响,如温度、湿度等。
另外,在滴定过程中,也需要注意滴定管、烧杯等实验器具的洁净度和正确使用方法。
总之,滴定分析法是一种常用且实用的定量分析方法,具有简便、快速和准确的特点。
在实际应用中,需要选择适当的滴定液和指示剂,严格控制实验条件,以获得准确可靠的分析结果。

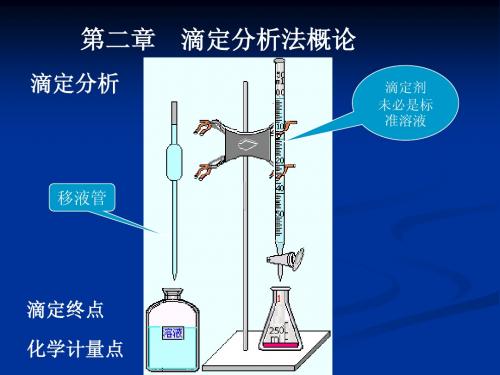
第一节 概述(一) 滴定分析法滴定:是将已知准确浓度的溶液——标准溶液通过滴定管滴加到待测溶液中的过程滴定分析法:待“滴定”进行到化学反应按计量关系完全作用为止,然后根据所用标准溶液的浓度的体积计算出待测物质含量的分析方法容量分析法:这类分析方法以测定标准溶液的容积为基础的方法,故滴定分析法又称~滴定分析法的特点:具有快速准确,操作简便,仪器要求低,相对误差一般在0.2%以下第二节 标准溶液(一) 标准溶液标准溶液的配制方法分为直接法和间接法1 直接法(1)试剂组成和化学式完成相符(2)试剂的纯度一般应在99.9%以上,且稳定,不发生副反应(3)试剂最好有较大的摩尔质量,可减少称量误差配制方法:准确称取一定量的基准物质,用一定溶剂溶解后定量转移到容量瓶中,稀释至刻度;根据称取的基准物质的质量和容量瓶的容积,即可算出该标准溶液的准确浓度:用配制溶液滴定基准物质计算其准确浓度的方法大多数标准溶液是通过标定确定其准确浓度的(二)标准溶液浓度的表示方法1 物质的量浓度常用的单位:摩尔(mol)或毫摩尔(mmol)滴定度滴定度:用来表示标准溶液的浓度表示方法:1.以每毫升标准溶液中所含溶质的质量表示2.以每毫升标准溶液所能滴定的被测物质的质量表示这种滴定度的表示方法的一般形式为T T/A,T表示滴定剂,A表示被测物质第三节 滴定分析的计算第四节 滴定分析中的化学平衡化学分析中常见的化学平衡包括:水的离解平衡,酸碱平衡,溶度积平衡,配位平衡,氧化还原平衡(一) 分布系数和副反应系数分析浓度:平衡体系中各种存在型体的平衡浓度之和,常用C表示分布系数:一定型体的平衡浓度占分析浓度的比值为该种型体的分布系数,用δn表示这里的n为型体的电荷数每种物质各种型体的分布系数的加和应等于1副反应系数:各种物质存在型体的浓度占各种物质存在型体浓度总和的分数倒数称为~ α =C/[Y]副反应系数和分布系数的倒数一致电荷平衡:只在一个化学平衡体系中正离子电荷的总和与负离子电荷的总和相等,即溶液总是电中性的电荷平衡式:正负电荷平衡的数学表达式质量平衡:又称物料平衡,指在一个化学平衡体系中某一组分的分析浓度等于该组分各种存在型体的平衡浓度之和。




