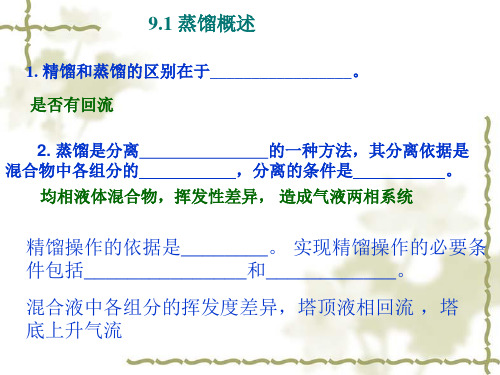
9-1_双组分溶_液气液相平衡
- 格式:ppt
- 大小:1.06 MB
- 文档页数:28


第二节双组分溶液的汽液相平衡§6.2.1、理想物系的汽液相平衡平衡蒸馏与简单蒸馏中都存在着汽液两相共存的物系。
在平衡蒸馏中汽液两相充分接触后再进行分离,可以近似认为两相已达到平衡状态。
在简单蒸馏中汽体自沸腾液体中产生,也可近似认为两相处于平衡状态。
所以,蒸馏过程都涉及到两相共存的平衡物系。
一、汽液两相平衡共存的自由度物系中共有四个变量P、T、y、xF = c-p+2 = 2-2+2 = 2所以四个变量中只有两个独立变量。
而蒸馏过程的操作压强是恒定不变的。
P一定,则F=1,即T、x、y中只有一个独立变量了。
若T一定,则x、y随之而定;若x或y 一定,则T(y)或T(x)也随之而定。
图中恒压下双组分平衡物系中必存在着:1)液相(或汽相)组成与温度间的一一对应关系,T-x(y)关系。
2)汽、液相组成之间的一一对应关系,y~x关系。
二、双组分理想物系的Tb~x关系式(泡点——液相组成关系式)理想物系液相为理想溶液I.S.,服从拉乌尔定律;微观Micro:g11=g22=g12,宏观Macro:△H=0;△V=0汽相为理想气体I.G.,服从理想气体定律或道尔顿分压定律。
根据拉乌尔定律,液相上方的平衡蒸汽压为,,混合液的沸腾条件是各组分的蒸汽压之和等于外压,即或Tb~x的函数关系已知泡点,可直接计算液相组成;反之,已知组成也可算出泡点,但一般需经试差,这是由于fA (t)和fB(t)通常系非线性函数的缘故。
纯组分的p0与t的关系通常可表示成如下的经验式:安托因方程A,B,C为安托因常数,由手册查得。
三.汽液两相平衡组成间的关系式Κ——相平衡常数,y-x的函数关系,P一定,Κ=f(T)。
四.汽相组成与温度(露点)的定量表达式y-Td函数关系式五.t~x(y)图和y-x图P恒定E、F互成平衡的汽、液相B'——第一个汽泡D'——第一个液滴把p一定,不同温度下互成平衡的汽液两相组成y和x绘制在y-x坐标中,得到的图称为y-x图。



双组分实际物系的气液相平衡双组分实际物系的气液相平衡是物理化学中一个重要的研究领域。
在这个领域中,我们研究的是由两种不同组分组成的混合物在一定条件下的气相和液相之间的平衡状态。
在气液相平衡中,我们通常关注的是两个重要的参数:温度和压力。
这两个参数会直接影响到气液相平衡的状态。
当温度和压力达到一定条件时,气体和液体之间会达到一个平衡状态,这个状态被称为饱和状态。
饱和状态下,气体和液体之间存在着动态平衡。
这意味着在饱和状态下,气体和液体之间会不断地发生相互转化,但总体上气体和液体的数量保持不变。
这种相互转化的过程被称为汽化和液化。
在双组分实际物系中,两种组分的物理性质会直接影响到气液相平衡的状态。
其中一个重要的性质是两种组分的互溶性。
如果两种组分具有较好的互溶性,那么在饱和状态下,气体和液体之间会有较好的混合性,从而形成一个均一的混合相。
相反,如果两种组分的互溶性较差,那么在饱和状态下,气体和液体之间会发生相分离现象,形成两个不同的相。
另一个重要的性质是两种组分的挥发性差异。
如果两种组分的挥发性差异较大,那么在饱和状态下,气体中富集了挥发性较高的组分,而液体中则富集了挥发性较低的组分。
这种情况下,气液相平衡的状态可以通过蒸馏等方法进行调节,以达到所需的纯度。
在实际应用中,我们经常遇到一些特殊的气液相平衡问题。
例如,在工业生产中,我们需要控制气体和液体之间的平衡状态,以确保产品的质量。
另外,在环境保护领域,我们也需要研究气体和液体之间的平衡状态,以了解污染物在大气和水体之间的传输规律。
总之,双组分实际物系的气液相平衡是一个复杂而有趣的研究领域。
通过深入研究气液相平衡的原理和规律,我们可以更好地理解混合物在不同条件下的行为,并且可以为实际应用提供有力的支持。