结构化学基础
- 格式:ppt
- 大小:4.28 MB
- 文档页数:69

结构化学基础
结构化学是研究化学物质的结构,关系和性质的一门学科,它至关重要。
结构化学通过对核苷酸、蛋白质、细胞及其他有机分子进行深入研究来了解化学反应的机理、以及它们对
生理过程的影响。
例如,只有当我们了解了血清素的构造,我们才能研发精准的抗抑郁症药物。
结构化学的基础是分子动力学模型。
分子动力学模型是用来模拟分子的位移、旋转和绑定的理论。
这些运动取决于分子间的相互作用,以及环境中的压力、温度、光照等因素,包
括电子交换等力学力量。
通过分子动力学模型,我们可以模拟分子发生变化的情况,甚至
研究宏观量级的化学反应,从而推导出它们的化学和物理性质。
结构化学也涉及有机化学、生物化学、物理化学、以及分子结构计算等多个学科。
它是一门研究物质结构和性质的综合性学科,既有理论研究,又有实验研究,涉及数学、物理、化学和生物等多个学科。
运用结构化学可以研究生命过程与化学反应的关系,发展出各种
新药物、新材料和新技术。
综上所述,结构化学是研究化学反应机理和生理过程的重要学科,有助于研发各种新药物、新材料以及新技术。
它涉及多领域,并且需要综合运用多学科知识,可以为我们提供很多
科学上的新发现。

结构化学基础在化学中,人们常使用分子图来代表化学物质。
分子图是一种结构化学的基本工具,能够清晰地表示化学物质的结构和性质。
结构化学是分子图的基础。
它研究分子、离子和它们之间的化学键所构成的化合物的结构、性质和反应。
本文将介绍结构化学的基础知识。
一、化学键的类型化学键是互相链接原子的力。
它们决定了分子的结构和性质。
化学键的类型有以下几种。
1. 静电键静电键是正负电荷之间的吸引力。
它们在离子化合物中非常普遍,比如氯化钠。
在分子化合物中,静电键是非常弱的,因为它们只有在极性分子中才存在。
有时候,静电键出现在共价键中,此时可以称之为极性共价键。
氟气和水分子中就存在这样的极性共价键。
2. 共价键共价键是原子间由共用一对电子而形成的化学键。
共价键分为极性共价键和非极性共价键。
非极性共价键指的是两个非极性原子间的化学键,例如氢气。
而极性共价键指的则是两个原子间,如果原子的电负性存在明显差异,就会形成极性共价键。
极性共价键在分子的化学性质中扮演着重要角色。
3. 金属键金属键是由离子化合物中金属离子与自由电子构成的一种键。
金属键在金属中的性质中起着重要的作用,它使得金属成为了良好的导体和热传导介质。
二、分子几何与习惯表示法分子的几何形状对于分子的化学性质有很大的影响。
在结构化学中,常用杜瓦尔-布拉格方案表示分子几何和结构。
这个方案中,每个原子都用一个符号表示,而它们之间的化学键用线来表示。
在所有的分子几何类型中,最重要的是以下几种。
1. 线性线性分子的共价键通常都是直线分布的。
氧气和碳二氧化分子都是线性分子。
2. 三角形锥形三角形锥形分子中,原子最多有四个邻居。
水分子和氨分子都是三角锥形分子。
3. 四面体四面体分子的原子通常有五个邻居。
一些复杂的离子也属于这一类分子。
三、立体异构体分子的立体异构体是指它们在空间构型方面存在不同的结构形态。
化学家使用手性符号或矢量来表示这些立体异构体。
异构体在化学和医学上都有很多应用。

结构化学基础知识点总结结构化学是化学的一个重要分支,主要研究物质的分子结构及其性质与变化。
以下是结构化学的基础知识点总结:1.化学键:化学键是原子之间的连接。
常见的化学键包括共价键、离子键和金属键。
共价键是通过共享电子对连接原子的,离子键是通过正负离子之间的电荷吸引力连接的,金属键是由金属离子的正电荷和自由电子之间的相互作用连接的。
2.价电子:原子外层的电子称为价电子。
它们决定了原子的化学性质和与其他原子形成化学键的能力。
主族元素的价电子数等于元素的主族号减去10,而过渡金属的价电子数则根据元素的电子排布确定。
3.分子式与结构式:分子式表示化合物中原子的种类和数量,用化学符号和小标数表示,例如H2O表示水分子。
结构式更详细地表示了化合物中原子之间的连接关系,包括键的类型和数量。
常见的结构式表示方法有线条结构式、希尔伯特投影式和叠式结构式等。
4.共价键的构型理论:共价键的构型理论包括共价键构型、价层电子对斥力理论(VSEPR理论)和化学键混合理论。
共价键构型指的是取得最低能量的共价键构型,包括线性、三角形平面、四面体和八面体等几何形状。
VSEPR理论用于预测分子形状,可以通过电子云对中原子周围的电子对的排列关系来确定分子形状。
化学键混合理论解释了化学键形成的机制,通过重新配对原子的电子,可以形成不同数量和性质的化学键。
5.分子轨道理论:分子轨道理论用于描述分子中的电子分布和性质。
分子轨道是原子轨道的线性组合,可以用分子轨道能级图表示。
共价键形成时,原子轨道的重叠导致分子轨道的形成,其中有两种类型:σ(sigma)轨道和π(pi)轨道。
σ轨道沿化学键方向形成,π轨道则垂直于化学键方向形成。
分子轨道的填充遵循由低能级到高能级的原则,通过分析分子轨道能级可以预测化合物的性质。
6.杂化轨道理论:杂化轨道理论用于描述共价键的形成。
原子的轨道混合以形成杂化轨道,其形状和方向决定了化合物的几何形状。
sp轨道是最常见的杂化轨道,即包含一部分s轨道和一部分p轨道的混合轨道,类似地,sp2和sp3轨道也是常见的杂化轨道。

![[正式版]结构化学习题解答 《结构化学基础》北京大学出版社ppt资料](https://uimg.taocdn.com/a1f2e19431b765ce040814d5.webp)

大一结构化学基础知识点结构化学是化学的重要分支之一,它研究分子的结构以及与结构之间的相互作用关系。
在大一的学习中,我们需要掌握一些基础的结构化学知识点,下面将对其中的一些重点内容进行介绍。
1. 原子与元素周期表原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,中子不带电,电子带负电荷。
元素周期表是化学中常用的工具,按照原子序数和元素性质排列了所有已知元素。
周期表中的每个元素都有自己独特的原子结构和化学性质。
2. 化学键与分子结构化学键是原子之间的连接,用于稳定分子结构。
常见的化学键有共价键、离子键和金属键等。
共价键是通过共用电子对形成的,可进一步分为极性共价键和非极性共价键。
离子键是通过正负电荷相互吸引形成的,金属键是金属原子间的电子云形成的。
3. 分子几何结构分子几何结构与原子间的化学键相关。
分子结构分为线性结构、平面三角形结构、四面体结构等。
分子几何结构决定了分子的空间排布和分子性质。
4. 有机化合物有机化合物主要由碳和氢组成,也包含其他元素。
有机化合物是生物体的组成部分,广泛存在于自然界和人工合成的化合物中。
大一阶段学习的有机化合物包括烃类、醇类、醛类、酮类、酸类等。
5. 化学反应与反应速率化学反应是物质转化过程,涉及到化学键的破裂和生成。
反应速率是指反应物浓度变化的快慢。
影响反应速率的因素包括浓度、温度、催化剂等。
6. 氧化还原反应氧化还原反应是化学反应中常见的一类反应,涉及到电子的转移。
在反应中,氧化剂接受电子而被还原,还原剂失去电子而被氧化。
氧化还原反应是许多重要化学反应的基础。
7. 化学平衡与动态平衡化学平衡是指反应物浓度和生成物浓度不再发生明显变化的状态。
动态平衡是指正反应和逆反应同时进行,速率相等达到平衡。
化学平衡和动态平衡是化学反应可逆性的重要特征。
8. 功能团与有机化合物命名有机化合物常常包含不同的功能团,如羟基、醛基、胺基等。
根据有机化合物中的功能团,可以进行系统命名和常用命名。



![结构化学基础知识点总结[参考]](https://uimg.taocdn.com/a3373f27ba68a98271fe910ef12d2af90242a8a8.webp)
结构化学基础知识点总结[参考]一、原子结构与原子能1、原子结构:原子是最小的具有化学性质的物质单位,原子结构由原子核和电子组成。
原子核由正电荷和非常小的负电荷组成,其质量约为原子的七十分之一。
电子的电荷为负,小,它的质量约为原子的三万分之一。
2、原子层次:电子位级是决定原子性质的内部结构,它将电子分成分子、原子层、最低能量状态等不同的层次,每一层的电子能量和每层的电子数在这一层上都是一定的。
3、原子能:原子的特征主要基于原子能。
原子能是原子核里的质子和中子相互反作用时所产生的能量,其势能和机械能在原子内部形成了重要的离散能级,其能级的高低决定着原子的性质。
二、原子结合1、杂原子结合:杂原子结合是指由不同元素构成的分子,例如水分子、由氢、氧组成的有机分子等,它们的特性与它们构成分子的元素,强度以及键数有关,从这些特性可以分辨出不同的化合物的性质。
2、非离子结合:非离子结合是指两个有共同亲和力的原子形成结合的一种结合方式,它们之间的结合是由相互分子对激发的吸引力维持的,例如氢键等,它不仅能定义分子的构型,而且还能定义分子的易燃性、电离性等一系列特性。
3、离子结合:离子结合是指一种具有一定形状的离子由于它们之间及其外围有机分子的电荷分布而形成的一种极性结合,它的调整能有来控制原子结合能从而控制它的性质。
三、离子化1、离子化反应:离子化反应是指有机分子或其它物质被离子(带电离子)分解而形成离子络合物的一类物质反应。
如水解反应等。
2、离子网络:离子网络是指各种结构不同的离子团簇相互联结而成的网络结构。
它由共有电子对或共有质子对不断构成,结构十分坚固,可以改变热,紫外等波长的电磁辐射的传播状态,也具有非常重要的作用。
3、离子热:离子热是指原子以及离子的极性的能量的转变,它与常温下无机物质之间的反应有较大的区别,一般表现为高温下才会形成有机反应,因此,离子热是一个相对比较高热的反应系统。
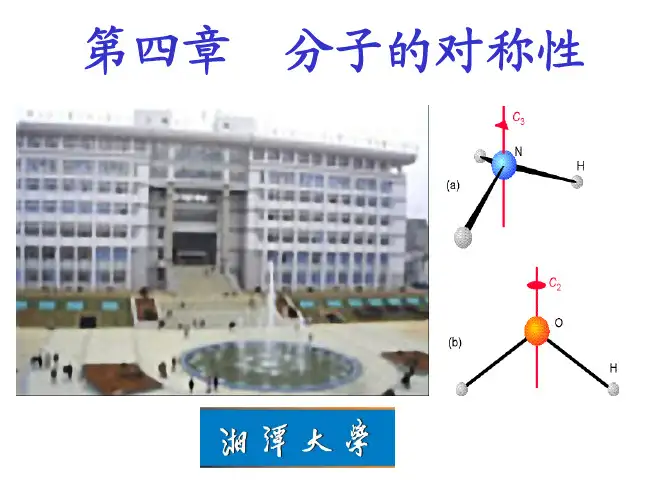
结构化学基础第五版周公度答案目录01.量子力学基础知识 ...................................................................................................................... 1 02 原子的结构和性质 ................................................................................................................. 13 04分子的对称性 ............................................................................................................................ 48 05 多原子分子中的化学键 ........................................................................................................... 61 06配位化合物的结构和性质 ........................................................................................................ 91 07晶体的点阵结构和晶体的性质 .............................................................................................. 103 08金属的结构和性质 .................................................................................................................. 119 09离子化合物的结构化学 .......................................................................................................... 135 10次级键及超分子结构化学 (153)01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1为单位的能量。
结构化学基础第五版pdf答案1、挥发油的溶解性难溶于()[单选题] *A水(正确答案)B乙醇C石油醚D乙醚2、一般情况下,为无色的化合物是()[单选题] *A黄酮B花色素C二氢黄酮(正确答案)D查耳酮3、下列溶剂中亲脂性最强的是()[单选题] *A甲醇B苯(正确答案)C三氯甲烷D丙酮4、香豆素与浓度高的碱长时间加热生成的产物是()[单选题] *A脱水化合物B顺式邻羟基桂皮酸(正确答案)C反式邻羟基桂皮酸D醌式结构5、所有游离香豆素均可溶于热的氢氧化钠水溶液,是由于其结构中存在()[单选题] * A异戊烯基B酮基C内酯环(正确答案)D酚羟基对位活泼氢6、凡具有()的木脂素,与三氯化铁反应,呈阳性()[单选题] *A酚羟基(正确答案)B羧酸C醇羟基D氨基7、苯丙素类化合物的生物合成途径是()[单选题] *A醋酸-丙二酸途径B丙二酸途径C莽草酸途径(正确答案)D氨基酸途径8、下列化合物可用水蒸汽蒸馏法提取的是()[单选题] *A七叶内酯(正确答案)B七叶苷C厚朴酚D五味子素9、以下黄酮类化合物中,以离子状态存在的是()[单选题] * A黄酮B花色素(正确答案)C二氢黄酮D查耳酮10、下列生物碱碱性最强的是()[单选题] *APkA=22BPkA=5(正确答案)CPkA=13DPkA=5811、沉淀法的分类不包括以下哪一种方法()[单选题] *A水提醇沉法B碱提酸沉法C铅盐沉淀法D结晶法(正确答案)12、具有光化学毒性的中药化学成分类型是()[单选题] *A多糖B无机酸C鞣质D呋喃香豆素(正确答案)13、以橙皮苷为指标成分进行定性鉴别的中药是()[单选题] * A葛根B黄芩C槐花D陈皮(正确答案)14、检识黄酮类化合物首选()[单选题] *A盐酸-镁粉反应(正确答案)B四氢硼钠反应C硼酸显色反应D锆盐-枸橼酸反应15、美花椒内酯属于()[单选题] *A呋喃香豆素B吡喃香豆素(正确答案)C环木脂素D环木脂内酯16、当一种溶剂无法结晶时,常常使用混合溶剂,下列不是常用的混合溶剂是()[单选题] *A甲醇-水B乙酸-水C乙醚-丙酮D石油醚-水(正确答案)17、临床上应用的黄连素主要含有()[单选题] *A奎宁B小檗碱(正确答案)C粉防己碱D苦参碱18、极性最大的溶剂是()[单选题] *A酸乙酯(正确答案)B苯C乙醚D氯仿19、下面化合物能与异羟肟酸铁反应的是()[单选题] *A花椒内酯(正确答案)B柠檬烯C色原酮D天精20、E连续回流提取法(正确答案)下列方法中能始终保持良好浓度差的是()* A浸渍法B渗漉法(正确答案)C煎煮法D回流提取法21、下列化合物中具有强烈天蓝色荧光的是()[单选题] * A七叶内脂(正确答案)B大黄素C麻黄碱D大豆皂苷22、游离生物碱和生物碱盐都易溶解的溶剂是()[单选题] * A三氯甲烷B正丁醇C乙醇(正确答案)D水23、中药紫草中的主要有效成分属于()[单选题] *A苯醌类B萘醌类(正确答案)C蒽醌类D菲醌类24、下列含有蒽醌类成分的中药是()*A丹参B决明子(正确答案)C芦荟(正确答案)D紫草25、萃取时,混合物中各成分越易分离是因为()[单选题] *A分配系数一样B分配系数相差越大(正确答案)C分配系数越小D以上都不是26、关于前胡,说法正确的有(多选)()*A是伞形科前胡属植物(正确答案)B药理药效作用主要有祛痰、镇咳、平喘、抗炎、解痉、镇静等(正确答案)C可与皂荚、藜芦等药物一起放在药中煎煮D不溶乙醚等有机溶剂27、以下哪种方法是利用混合中各成分在溶剂中的溶解度不同或在冷热情况下溶解度显著差异的原理而达到分离的()[单选题] *A沉淀法B分馏法C结晶法(正确答案)D升华法28、阿托品是莨菪碱的()[单选题] *A左旋体B右旋体C同分异构体D外消旋体(正确答案)29、在高效液相色谱法中,常用的柱内填料是()[单选题] * A氧化铝B活性炭C十八烷基硅烷键和硅胶(正确答案)D羧甲基纤维素30、临床用于上呼吸道抗菌消炎的是()[单选题] *A穿心莲内酯(正确答案)B青蒿素C莪术醇D薄荷脑。
05 多原子分子中的化学键【5.1】利用价电子互斥理论,说明44324XeF,XeO,XeO,XeF,XeOF等分子的形状。
解:【5.2】利用价电子互斥理论,说明2-+-333333AsH,ClF,SO,SO,CH,CH的分子和离子的几何形状,说明哪些分子有偶极矩?表中3分子中Cl原子周围的5对价电子按三方双锥分布,可能的形状有下面三种:(A)和(B)相比,(B)有lp-lp(孤对-孤对)排斥作用代替(A)的lp-bp(孤对-键对)相互作用,故(A)比(B)稳定。
(A)和(C)比较,(C)有两个lp-bp相互作用代替了(A)的2个bp-bp相互作用,故(A)最稳定。
【5.3】画出下列分子中孤对电子和键对电子在空间的排布图:(a )2ICl -,2N O (b )3H O +,3BrF ,3NF ; (c )4ICl -,4IF +,4SbF -,22XeO F ;(d )3IF ,5XeF +。
解:这是VSEPR 方法的具体应用,现将分子中孤对电子和键对电子在空间的排布图示于图5.3。
(a)N (b)HCl F(c)(d)图5.3【5.4】写出下列分子或离子中,中心原子所采用的杂化轨道:2CS ,2NO +,3NO -,3BF ,4CBr ,4PF +,6SeF ,5SiF -,36AlF -,6IF +,4MnO -,5MoCl ,()322CH SnF 。
解:【5.5】由22x y d -,s ,x p ,yp轨道组成2dsp 等性杂化轨道1φ,234,,φφφ,这些轨道极大值方向按平面四方形分别和,x y 轴平行。
根据原子轨道正交、归一性推出各个杂化轨道的,,,x yd s p p 的组合系数,验证它们是正交,归一的。
解:因为4个2dsp 杂化轨道是等性的,所以每一条杂化轨道的s ,p 和d 成分依次为1/4,1/2和1/4。
这些成分值即s ,p 和d 轨道在组成杂化轨道时的组合系数的平方。