第3章 氨基酸分离分析
- 格式:ppt
- 大小:142.00 KB
- 文档页数:13


氨基酸的分离鉴定纸层析法引言:氨基酸是构成蛋白质的基本组成单元,对于生物体的正常生理功能至关重要。
因此,准确地分离鉴定氨基酸成分对于研究蛋白质结构和功能具有重要意义。
纸层析法是一种简单而有效的分离和鉴定氨基酸的方法。
本文将介绍氨基酸的分离鉴定纸层析法并探讨其应用。
一、纸层析法的原理纸层析法是利用气相平衡原理进行物质分离的一种方法,其原理是根据物质在纸上各组分的相对亲疏性,通过运动距离的差异来分离物质。
在氨基酸的分离鉴定中,纸层析法通过将待测氨基酸溶液滴于纸上,然后将纸立起来,将纸的下端浸入相应的溶剂中,使得溶剂上升,通过毛细作用将氨基酸上提,最终实现氨基酸的分离和鉴定。
二、纸层析法的步骤1. 准备工作:制备纸层析板和显色剂。
2. 样品处理:将待测氨基酸溶解于适量的溶剂中,使其浓度适宜,然后滴于纸层析板上。
3. 运行纸层析:将纸层析板立起,纸的下端浸入相应的溶剂中,待溶剂上升到一定高度后,取出纸层析板。
4. 显色:将纸层析板放置于显色剂中,通过氨基酸与显色剂的反应,使得氨基酸在纸上显色。
5. 结果鉴定:根据显色的位置、颜色和强度等特征,对氨基酸进行鉴定和定量分析。
三、纸层析法的应用1. 氨基酸组成分析:纸层析法可用于分析蛋白质中氨基酸的组成,从而揭示蛋白质的结构和功能。
2. 质量控制:纸层析法可用于对食品、药品等中氨基酸含量的快速检测,保证产品质量和安全性。
3. 生物体内氨基酸代谢研究:纸层析法可用于研究生物体内氨基酸的代谢途径和代谢产物。
四、纸层析法的优缺点纸层析法作为一种常用的分离和鉴定氨基酸的方法,具有以下优点:1. 简单易行:操作简单,不需要复杂的仪器设备,成本低廉。
2. 分离效果好:对于氨基酸的分离效果较好,可以得到较为准确的结果。
3. 易于观察:通过显色剂的反应,可以直观地观察到氨基酸在纸上的分离和鉴定结果。
然而,纸层析法也存在一些缺点:1. 分离效果有限:对于某些结构相似的氨基酸,纸层析法的分离效果不佳,难以实现准确鉴定。


实验一氨基酸的分离与鉴定——滤纸层析法目的要求(1)通过实验,了解氨基酸滤纸层析法的原理。
(2)掌握氨基酸滤纸层析的操作方法。
原理滤纸层析是以滤纸作为惰性支持物的分配层析(它也并存着吸附和离子交换作用)。
滤纸纤维上羟基具有亲水性,因此吸附一层水作为固定相,而通常把有机溶剂作为流动相。
有机溶剂自上而下流动称为下行层析,自下而上流动称为上行层析。
流动相流经支持物时,与固定相之间连续抽提,使物质在两相间不断分配而得到分离。
溶质在滤纸上的移动速率用R f值表示:溶质结构、溶剂系统物质组成与比例、pH值、选用滤纸质地和温度等因素都会影响R f 值。
此外,样品中的盐分、其他杂质以及点样过多皆会影响样品的有效分离。
无色物质的纸层析图谱可用光谱法(紫外光照射)或显色法鉴定。
氨基酸纸层析图谱常用的显色剂为茚三酮或吲哚醌,本实验采用茚三酮为显色剂。
本实验用单向上行层析法作标准氨基酸的标准曲线,用双向上行纸层析法作几种已知氨基酸的层析图谱。
然后将其中的谷氨酸和天冬氨酸加以定量测定。
试剂和器材一、试剂(1)8×10-3mol/L谷氨酸和8×10-3mol/L天冬氨酸混合液。
(2)谷氨酸、天冬氨酸、谷氨酰胺、γ-氨基丁酸和丙氨酸混合液(已知氨基酸混合液)。
将以上氨基酸分别配制成8×10-3mol/L的浓度,然后混合之。
(3)茚三酮重结晶方法:茚三酮有时由于包装不好或放置不当常带微红色,需重结晶方可使用。
5g茚三酮溶于15mL热水,加入0.25g活性炭轻轻搅动,若溶液太浓不易操作,可酌量加5—10mL热水,加热30min后趁热过滤(用热滤漏斗,以免茚三酮遇冷结晶而损失),滤液置冰箱内过夜,次日晨即见黄白色结晶出现,过滤,再以1mL冷水洗涤结晶,置于干燥器中干燥,最后装入棕色瓶内保存。
(4)0.1%硫酸铜(CuSO4·5H2O):75%乙醇=2 :38硫酸铜难溶于乙醇,将硫酸铜直接用75%乙醇溶解不能得到澄清溶液,如将硫酸铜溶液和乙醇混合后,放置过久则会有沉淀析出,因此,必须在临用前按比例混合。

氨基酸的分离鉴定纸层析法实验报告一、实验目的1、掌握纸层析法分离和鉴定氨基酸的基本原理和操作方法。
2、学习如何根据氨基酸在层析纸上的迁移率(Rf 值)来鉴定氨基酸。
二、实验原理纸层析法是以滤纸作为惰性支持物的分配层析法。
滤纸纤维上的羟基具有亲水性,能吸附一层水作为固定相,而有机溶剂作为流动相。
当有机相沿滤纸经过样品点时,样品点中的溶质在水和有机相之间进行分配。
由于不同的氨基酸在两相中的分配系数不同,导致它们在滤纸上的迁移率不同,从而实现分离和鉴定。
Rf 值(比移值)是氨基酸在层析中的特征值,计算公式为:Rf =溶质移动的距离/溶剂移动的距离。
三、实验材料与仪器1、实验材料标准氨基酸溶液:丙氨酸、缬氨酸、亮氨酸。
混合氨基酸溶液。
展开剂:正丁醇:冰醋酸:水= 4:1:5(体积比)。
显色剂:025%茚三酮溶液。
2、实验仪器层析缸。
毛细管。
喷雾器。
烘箱。
直尺。
四、实验步骤1、准备滤纸选用一张大小合适的滤纸,在距底边 2cm 处用铅笔轻轻画一条横线,作为起始线。
2、点样用毛细管分别吸取标准氨基酸溶液和混合氨基酸溶液,在起始线上轻轻点样,每个点的直径不超过 2mm,点样后自然风干。
3、层析将滤纸垂直放入装有展开剂的层析缸中,滤纸下端浸入展开剂约1cm,注意滤纸不要与缸壁接触,盖上盖子,进行层析。
当展开剂前沿上升至距滤纸顶端约 1cm 时,取出滤纸,用铅笔标记展开剂前沿的位置,自然风干。
4、显色用喷雾器将显色剂均匀地喷在滤纸上,放入烘箱中,在 80℃左右烘 5 10 分钟,直至斑点显色清晰。
五、实验结果与分析1、测量并计算 Rf 值用直尺分别测量标准氨基酸和混合氨基酸斑点中心到起始线的距离(a)以及展开剂前沿到起始线的距离(b),计算 Rf 值。
2、结果分析根据计算得到的 Rf 值,对照标准氨基酸的 Rf 值,鉴定混合氨基酸溶液中的成分。
六、注意事项1、点样时要避免毛细管的尖端刺破滤纸,且点样量要适中,过多会导致斑点扩散,影响分离效果。

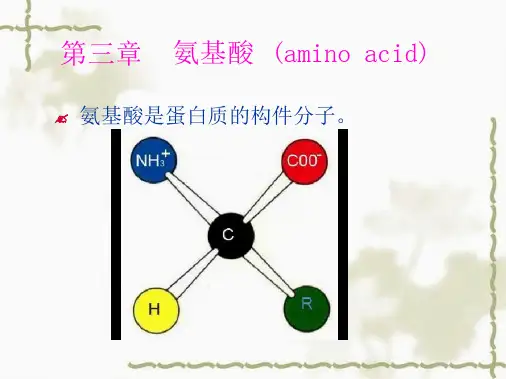
第三章氨基酸第3章氨基酸四大类生物分子中蛋白质是生物功能的主要载体,而氨基酸(amino acid)是蛋白质的构件分子。
自然界中存成千上万在的种蛋白质,在结构和功能上的惊人的多样性归根结底是由20种常见氨基酸的内在性质造成的。
这些性质包括①聚合能力,②特有的酸碱性质,③侧链的结构及其化学功能的多样性,④手性。
本章主要讲述这些性质,它们是讨论蛋白质和酶的结构、功能以及许多其他有关问题的基础。
一、氨基酸—蛋白质的构件分子(一)蛋白质的水解一百多年前就开始了关于蛋白质的化学研究。
在早期的研究中,水解作用提供了关于蛋白质组成和结构的极其价值的资料。
蛋白质可以被酸、碱或蛋白酶催化水解。
在水解过程中,逐渐降解成相对分子质量越来越小的肽段(peptide fragment),直到最后成为氨基酸的混合物。
根据蛋白质的水解程度,可分为完全水解和部分水解两种情况。
完全水解或称彻底水解,得到的水解产物是各种氨基酸的混合物。
部分水解即不完全水解,得到的产物是各种大小不等的肽段和氨基酸。
下面简略地介绍酸、碱和酶3种水解方法及其优缺点:⑴酸水解常用H2SO4或HCl进行水解。
一般6mol/L HCl,4mol/L H2SO4;回流煮沸20h左右可使蛋白质完全水解。
酸水解的优点是不引起消旋作用(racemization),得到的是L-氨基酸。
缺点是色氨酸完全被沸酸所破坏,羟基氨基酸(丝氨酸及苏氨酸)有一小部分被分解,同时天冬氨酸和谷氨酰胺的酰胺基被水解下来。
⑵碱水解一般与5mol/L NaOH共煮10~20h,即可使蛋白质完全水解。
水解过程中多数氨基酸遭到不同程度的破坏,并且产生消旋现象,所得产物是D-和L-氨基酸的混合物,称消旋物(见本章氨基酸的光学活性部分)。
此外,碱水解所需时间较长。
因此酶法主要用于部分水解。
常用的蛋白酶有胰蛋白酶(trypsin)、胰凝乳蛋白酶或称糜蛋白酶(chymotrypsin)以及胃蛋白酶(pepsin)等,它们主要用于蛋白质一级结构分析以获得蛋白质的部分水解产物。




氨基酸的分离鉴定实验报告实验室的氨基酸分离鉴定实验,哎呀,听起来就很专业对吧?做起来也不复杂,咱们先把氨基酸这玩意儿搞清楚。
氨基酸是咱们身体的“小工人”,它们负责合成蛋白质,咱们吃的各种食物,都是它们的材料。
所以,搞清楚氨基酸的种类和特性,简直是给自己补充营养的第一步。
在实验开始之前,先准备好需要的材料。
比如说,咱们得有氨基酸样品、缓冲液、色谱柱之类的玩意儿。
嘿,你可能会问,色谱柱是什么?简单来说,就是咱们分离氨基酸的小工具,像个细长的管子,里面填满了能“吸附”氨基酸的材料。
听起来是不是很神奇?然后,咱们得把样品溶解在缓冲液里,记住,这一步很重要,得搅拌均匀。
咱们可不能把氨基酸“丢”到水里就完事,得让它们彻底溶解,像小鱼在水里游得自在那样。
把溶液慢慢倒入色谱柱,哇,真是“万事开头难”,这时你就得耐心等待,看看氨基酸们是如何排队出场的。
每种氨基酸在柱子里都有不同的“出场时间”,就像参加选秀节目一样,个个都想争当“明星”。
当氨基酸一一流出时,咱们得用“紫外光检测器”来识别。
这个小家伙可是非常聪明,能识别每种氨基酸的“身份证”。
你知道吗?有些氨基酸在紫外光下会发光,就像明星在舞台上闪闪发光一样。
每当看到一个个氨基酸冒泡,真是让人激动得像打了鸡血!咱们得记录每种氨基酸的出现时间和浓度。
这就像做日记,记下每个小细节,越详细越好。
然后,咱们就能把这些数据分析出来,画出一张“氨基酸分布图”。
说实话,这一过程还真是考验耐心,有时候还得来几次“复测”,才能确保结果的准确性。
不过,别担心,结果一出来,绝对让你心里美滋滋的。
咱们得对实验结果进行讨论。
这一步也很重要,得看看咱们的分离结果和理论结果是否一致。
氨基酸的分离效果可能不如预期,别灰心,科学就是这么神奇,有时候让你意想不到。
你还会发现一些不常见的氨基酸,简直就像在挖宝一样,兴奋得不得了。
大家肯定好奇,这些氨基酸到底有什么用。
氨基酸可不是“吃了就算”,它们在咱们的身体里起着举足轻重的作用,比如促进新陈代谢、修复组织等等。
实验三氨基酸的分离鉴定—纸层析法一、实验目的通过对氨基酸的分离,学习运用纸层析法分离混合物的基本原理,掌握纸层析的操作方法。
二、实验原理纸层析从层析原理来讲属于分配层析,它是以纸作固定相的载体,纸纤维上的羟基具有亲水性,因此滤纸吸附的水作为固定相,而通常把有机溶剂作为流动相。
将样品点在滤纸上(此点称为原点),进行展开,样品中的各种溶质(如氨基酸)即在两相溶剂中不断进行分配。
由于它们的分配系数不同,因此不同的溶质随流动相移动的速率不等,于是就将这些溶质分离开来,形成距原点不等的层析点。
溶质在滤纸上的移动速率用Rf值表示:Rf=原点到层析点中心的距离/原点到溶剂前沿的距离只要条件(如温度、展开溶剂的组成、滤纸的质量等)不变,Rf值是常数。
故可根据Rf值作定性分析。
无色物质的纸层析图谱可用显色法鉴定,氨基酸纸层析图谱常用茚三酮作为显色剂。
三、仪器与试剂(一)实验器材大烧杯(1个)、毛细管(10支)、喷雾器(公用)、培养皿(1个)、层析滤纸(2张)、烘箱、镊子(1把)、刻度尺、铅笔、针线、手套(二)实验试剂1、扩展剂:是4份水饱和的正丁醇和1份醋酸的混合物。
将20mL正丁醇和5mL冰醋酸放入分液漏斗中,与15mL水混合,充分振荡,静置后分层,放出下层水层。
2、氨基酸溶液:0.5%缬氨酸、组氨酸、谷氨酸、亮氨酸、甘氨酸溶液:分别称取上述5种氨基酸各0.5g,分别溶于20ml蒸馏水中,测其pH值并用5%KOH或HCl调至中性,然后用pH7.40.01mol/L磷酸缓冲液稀释至100ml。
PH7.4时Na2HPO4溶液与NaH2PO4溶液的体积比为81∶19。
样品1:用等量的组氨酸、谷氨酸、亮氨酸溶液混合。
样品2:用等量的缬氨酸、甘氨酸溶液混合。
3、显色剂:50~100mL0.5%水合茚三铜正丁醇容液。
四、操作步聚1.检查培养皿是否干燥、洁净;若否,将其洗净并置于干燥箱内100℃烘干。
2.平衡:剪一大块塑料薄膜铺在桌面上,将大烧杯到置于塑料薄膜上,再把盛有约20mL 展层溶液的小烧杯置于倒置的大烧杯中,用塑料薄膜密封起来,平衡20min。
实验三氨基酸的分离鉴定--纸层析法学时数:4学时一、目的:学习分配层析的原理;掌握氨基酸纸层析法的操作技术要点;并了解氨基酸的呈色反应原理。
二、原理:※分配层析是利用不同的物质在两个互不相溶的溶剂中的分配系数不同而得到分离的。
混合物之间的分配系数相差越大,越容易分开。
通常用α表示分配系数。
一个物质在某溶剂系统中的分配系数,在一定温度下是一个常数。
※纸层析是以滤纸作为惰性支持物的分配层析,纸纤维上的-OH具有亲水性,因此能吸附一层水作为固定相,有机溶剂通常作为流动相。
流动相流经支持物时与固定相之间连续抽提,使物质在两相之间不断分配而得到分离。
※氨基酸层析图谱常用茚三酮作显色剂。
氨基酸被分离后,在层析图谱上的位置用R f(比移)表示。
R f的主要决定因素是分配系数,另外还与物质的结构、溶剂系统、滤纸质量及层析温度等条件有关。
三、器材:层析缸、毛细管、喷雾器、层析滤纸、电吹风四、试剂:展层剂(水饱和的正丁醇与醋酸的混合物)、氨基酸溶液(Pro、Val、Leu 及其混合液)、茚三酮显色剂五、步骤:(取滤纸时,始终拿滤纸边缘)1、平衡:将展层剂置于层析缸中进行平衡。
2、标记:取层析滤纸一张,在纸的一端距边缘2-3cm处用铅笔划一直线,在此直线上,每隔2-3cm做一记号(点样点)。
3、点样:用毛细管将各氨基酸样品分别点在标记的位置上,干后在原来点样位置再点一次(可用吹风机吹干,但要控制温度不能太高)。
注意,每点的扩散直径不能超过3mm。
4、展层:用线将滤纸缝成筒状(用透明胶粘也可以),注意滤纸的两边不能接触!!缝好后,将滤纸直立于层析缸中。
(点样端在下,展层剂的液面需低于点样线)待溶剂上升15cm左右(约40min),取出滤纸,用铅笔描出溶剂前沿界线,吹风机吹干。
5、显色:用喷雾器均匀喷上茚三酮显色液(要离开滤纸一定距离且要直立喷洒,显色液在滤纸上不能成柱状流下);热风吹干,可见显色的各层析斑点。
6、计算:计用直尺量出原点到溶剂前沿及各层析点中心的距离,分别计算R f值;并通过比较单种氨基酸样品与混合液中氨基酸的R f值,指出相对应的氨基酸。
氨基酸的分离鉴定实验报告
《氨基酸的分离鉴定实验报告》
实验目的:通过对氨基酸的分离和鉴定实验,掌握氨基酸的分离技术和鉴定方法,提高实验操作能力和数据分析能力。
实验原理:氨基酸是生命体系中的重要有机分子,它们是蛋白质的组成单位。
在实验中,我们将利用离心分离、薄层色谱等技术,对氨基酸进行分离和鉴定。
实验步骤:
1. 将混合氨基酸样品溶解在适量的溶剂中,得到氨基酸溶液。
2. 利用离心技术,将氨基酸溶液中的杂质分离出来,得到纯净的氨基酸溶液。
3. 将纯净的氨基酸溶液加载到薄层色谱板上,进行薄层色谱分离。
4. 根据薄层色谱结果,对氨基酸进行鉴定和定量分析。
实验结果:
经过离心分离和薄层色谱分离,我们成功地分离出了混合氨基酸样品中的各种
氨基酸,并且得到了它们的定量数据。
通过比对标准氨基酸的色谱图谱,我们
成功地鉴定出了样品中的各种氨基酸成分。
实验结论:
通过本次实验,我们掌握了氨基酸的分离技术和鉴定方法,提高了实验操作能
力和数据分析能力。
同时,我们对氨基酸的结构和性质有了更深入的了解,为
今后的科研工作打下了坚实的基础。
总结:氨基酸的分离鉴定实验是一项重要的生物化学实验,通过本次实验,我
们不仅掌握了氨基酸的分离技术和鉴定方法,还提高了实验操作能力和数据分
析能力,为今后的科研工作提供了有力支持。