初三化学下学期常见气体的制备和验证
- 格式:pdf
- 大小:1.10 MB
- 文档页数:8


初中化学常用气体制备教案
教学目标:通过本课的学习,使学生了解常用气体的制备方法,掌握实验操作技巧,培养
学生的实验能力和创新思维。
教学重点:氢气、氧气、氯气、二氧化碳的制备方法及实验操作技巧。
教学难点:氯气和二氧化碳的制备方法及注意事项。
教学准备:硫酸、锌、烧瓶、试管、碳酸氢钠、稀盐酸、氢氧化钠、氯化铵、酸性高锰酸
钾溶液等实验器材和试剂。
教学过程:
1. 氢气的制备及实验操作技巧
a. 实验操作:在烧瓶中放入适量的锌片,加入盖子后,通过试管将稀盐酸滴入烧瓶中,
观察气体生成情况。
b. 实验方法:将氢气通过水中进行收集,用火柴点燃氢气,观察氢气的燃烧现象。
2. 氧气的制备及实验操作技巧
a. 实验操作:在烧瓶中放入碳酸氢钠,加入烧热过的氢氧化钠,通入氧气,观察气体生
成情况。
b. 实验方法:将氧气通过水中进行收集,用燃烧的木条点燃氧气,观察氧气的燃烧现象。
3. 氯气的制备及实验操作技巧
a. 实验操作:在烧瓶中放入氯化铵,加入酸性高锰酸钾溶液,观察气体生成情况。
b. 实验方法:将氯气通过水中进行收集,用火柴点燃氯气,观察氯气的燃烧现象。
4. 二氧化碳的制备及实验操作技巧
a. 实验操作:在烧瓶中放入碳酸氢钠,加入稀盐酸,观察气体生成情况。
b. 实验方法:将二氧化碳通过水中进行收集,用火柴点燃一根蜡烛后,将蜡烛熄灭后的
烟团与二氧化碳气体接触,观察烟团的变化。
教学总结:通过本次实验,学生掌握了常用气体的制备方法和实验操作技巧,对氢气、氧气、氯气、二氧化碳的性质有了更加深入的了解,培养了学生的实验技能和思维能力。

气体制备和检验方法(一)、中学阶段常见气体的工业制法和实验室制法归纳1.氢气(1)工业制法:①水煤气法:(高温条件下还原水蒸气)单质+化合物化合物+单质:C+H2O(g)CO+H2;化合物+化合物化合物+单质:CO+ H2O(g) CO2+H2②氯碱工业的副产物:(电解饱和食盐水)溶液A+B+C :2NaCl+2H2O2NaOH +H2↑+ Cl2↑,(2)实验室制法:活泼金属与非氧化性强酸的置换反应:单质+化合物化合物+单质:Zn+H2SO4=ZnSO4+H2↑2.二氧化碳(1)工业制法:高温分解,煅烧大理石:CaCO3CaO+CO2↑(2)实验室制法:复分解反应:碳酸钙与盐酸的反应:CaCO3+2HCl=CaCl2+H2O+CO2↑3.氨气(1)工业制法化合反应:合成氨工业N2+3H2 2NH3(2)实验室制法①氯化铵和消石灰混合受热制备氨气:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O②浓氨水滴入到生石灰(烧碱或碱石灰)表面快速产生氨气。
NH3·H2O+CaO=NH3↑+Ca(OH)24.一氧化氮(1)工业制法:①二氧化氮溶于水制硝酸的副产物:3NO2+H2O=2HNO3+NO②氨气催化氧化制备一氧化氮(硝酸工业的第一步反应):4NH3+5O24NO+6H2O(2)实验室制法: 铜和稀硝酸反应制备一氧化氮:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O5.二氧化氮(1)工业制法: 一氧化氮氧化制二氧化氮:(硝酸工业的第二步反应):2NO+O2=2NO2(2)实验室制法: 铜和浓硝酸反应制备二氧化氮:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 6.氧气(1)工业制法:分离液态空气(2)实验室制法:①双氧水催化分解:2H2O22H2O+O2↑②高锰酸钾受热分解:2KMnO4K2MnO4+MnO2+O2↑③氯酸钾受热分解:2KClO32KCl+3O2↑7.二氧化硫(1)工业制法:①高温煅烧硫铁矿得到二氧化硫:4FeS2+11O22Fe2O3+8SO2②火法炼铜得到副产物二氧化硫:Cu2S+O22Cu+SO2③燃烧硫磺得到二氧化硫:S+O2SO2(2)实验室制法:①在加热条件下铜还原浓硫酸:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O②亚硫酸钠和硫酸发生复分解反应:Na2SO3+ H2SO4(浓)=Na2SO4+H2O+SO2↑8.氯气(1)工业制法:①电解饱和食盐水得到烧碱、氢气和氯气:2NaCl+2H2O2NaOH +H2↑+ Cl2↑②冶炼钠时得到钠和氯气:2NaCl(熔融)2Na + Cl2↑③冶炼镁时得到镁和氯气:MgCl2(熔融)Mg + Cl2↑(2)实验室制法:①常温氧化浓盐酸:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O②加热氧化浓盐酸:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O9.氯化氢(1)工业制法:氢气在氯气中燃烧产生氯化氢:H2+Cl22HCl(2)实验室制法:①复分解反应制备氯化氢气体:2NaCl+H2SO4(浓)Na2SO4+2HCl ↑②浓硫酸滴入到浓盐酸中快速制备氯化氢气体。



化学实验教案:常见气体的制备一、引言化学实验是提高学生实际操作能力和培养科学思维的重要环节之一。
在化学教育中,常见气体的制备是基础实验之一。
通过制备常见气体,学生可以掌握气体的性质、制备方法以及相关实验技术,并加深对化学原理的理解。
本篇文章将探讨几种常见气体的制备方法,包括氧气、氢气、二氧化碳和氮气。
二、制备氧气1. 实验目的:了解制备氧气的方法。
2. 所需材料:过量的高锰酸钾(KMnO4)和稀盐酸(HCl),玻璃烧杯,玻璃漏斗。
3. 实验步骤:- 取适量高锰酸钾粉末放入玻璃烧杯中;- 在高锰酸钾上方加入稀盐酸,在其产生泡沫时停止通入;- 将通有空气泡的盛有水的玻璃漏斗口放在试管或水槽中,并连好胶皮管;- 用火源加热含有稀盐酸的高锰酸钾;- 当稀盐酸与高锰酸钾反应产生氧气时,气泡顺胶皮管进入漏斗,最终在水中收集。
三、制备氢气1. 实验目的:熟悉制备氢气的方法。
2. 所需材料:活性锌粉,稀盐酸(HCl),玻璃烧杯,玻璃漏斗。
3. 实验步骤:- 取适量活性锌粉末放入玻璃烧杯中;- 在活性锌上方加入稀盐酸;- 将通有空气泡的盛有水的玻璃漏斗口放在试管或水槽中,并连好胶皮管;- 用火源加热含有稀盐酸的活性锌;- 当稀盐酸与活性锌反应产生氢气时,气泡顺胶皮管进入漏斗,最终在水中收集。
四、制备二氧化碳1. 实验目的:了解制备二氧化碳的方法。
2. 所需材料:大理石颗粒或发芽粉末,稀盐酸(HCl),玻璃反应瓶,试管。
3. 实验步骤:- 在玻璃反应瓶中放入适量的大理石颗粒或发芽粉末;- 加入足够的稀盐酸;- 用塞子封住玻璃反应瓶口,并在塞子上开一个小孔;- 把试管的一端插在小孔上,并将另一端浸入水中;- 当大理石和稀盐酸反应时产生二氧化碳气体,气泡经试管进入水中。
五、制备氮气1. 实验目的:掌握制备氮气的方法。
2. 所需材料:铜和高温流动空气,玻璃反应管。
3. 实验步骤:- 将铜片放入预先加热的玻璃反应管中;- 使用高温流动空气吹嘴吹风,并通过反应器中;- 等待一段时间,直到铜与空气发生反应生成黑色固体为止;- 随后关闭高温流动空气通道并升降漏斗进行冷却;- 可从底部取出冷却后的管子,其中氮气浓度较高。


常见气体的实验室制取和检验⑴氧气制取原理——含氧化合物自身分解 制取方程式——2KClO 32KCl+3O 2↑ 装置——略微向下倾斜的大试管,加热 检验——带火星木条,复燃 收集——排水法或向上排气法 ⑵氢气制取原理——活泼金属与弱氧化性酸的置换 制取方程式——Zn+H 2SO 4 === H 2SO 4+H 2↑ 装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠 收集——排水法或向下排气法 ⑶氯气制取原理——强氧化剂氧化含氧化合物 制取方程式——MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O 装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气) 收集——排饱和食盐水法或向上排气法尾气回收——Cl 2+2NaOH=== NaCl+NaClO+H 2O ⑷硫化氢制取原理——强酸与硫化物的复分解反应 制取方程式——FeS+2HCl=== FeCl 2+H 2S↑ 装置——启普发生器检验——能使湿润的醋酸铅试纸变黑除杂质——先通入饱和NaHS 溶液(除HCl),再通入固体CaCl 2(或P 2O 5)(除水蒸气)收集——向上排气法尾气回收——H 2S+2NaOH=== Na 2S+H2O 或H 2S+NaOH=== NaHS+H 2O ⑸二氧化硫制取原理——稳定性强酸与不稳定性弱酸盐的复分解 制取方程式——Na 2SO 3+H 2SO 4=== Na 2SO 4+SO 2↑+H 2O 装置——分液漏斗,圆底烧瓶检验——先通入品红试液,褪色,后加热又恢复原红色; 除杂质——通入浓H 2SO 4(除水蒸气) 收集——向上排气法尾气回收——SO 2+2NaOH=== Na 2SO 3+H 2O ⑹ 二氧化碳制取原理——稳定性强酸与不稳定性弱酸盐的复分解 制取方程式——CaCO 3+2HCl===CaCl 2+CO 2↑+H 2O 装置——启普发生器检验——通入澄清石灰水,变浑浊除杂质——通入饱和NaHCO 3溶液(除HCl),再通入浓H 2SO 4(除水蒸气) 收集——排水法或向上排气法 ⑺ 氨气制取原理——固体铵盐与固体强碱的复分解 制取方程式——Ca(OH)2+2NH4Cl CaCl 2+NH 3↑+2H 2O 装置——略微向下倾斜的大试管,加热 检验——湿润的红色石蕊试纸,变蓝 除杂质——通入碱石灰(除水蒸气) 收集——向下排气法⑻氯化氢制取原理——高沸点酸与金属氯化物的复分解制取方程式——2NaCl+H2SO 4Na2SO4+2HCl↑装置——分液漏斗,圆底烧瓶,加热检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶除杂质——通入浓硫酸(除水蒸气)收集——向上排气法简单方法:将浓硫酸滴入浓盐酸中。
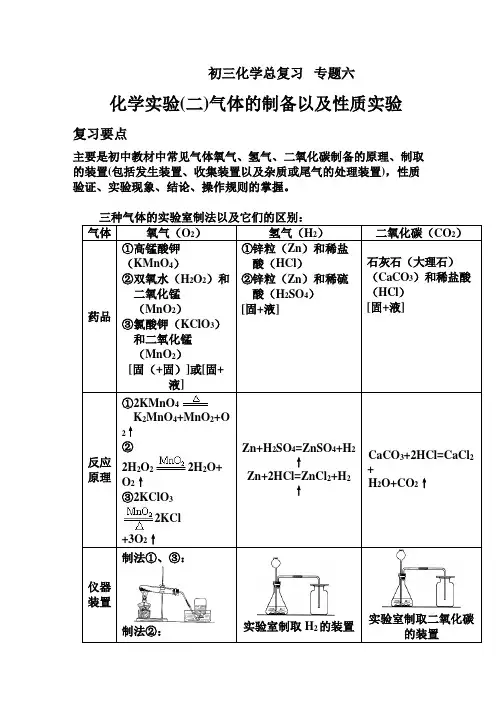
初三化学总复习专题六化学实验(二)气体的制备以及性质实验复习要点主要是初中教材中常见气体氧气、氢气、二氧化碳制备的原理、制取的装置(包括发生装置、收集装置以及杂质或尾气的处理装置),性质验证、实验现象、结论、操作规则的掌握。
三种气体的实验室制法以及它们的区别:气体氧气(O2)氢气(H2)二氧化碳(CO2)药品①高锰酸钾(KMnO4)②双氧水(H2O2)和二氧化锰(MnO2)③氯酸钾(KClO3)和二氧化锰(MnO2)[固(+固)]或[固+液]①锌粒(Zn)和稀盐酸(HCl)②锌粒(Zn)和稀硫酸(H2SO4)[固+液]石灰石(大理石)(CaCO3)和稀盐酸(HCl)[固+液]反应原理①2KMnO4K2MnO4+MnO2+O2↑②2H2O22H2O+O2↑③2KClO32KCl+3O2↑Zn+H2SO4=ZnSO4+H2↑Zn+2HCl=ZnCl2+H2↑CaCO3+2HCl=CaCl2+H2O+CO2↑仪器装置制法①、③:制法②:实验室制取H2的装置实验室制取二氧化碳的装置检验用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气通入澄清的石灰水,看是否变浑浊,若浑浊则是CO2。
收集方法①排水法(不易溶于水)②瓶口向上排空气法(密度比空气大)①排水法(难溶于水)②瓶口向下排空气法(密度比空气小)①瓶口向上排空气法(密度比空气大)(不能用排水法收集)验满(验纯)用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满<1>用拇指堵住集满氢气的试管口;<2>靠近火焰,移开拇指点火若噗的一声,氢气已纯;若有尖锐的爆鸣声,则氢气不纯用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满;否则没满放置正放倒放正放注意事项①检查装置的气密性(当用第一种药品制取时以下要注意)②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流入试管底部使试管破裂)③加热时应先使试管均匀受热,再集中在药品部位加热。


常见的气体制备方法及实验注意事项一、概述气体的制备方法是实验室中常见的工作之一,在各个科学领域都有广泛的应用。
本文将介绍几种常见的气体制备方法,并提供相关的实验注意事项。
二、常见气体制备方法1. 反应法反应法是一种常见的气体制备方法,通过化学反应产生气体。
例如,通过与酸反应得到氢气,如HCl + Zn → ZnCl2 + H2。
在进行反应法制备气体时,需要注意以下几点:- 需要知道反应的热力学条件,包括反应物的摩尔比例和反应温度。
- 注意选择反应容器,确保容器具有良好的耐腐蚀性。
- 实验操作时要注意安全,避免与有毒、易燃气体接触。
2. 分解法分解法是指通过化学反应使某种物质分解产生气体。
例如,过氧化氢分解成水和氧气,如2H2O2 → 2H2O + O2。
在进行分解法制备气体时,需要注意以下几点:- 确定分解反应的条件,包括温度、催化剂等。
- 注意选择合适的反应器和催化剂,以提高分解反应的效率。
- 实验时需注意分解产物的收集和储存方式,避免与有机物或易燃物接触。
3. 溶液法溶液法是一种通过将溶质溶解于溶剂中得到气体的制备方法。
例如,通过溶解氢氧化钠或氢氧化钾得到氨气,如2N aOH + NH4Cl →Na2SO4 + 2H2O + NH3。
在进行溶液法制备气体时,需要注意以下几点:- 确定溶质和溶剂的摩尔比例,保证溶液的浓度适宜。
- 选择适当的反应容器和搅拌装置,以促进反应的进行。
- 注意使用耐腐蚀的实验仪器和容器,避免产生有毒气体。
三、实验注意事项1. 安全措施气体制备实验过程中需要严格遵守实验室安全规定:- 确保实验室通风良好,避免有毒气体积聚。
- 使用个人防护装备,如实验手套、护目镜等。
- 避免与易燃物接触,并确保实验室远离明火。
2. 仪器设备- 选择适当的实验仪器和设备,确保其耐腐蚀性和密封性。
- 注意对仪器设备进行正确的操作和维护,以保证实验的准确性和安全性。
3. 质量测量- 在进行气体制备实验时,需要对反应物的质量进行准确测量,以保证制备的气体质量的准确性。
常见气体的制备和检验易错知识点辨析:1.气体的制备要依据反应物的状态、反应发生的条件。
一般气体的发生装置分为两套:固体与固体加热制气体或固体与液体不加热制气体。
2.气体的收集要依据气体的密度和水溶性。
气体难溶于水且不与水反应可用排水集气法收集;气体密度小于空气(相对分子质量小于29)且不与空气中的成分反应可用向下排空气法收集;气体密度大于空气(相对分子质量大于29)且不与空气中的成分反应可用向上排空气法收集。
3.气体的检验要依据气体的特性。
4.气体干燥和净化,先净化后干燥。
除去气体中的水蒸气叫做气体的干燥。
常用浓硫酸、固体氢氧化钠做干燥剂。
气体净化指的是气体和气体或其他杂质的分离方法。
采用的方法是将混合气体通过装在洗气瓶里的某试剂的溶液,利用所需要的气体不与该试剂反应,也不溶在水里,而其他不需要的气体杂质,能和该试剂反应生成难挥发的物质,留在洗气瓶里,达到分离的目的。
一、五年中考1.(2011.南京中考)下列是与人类的生活与未来密切相关的物质:A.甲烷;B.酒精;C.石油;D.氢气。
选择相应的编号填空。
①是实验室常用的燃料②可以提供清洁、高效的氢能③是天然气的主要成分④经过加热分馏可得到汽油、柴油、石蜡等2.(2011.南京中考)20. 在相同的温度和压强下,相同体积的气体具有相同的分子数,反之亦然。
取同温同压下相同体积的CO和O2混合,在一定条件下充分反应,恢复到初始温度和压强。
下列说法正确的是A. 参加反应的CO和O2的体积比为2:1B. 生成的CO2分子个数为原来气体分子数的三分之二C. 反应后气体的体积为原来的四分之三D. 反应后的气体中C、O原子的个数比为1:23.(2009.南京中考)根据下列装置图.回答有关问题:(1)写出装置中标号仪器的名称:①;②。
(2)实验室用高锰酸钾制取氧气,可选用的发生装置是(填字母)。
(3)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式,并据此选择上图中(填字母)组装一套制取于燥氧气的装置,收集氧气时,验满的方法是。