高考化学二轮复习第八章水溶液中的离子平衡8.4难溶电解质的溶解平衡课件
- 格式:ppt
- 大小:2.66 MB
- 文档页数:70


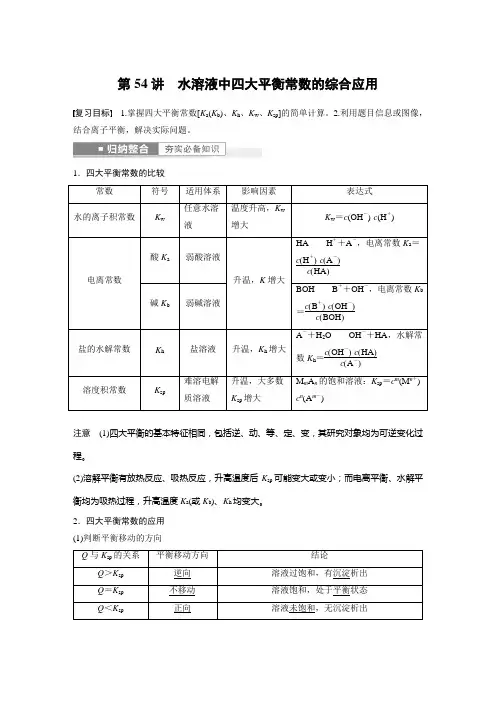
第54讲水溶液中四大平衡常数的综合应用复习目标 1.掌握四大平衡常数[K a(K b)、K h、K w、K sp]的简单计算。
2.利用题目信息或图像,结合离子平衡,解决实际问题。
1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w 任意水溶液温度升高,K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp 难溶电解质溶液升温,大多数K sp增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)注意(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a(或K b)、K h均变大。
2.四大平衡常数的应用(1)判断平衡移动的方向Q与K sp的关系平衡移动方向结论Q>K sp逆向溶液过饱和,有沉淀析出Q=K sp不移动溶液饱和,处于平衡状态Q<K sp正向溶液未饱和,无沉淀析出(2)常数间的关系 ①强碱弱酸盐:K h =K w K a ;②强酸弱碱盐:K h =K wK b。
(3)判断离子浓度比值的大小变化。
如将NH 3·H 2O 溶液加水稀释,c (OH -)减小,由于电离平衡常数为c (NH +4)·c (OH -)c (NH 3·H 2O ),此值不变,故c (NH +4)c (NH 3·H 2O )的值增大。

![[原创]2015年《南方新课堂·高考总复习》化学 第八单元 第4节 难溶电解质的溶解平衡[配套课件]](https://uimg.taocdn.com/7702861a5f0e7cd184253624.webp)



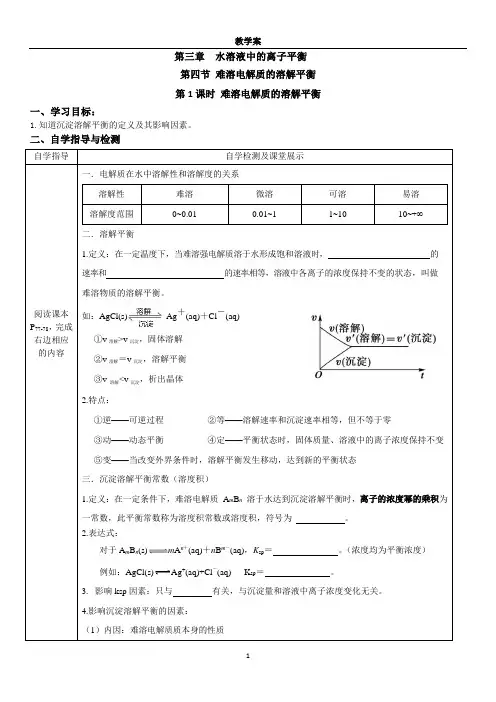
第三章水溶液中的离子平衡第四节难溶电解质的溶解平衡第1课时难溶电解质的溶解平衡一、学习目标:1.知道沉淀溶解平衡的定义及其影响因素。
二、自学指导与检测自学指导自学检测及课堂展示阅读课本P77-78,完成右边相应的内容一.电解质在水中溶解性和溶解度的关系溶解性难溶微溶可溶易溶溶解度范围0~0.01 0.01~1 1~10 10~+∞二.溶解平衡1.定义:在一定温度下,当难溶强电解质溶于水形成饱和溶液时,的速率和的速率相等,溶液中各离子的浓度保持不变的状态,叫做难溶物质的溶解平衡。
如:AgCl(s)Ag+(aq)+Cl-(aq)①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体2.特点:①逆——可逆过程②等——溶解速率和沉淀速率相等,但不等于零③动——动态平衡④定——平衡状态时,固体质量、溶液中的离子浓度保持不变⑤变——当改变外界条件时,溶解平衡发生移动,达到新的平衡状态三.沉淀溶解平衡常数(溶度积)1.定义:在一定条件下,难溶电解质A m B n溶于水达到沉淀溶解平衡时,离子的浓度幂的乘积为一常数,此平衡常数称为溶度积常数或溶度积,符号为。
2.表达式:对于A m B n(s)m A n+(aq)+n B m-(aq),K sp=。
(浓度均为平衡浓度)例如:AgCl(s)Ag+(aq)+Cl-(aq) K sp=。
3.影响ksp因素:只与有关,与沉淀量和溶液中离子浓度变化无关。
4.影响沉淀溶解平衡的因素:(1)内因:难溶电解质质本身的性质(2)外因①温度:溶解平衡一般是的,温度升高平衡,K sp,但Ca(OH)2相反。
②浓度:加水稀释,沉淀溶解平衡向的方向移动(溶解的溶解质增多),但K SP ,溶解度S 不变③同离子效应:向平衡体系中加入与体系中相同的离子,平衡向的方向移动,但K SP,溶解度S 减小;如:AgCl 中加入KCl(S),则c(Ag+)减小、c(Cl—)增大,此时c(Ag+)≠c(Cl—)④向体系中加入能与体系中离子反应生成更难溶的电解质或气体的离子,则平衡向的方向移动。


第8章(水溶液中的离子平衡)李仕才第四节难溶电解质的溶解平衡考点一沉淀溶解平衡及应用1.沉淀溶解平衡(1)定义:在一定温度下,当沉淀溶解速率和沉淀生成速率相等时,形成饱和溶液,达到平衡状态,把这种平衡称之为沉淀溶解平衡。
(2)沉淀溶解平衡的建立:固体溶质溶解沉淀溶液中的溶质⎩⎪⎨⎪⎧①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体(3)特点:(适用勒夏特列原理)(4)影响因素①内因难溶电解质本身的性质。
溶度积(K sp)反映难溶电解质在水中的溶解能力。
对同类型的电解质而言,K sp数值越大,电解质在水中溶解度越大;K sp数值越小,难溶电解质的溶解度也越小。
②外因a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但K sp不变。
b.温度:多数难溶电解质的溶解过程是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时K sp变大。
c.同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动,但K sp 不变。
d.其他:向沉淀溶解平衡体系中,加入可与体系中某些离子反应生成更难溶或气体的离子,使平衡向溶解的方向移动,K sp不变。
以BaCO3(s)Ba2+(aq)+CO2-3(aq) ΔH>0为例2.沉淀溶解平衡的应用(1)沉淀的生成加入沉淀剂,应用同离子效应,控制溶液的pH,当Q c>K sp时,有沉淀生成。
可利用生成沉淀来达到分离或除去某些离子的目的。
(2)沉淀的溶解当Q c<K sp时,沉淀发生溶解。
(3)沉淀的转化判断正误(正确的打“√”,错误的打“×”)1.沉淀达到溶解平衡状态,溶液中各离子浓度一定相等。
( ×)2.升高温度,沉淀溶解平衡一定正向移动。
( ×)3.某物质的溶解性为难溶,则该物质不溶于水。
( ×)4.因溶解度小的沉淀易向溶解度更小的沉淀转化,故ZnS沉淀中滴加CuSO4溶液可以得到CuS 沉淀。
2019高考化学总复习第八章水溶液中的离子平衡8-4-2 考点二溶度积常数及应用基础小题快练新人教版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019高考化学总复习第八章水溶液中的离子平衡8-4-2 考点二溶度积常数及应用基础小题快练新人教版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019高考化学总复习第八章水溶液中的离子平衡8-4-2 考点二溶度积常数及应用基础小题快练新人教版的全部内容。
8-4—2 考点二溶度积常数及应用一、K sp的理解计算和应用1.下列说法不正确的是( )A.K sp只与难溶电解质的性质和温度有关B.由于K sp(ZnS)>K sp(CuS),所以ZnS沉淀在一定条件下可转化为CuS 沉淀C.其他条件不变,离子浓度改变时,K sp不变D.两种难溶电解质作比较时,K sp小的溶解度一定小解析:只有相同类型的难溶电解质作比较时,K sp小的,溶解度一定小。
答案:D2.已知25 ℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO错误!(aq),K sp=1.102 5×10-10,下列有关BaSO4的溶度积和溶解平衡的叙述正确的是()A.25 ℃时,向c(SO错误!)=1.05×10-5mol·L-1的BaSO4溶液中,加入BaSO4固体,c(SO错误!)增大B.向该饱和溶液中加入Ba(NO3)2固体,则BaSO4的溶度积常数增大C.向该饱和溶液中加入Na2SO4固体,则该溶液中c(Ba2+)>c(SO错误!) D.向该饱和溶液中加入BaCl2固体,则该溶液中c(SO错误!)减小解析:BaSO4的溶度积等于c(Ba2+)和c(SO错误!)的乘积,故饱和溶液中c(SO错误!)=1。
第4讲 难溶电解质的沉淀溶解平衡[考纲要求] 1.了解难溶电解质的沉淀溶解平衡。
2.了解难溶电解质的沉淀转化的本质。
考点一 溶解平衡和溶度积常数 1.沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成____________时,________速率和____________速率相等的状态。
2.溶解平衡的建立固体溶质 溶解沉淀溶液中的溶质 (1)v 溶解____v 沉淀,固体溶解 (2)v 溶解____v 沉淀,溶解平衡 (3)v 溶解____v 沉淀,析出晶体 3.溶解平衡的特点4.电解质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:5.溶度积和离子积 以A m B n (s)m A n +(aq)+n B m -(aq)为例:溶度积离子积概念 ________的平衡常数溶液中有关离子____幂的乘积符号 K spQ c表达式K sp (A m B n )=______________,式中的浓度都是平衡浓度Q c (A m B n )=______________,式中的浓度是任意浓度应用判断在一定条件下沉淀能否生成或溶解①Q c ____K sp :溶液过饱和,有沉淀析出②Q c ____K sp :溶液饱和,处于平衡状态③Q c ____K sp :溶液未饱和,无沉淀析出6.K sp 的影响因素(1)内因:难溶物质本身的性质,这是主要决定因素。
(2)外因①浓度:加水稀释,平衡向________方向移动,但K sp________________。
②温度:绝大多数难溶盐的溶解是________过程,升高温度,平衡向________方向移动,K sp________。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但K sp不变。
1.难溶的氯化银在水中也存在着溶解平衡AgCl(s) Ag+(aq)+Cl-(aq),怎样用实验证明溶液中可以同时存在着少量的Ag+和Cl-?2.(1)0.1 mol·L-1的盐酸与0.1 mol·L-1的AgNO3溶液等体积混合完全反应后溶液中含有的微粒有________________________。
第八章水溶液中的离子反应与平衡第8讲沉淀溶解平衡图像课标要求核心考点五年考情核心素养对接认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化沉淀溶解平衡图像分析2023新课标卷,T13;2023全国乙,T13;2023全国甲,T13;2023辽宁,T15;2022湖南,T10;2021全国乙,T13;2021全国甲,T12;2019全国Ⅱ,T12;2019海南,T9变化观念与平衡思想:难溶电解质的沉淀溶解平衡图像中曲线上的点处于动态平衡命题分析预测1.高考中常以c (A m +)或c (B n -)、pA m +[pA m +=-lg c (A m +)]或pB n -[pB n -=-lg c (B n -)]、温度(T )、V (加入溶液体积)等为纵、横轴形成的二维图像为载体,考查K sp 的应用、沉淀溶解平衡移动时相关量的变化或计算。
2.沉淀溶解平衡图像是高考高频考点,难度较大,侧重对考生创新思维和创新意识的考查,预计2025年高考仍会延续这种考查考点沉淀溶解平衡图像分析1.沉淀溶解平衡浓度图像模型图像分析BaSO 4的沉淀溶解平衡图像(1)求K sp或K sp的数量级:A点,c(Ba2+)=c(S O42-)=10-5 mol·L-1,K sp(BaSO4)=[1]10-10。
(2)曲线上任意一点都达到了沉淀溶解平衡状态,Q c[2]=K sp。
温度不变时,K sp不变,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
曲线上方区域的点所示溶液均为[3]过饱和溶液,Q c[4]>K sp。
曲线下方区域的点所示溶液均为[5]不饱和溶液,Q c[6]<K sp2.沉淀溶解平衡对数图像模型图像分析CaSO4与CaCO3的沉淀溶解平衡图像注:pM=pCa2+=-lg c(Ca2+),pR=pS O42-(或pC O32-)=-lg c(S O42-)[或-lg c(C O32-)](1)曲线上任意一点都达到了沉淀溶解平衡状态。