反应动力学 习题及答案
- 格式:doc
- 大小:91.50 KB
- 文档页数:7

第六章 化学反应动力学思考题解答一、是非题(判断下列说法是否正确,并说明理由)1. 错2. 对3. 错4. 错5. 错6. 错7. 对8. 对9.错 10. 对 二、选择题1. B2. A.3. B.4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C.习题解答1.请根据质量作用定律,写出下列各基元反应或复合反应中Ad d c t与各物质浓度的关系。
(1)2A + B 2P k−−→ (2)A + 2B P + 2S k−−→ (3)22A + M A M k−−→+ (4)2A B (5)2A 2B+D B+A 2D(6)解:(1)2A A B d 2d c kc c t -= (2)2A A Bd d c kc c t -=(3)2A A M d 2d c kc c t -= (4)2A 2B 1A d 2+2d c k c k c t -=- (5)222A 1B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=--(6)A 1A 2A 3C d d ck c k c k c t-=+-2.某人工放射性元素放出α粒子,半衰期为15min 。
试问多长时间后该试样能分解掉80%。
解:由题意得该反应为一级反应,符合一级反应的条件,则112ln 2t k =得 1k = ln 215=0.0462mol -1 由积分定义式 1ln ak t a x=- 令0.8xy a==得 11ln 1k t y =- 则 t=34.84mink 1 k-1 k 1 k-1 k k3.反应25222N O (g)4NO (g)O (g)−−→+,在318K 下测得N 2O 5的浓度如下: t /min 0 20 40 60 80 100 120 140 160 c /mol·m -317.69.735.462.951.670.940.500.280.16求该反应的级数和速率常数及半衰期。

第4章 反应动力学初步一、选择题 4-1 利用反应生成产物B ,在动力学上要求 ( )(A) (B) (C) (D)答案: B 4-2 对的反应使用催化剂可以 ( )(A) 大大加速 (B) 减速(C)、皆加速 (D) 无影响答案: C4-3 催化剂能加速反应的速率,它的作用机理是 ( ) (A) 增大碰撞频率 (B) 改变反应途径,降低活化能 (C) 减少速率常数 (D) 增大平衡常数 答案: B4-4 下列有关活化能的叙述不正确的是 ( ) (A) 不同反应具有不同的活化能(B) 同一条件下同一反应的活化能越大,其反应速率越小 (C) 同一反应的活化能越小,其反应速率越小(D) 活化能可以通过实验来测定 答案: C4-5 已知下列两个反应的活化能:(1)(2)在同一温度下,所有反应物浓度为1,下列说法不正确的是 ( ) (A) 反应(1)比反应(2)的速率慢。
(B) (A) 反应(1)比反应(2)的速率快。
(C)受温度的影响较小。
(D) 对于反应(1)与反应(2),当温度变化的始态、终态相同时,反应(2)的反应速率(或速率常数)的改变比反应(1)显著的多。
13 2A B C −−→−−→←−−123a a a E E E >>123a a a E E E <<123a a a E E E >=123a a a E E E =<0r G ∆>v 正v 正v 正v 负42284224243(NH )S O + 3KI (NH )S O + K SO + KI →1-156.7kJ mol a E =⋅2222SO + O 2SO →2-1250.8kJ mol a E =⋅-1mol L ⋅12a a E E 和答案: A 4-6 已知反应 的反应历程是:(1) (快)(2)(慢)此反应的速率方程可能是 ( ) (A) (B)(C) (D)答案:C4-7 下列说法正确的是 ( ) (A) 一个化学反应的越负,在温度T 下,反应的速率就越大。

第八章 复杂反应动力学8-1.对于平行反应 CB A 21−→−−→−k k ┤,设E a 、E 1、E 2分别为总反应的表观活化能和两个平行反应的活化能,证明存在以下关系式:E a = (k 1E 1 + k 2E 2)/(k 1 + k 2) 。
证明: 总速率: - d[A]/d t = k 1[A] + k 2[A] = (k 1 + k 2)[A] = k '[A]其中 k ' = k 1 + k 2 = Ae x p(-E '/RT ), ∵2'd 'ln d RTE T k = 又∵Tk k k k T k k T k d )d(1d )dln(d 'ln d 212121+⋅+=+=⎪⎪⎭⎫⎝⎛+⨯+=⎪⎭⎫ ⎝⎛+⨯+=T k k k T k k k k k T k T kk k d d d d 1d d d d 1222111212121⎪⎭⎫ ⎝⎛+⨯+=⎪⎭⎫ ⎝⎛+⨯+=222211212211211d ln d d ln d 1RT E k RT E k k k T k k T k k k k21221121k k E k E k RT ++⨯=所以 212211'k k E k E k E ++=8-2.醋酸高温裂解制乙烯酮,副反应生成甲烷 CH 3COOH —k 1→CH 2=CO +H 2O CH 3COOH —k 2→CH 4+CO 2已知在1189k 时k 1=4.65s -1,k 2=3.74s -1。
试计算: (1)99%醋酸反应需要的时间;(2)在1189 K 时,乙烯酮的最高效率? 如何提高选则性? 解: A B C t =0 a 0 0 t =t x y z(1) ln(a /x )=(k 1+k 2)t x =(1-0.99)a =0.01at =[ln(a /0.01a )]/(k 1+k 2) =(ln100)/(4.65+3.74)=0.5489s (2) y /z =k 1/k 2=4.65/3.74=1.243 z =0.4414a 解得 :y +z =a -x =0.99a y =0.5486a收率,就是产率=产品量/转化反应物量=0.5486a /0.99a =55.42%由于k 1与k 2 相差不大,说明两者解离能相差不大,改变温度效果不好。

第07章基元反应动力学习题及答案第07章基元反应动力学习题及答案3第七章 基元化学反应动力学习题及答案1. N 2O 5在25℃时分解反应的半衰期为5.7h, 且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应 111216.07.56932.06932.021-===h t kt k y1)11ln(=-h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-=即完成90%所需时间为18.9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1 =5.4×1011exp(-122 474 J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101 325 Pa ,问多长时间后,丙烯酮的分压可达54 kPa ?解:k /S-1=5.4×1011exp[-122474/8.314×(150+273)] =4.055×10-4据题意:ktppt=0ln4t410005.454000101325101325ln-⨯=-t =1877S3. 双分子反应2A(g)−→−kB(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出(1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol -1, 573K 时的最大反应速率为多少? 解:(1) r = k [A]2 , t 0.5= 1/(2 k [A]0) , k = 0.012dm 3mol -1s -1 (2) 1/[A] – 1/[A]0 =2 k t , t = 945 s(3) ln(k/k ’)=(E a /R )(1/T ’-1/T ) , 573K 时k = 0.00223dm 3mol -1s -1,最大反应速率r max = k [A]02=3.6×10-4 moldm -3s -1.4. 450℃时实验测定气相反应3A + B →2C 的速率数据如下;实验 初压 / Pa 初速率-dp B / dt / (Pa/h) P A,0 P B,01. 100 1.00 0.0100 2. 200 1.00 0.0400 3. 400 0.50 0.0800 (1)若反应的速率方程为r = kP A x P B y ,求x 、y 及k 。

基元反应动力学练习题7-1 双分子反应2A(g) B(g) + D(g),在623K、初始浓度为0.400mol dm-3时,半衰期为105s,请求出(1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol-1, 573K时的最大反应速率为多少?解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t , t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.7-2 500K时气相基元反应A + B = C,当A和B的初始浓度皆为0.20 mol dm-3时,初始速率为5.0×10-2 mol dm-3 s-1(1) 求反应的速率系数k;(2) 当反应物A、B的初始分压均为50 kPa(开始无C),体系总压为75 kPa时所需时间为多少?解:(1) r0 = k[A]0 [B]0 , k =1.25 dm3 mol-1 s-1(2) p0(A) = p0(B) , r = k p p (A) 2 , p =2 p0(A) - p (A) , p (A)= p0(A)/ 2 , k p = k/(RT) ,t1/2 =1/[ k p p0(A)] = 66 s7-3 已知在540―727K之间和定容条件下,双分子反应CO(g)+ NO2(g)→CO2(g)+NO(g)的速率系数k表示为k / (mol-1 dm3 s-1) = 1.2×1010exp[E a /(RT)],E a= -132 kJ mol-1。
若在600K时,CO和NO2的初始压力分别为667和933Pa,试计算:(1) 该反应在600K时的k值; (2) 反应进行10 h以后,NO的分压为若干。
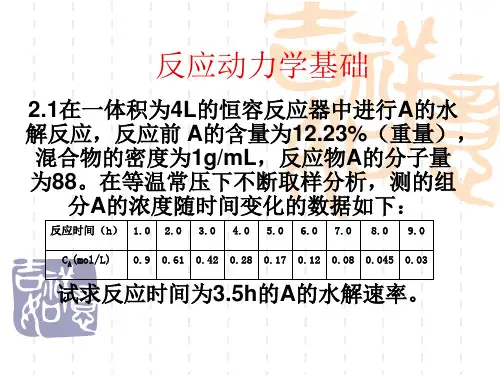

2 反应动力学基础2.1 在一体积为4L 的恒容反应器中进行A 的水解反应,反应前 A 的含量为12.23%(重量),混合物的密度为1g/mL ,反应物A 的分子量为88。
在等温常解:利用反应时间与组分A 的浓度变化数据,作出C A ~t 的关系曲线,用镜面法求得t=3.5h 时该点的切线,即为水解速率。
切线的斜率为0.760.125/.6.1α-==-mol l h由(2.6)式可知反应物的水解速率为0.125/.-==dC A r mol l hAdt2.2在一管式反应器中常压300℃等温下进行甲烷化反应:2423+→+CO H CH H O催化剂体积为10ml ,原料气中CO 的含量为3%,其余为N 2,H 2气体,改变进口原料气流量Q 0解:是一个流动反应器,其反应速率式可用(2.7)式来表示00000(1)(1)-==-=-=-A A RA A A A A A A AdF r dV F F X Q C X dF Q C dX故反应速率可表示为:000(/)==A AA A A R R dX dX rQ C C dV d V Q用X A ~V R /Q 0作图,过V R /Q 0=0.20min 的点作切线,即得该条件下的dX A /d(V R /Q 0)值α。
0.650.04 1.790.34α-==故CO 的转化速率为40030.10130.03 6.3810/8.31410573--⨯===⨯⨯⨯A A P C mol l RT4300 6.3810 1.79 1.1410/.min(/)--==⨯⨯=⨯AA A R dX r C mol l d V Q2.3已知在Fe-Mg 催化剂上水煤气变换反应的正反应动力学方程为: 20.850.4/-=⋅w CO CO r k y y kmol kg h式中y CO 和y CO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa 压力及700K 时反应速率常数k W 等于0.0535kmol/kg.h 。

化学反应动力学的练习题化学反应动力学是研究反应速率和反应的速率规律的学科。
这个领域的重要内容就是解决反应速率与温度、浓度、催化剂等因素的关系。
本篇文章将结合一些练习题,来说明化学反应动力学的相关概念和计算方法。
一、题目解析1. 硫酸铁(III)催化硫代硫酸钠分解的反应:2NaSSO3 + 2H2SO4 → 3SO2 + 2Na2SO4 + H2O它的速率方程为:v = k[H2SO4]m[NaSSO3]n,已知当[H2SO4]=0.2mol/L,[NaSSO3]=0.1mol/L时,反应速率为2.25mol/L·min。
请问该反应的速率常数 k、反应级数 m 和 n 分别为多少?二、解答过程在解答该练习题之前,我们首先需要了解速率常数、反应级数和速率方程的概念。
速率常数:表示反应速率与反应物浓度关系的比例常数,用符号 k表示。
反应级数:根据反应物浓度与速率之间的关系,确定反应速率方程的指数值。
速率方程:表示反应速率与反应物浓度之间的关系式。
对于题目中给出的反应速率方程:v = k[H2SO4]m[NaSSO3]n,已知当[H2SO4]=0.2mol/L,[NaSSO3]=0.1mol/L时,反应速率为2.25mol/L·min。
我们可以根据题目给出的数据,利用速率方程求解:v = k[H2SO4]m[NaSSO3]n二次代入已知条件:2.25 = k × (0.2)m × (0.1)n ----(1)为了确定每个指数的值,我们需要利用不同条件下的反应速率数据来进行消元计算。
考虑尝试不同的条件,我们可以重复着这一过程直到找到一个关系成立的组合。
假设此时反应速率为 v₁:v₁ = k × (c₁[NaSSO3]) × (c₂[H2SO4]) ----(2)将条件1代入方程2,我们得到:2.25 = k × (0.2/c₂ )m × (0.1/c₁ )n ----(3)为了方便计算,我们可以将等式两边取对数:log(2.25) = log(k) + mlog(0.2/c₂) + nlog(0.1/c₁) ----(4)继续进行计算,可得:log(2.25) = log(k) + -log(c₂)/log(5) + (log(0.1) - log(c₁))/log(10) ----(5)整理方程,我们可以得到:log(k) = log(2.25) + log(c₂)/log(5) - (log(0.1) - log(c₁))/log(10) ----(6)根据已知条件,我们可以计算出 c₁和 c₂的值,将其代入方程6中求解 log(k)。

第二章 化学反应动力学习题解答(2012-3-26)化09-1、2、31、补充题:本章子电子教案布置的习题的第5题:某气相反应在400K 时的速率为h MPa p dtdp A A /371.02=-。
试问:(1)反应速率常的单位是什么? (2)若速率式写成h m kmol kc Vdtdn r A A A ./32=-=-,则此反应速率常数是多少? 解:(1)单位:[][]()()122//-===MPaMPa h MPa k hMPa kp A(2)设气相符合理想气体规律,则:hm k m o l c V d tdn hm mol c Vdt dn h m mol c RT Vdt dn hPa V RT n Vdt dn RT dt V RT n d dt dp r VRT n p A A A A A A A A A A A A A ./10234.1./10400314.8371.0./10371.0/10371.032632632662⨯⨯=-⇒⨯⨯⨯⨯=-⇒⋅⋅=-⇒⨯⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛-=⎪⎭⎫ ⎝⎛-=-=-=故速率常数131610234.1--⨯=h m kmol k2、补充题:本章子电子教案布置的习题在间歇反应器中进行等温二级反应A B ,反应速率为s L mol c r A A ./01.02=-,当C A0分别为1,5,10mol/L 时,求反应至C A =0.01mol/L 所需反应时间。
解:由题可知:速率常数1101.0--=Ls mol k不同初始浓度反应达到同一终了浓度所需反应时间:⎪⎪⎭⎫⎝⎛-=0111A A c c k t 分别将不同的初始浓度及终了浓度代入上式求解得:999010101.0101.0111199805101.0101.0111199001101.0101.01111030201=⎪⎭⎫⎝⎛-=⎪⎪⎭⎫ ⎝⎛-==⎪⎭⎫ ⎝⎛-=⎪⎪⎭⎫ ⎝⎛-==⎪⎭⎫⎝⎛-=⎪⎪⎭⎫ ⎝⎛-=A A A A A A c c k t c c k t c c k t3、补充题:本章子电子教案布置的习题A certain reaction has a rate given by: 132min..005.0--=-cm mol c r A Aif the concentration is to be expressed in mol/Liter and time in hours, what would be the value and unit of the rate constant.解:()11132132132300.300601.1.0.005.0min ..005.0--------⋅=∴=⎪⎭⎫ ⎝⎛==-h L mol k h dm mol c h dm mol c cm mol c r A A A A4、陈甘棠第三版教材P29第4题 解:()()()()[]12211224222229.4230273082.0/1065.2----=+⨯⋅⋅⋅⋅⨯===-=-→⎪⎭⎫ ⎝⎛=-=-===-=-s atm Kmol Katm L smol L RT k k p p RT k dt dp r RT p RT p k RTdt dp r RTp C RT p C C C k dtdC r cp B A c A A B A c A A BB A A B A c A A5、陈甘棠第三版教材P29第5题 解:恒T 、V 下有:RTp n RT n V p kn dt dn V n k dt dn V r AA A A AA A AA =→==-⇒=-=-1A Akp dtdp =-⇒ 由化学反应计量式可知: A 3p p A 3(p A0-p A )则总压:()23300pp p p p p p A A A A A -=→-+=,将此式代入上式得: ()23p p k dt dp Ao -=5、陈甘棠第三版教材P29第6题 解:反应式:2421042H H C H C +→ (a )乙烯分压:1242104104424242104104..8.424.2--=⨯=⨯-=∴=-scm kgf r r r r H C H C H C H C H C H C H C H C νννν(b )氢的物质的量:()smol s kmol p n RT V r r RTV dt dp RT V dt dn s cm kgf dt dp T H C H H C H C H C /3200/2.3344.24.24.24.2..4.2104210410412104==⨯=⨯=⨯=-==⎪⎭⎫ ⎝⎛-=-=---(c )丁烷的摩尔分数:11041041041048.04.24.2-==-∴=-=-=-sp dt dy dtdyp dt dpy dt dp H C H C H C H C6、陈甘棠第三版教材P29第7题 解: 设乙酸为关键组分A (1)经过120 min 后,乙酸的转化率:t=0时各物料的初始浓度: C A0=90.8/(60×0.3785)=4.0 kmol/m 3 C B0=181.6/(46×0.3785)=10.43 kmol/m 3 C R0=0 kmol/m 3C S0=[0.3785×1043-(90.8+181.6)]/(18×0.3785) =18.0kmol/m 3设t=t 时,A 的转化率为x A ,则各物料的浓度分别为: C A =C A0(1-x A )= 4-4x A C B =C B0 - C A0x A )=10.43 - 4x A C R =C R0 + C A0x A = 4x A C S =C S0 + C A0x A =18 + 4x A 代入速率方程式得:⎰=+-⨯=+⨯⨯⨯---⨯⨯=----Ax A A A A A A A x x x x x x r 0A AA02244)(-r dx C t )063.049.0248.0(108 )418(41063.1)443.10)(1(41076.4)(⎰⎪⎪⎭⎫⎝⎛⨯--=+-⨯=∴-Ax A A A A x x x x 02A 291.007.007.0126.097.0126.0ln 42.050)063.049.0248.0(dx 1084 t t=120min 时,x A =0.35,即有35%的乙酸转化为乙酸乙酯。


化学反应动力学许越习题1. 下列说法正确的是 [单选题] *A、碳的稳定单质是金刚石B、Fe(s)和Cl2(l)的标准摩尔生成焓都为0C、放热反应均是自发反应D、内能和焓都是状态函数(正确答案)2. 预测下列过程中哪个是熵增加的过程: [单选题] *A、水结冰B、建筑物坍塌(正确答案)C、空气分为温度、压力相同的氧气、氮气和氢气3. 下列说法不正确的是 [单选题] *A、反应速率常数取决于反应温度与反应浓度无关B、质量作用定律仅适用于基元反应C、反应活化能越大,反应速率也越大(正确答案)4. 反应2NO+H2→N2+H2O2的反应速率表达式v=kc2(NO)c(H2),以下分析正确的是: [单选题] *A、NO浓度增加一倍,反应速率也增加一倍B、氢气浓度增加一倍,反应速率也增加一倍(正确答案)C、将反应器的容积增大一倍,反应速率降低为原来的二分之一D、根据速率方程可以肯定该反应为基元反应5. 对于可逆反应:C(s) + H2O(g) == CO(g) + H2(g), ∆rHmθ > 0,下列说法正确的是 *A、达到平衡时各反应物和生成物的分压相等B、改变生成物的分压,使Q < K,平衡将向右移动(正确答案)C、升高温度平衡向右移动(正确答案)D、由于反应前后分子数目相等,所以增加压力对平衡无影响(正确答案)E、加入催化剂使正反应速率增加,故平衡向右移动(正确答案)6. 下列纯物质中,哪些单质的标准摩尔生成焓不为零 *A、金刚石(正确答案)B、 O3(g)(正确答案)C、Br2(l)D、 Fe(s)E、 Hg(g)(正确答案)F、石墨7. 升高温度可以增加__________________,从而提高反应速率 [填空题] *_________________________________(答案:活化分子百分比)8. 增加反应物浓度可以增加______________________ ,从而提高反应速率; [填空题] *_________________________________(答案:活化分子数量)9. 催化剂可以改变______________________________,从而提高反应速率。
第七章 基元化学反应动力学习题及答案1. N 2O 5在25℃时分解反应的半衰期为5.7h, 且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应 111216.07.56932.06932.021-===h t kt k y1)11ln(=- h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-=即完成90%所需时间为18.9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1 =5.4×1011exp(-122 474 J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101 325 Pa ,问多长时间后,丙烯酮的分压可达54 kPa ?解:k /S -1=5.4×1011exp[-122474/8.314×(150+273)]=4.055×10-4据题意:kt p p t=0lnt 410005.454000101325101325ln-⨯=-t =1877S3. 双分子反应2A(g)−→−k B(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出 (1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol-1, 573K时的最大反应速率为多少? 解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t, t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.4. 450℃时实验测定气相反应3A + B→2C的速率数据如下;实验初压 / Pa 初速率-dpB/ dt / (Pa/h)PA,0 PB,01. 100 1.00 0.0100 2. 200 1.00 0.0400 3. 400 0.50 0.0800(1)若反应的速率方程为r = kPA x PBy,求x、y及k。
第三章 微生物反应动力学习题答案1. 微生物反应的特点,其与化学反应的主要区别有那些? 答:微生物反应与化学反应相比,具有以下特点:1)微生物反应属于生化反应,通常是在常温常压下进行;2)反应原料来源相对丰富;3)易于生产复杂的高分子化合物和光学活性物质;4)通过菌种改良,可大大提高设备的生产能力;5)副产物多,提取有一定难度;6)生产微生物受外界环境影响比较大;7)开发成本较大;8)废水BOD较大2.简要回答微生物反应与酶促反应的最主要区别?答:微生物反应与酶促反应的最主要区别在于,微生物反应是自催化反应,而酶促反应不是。
此外,二者还有以下区别:(1)酶促反应由于其专一性,没有或少有副产物,有利于提取操作,对于微生物反应而言,基质不可能全部转化为目的产物,副产物的产生不可避免,给后期的提取和精制带来困难,这正是造成目前发酵行业下游操作复杂的原因之一。
(2)对于微生物反应,除产生产物外,菌体自身也可是一种产物,如果其富含维生素或蛋白质或酶等有用产物时,可用于提取这些物质。
(3)与微生物反应相比,酶促反应体系较简单,反应过程的最适条件易于控制。
微生物反应是利用活的生物体进行目的产物的生产,因此,产物的获得除受环境因素影响外,也受细胞因素的影响,并且微生物会发生遗传变异,因此,实际控制有一定难度。
(4)酶促反应多限于一步或几步较简单的生化反应过程,与微生物反应相比,在经济上有时并不理想。
4. 答:Monod 方程建立的基本假设:微生物生长中,生长培养基中只有一种物质的浓度(其他组分过量)会影响其生长速率,这种物质被称为限制性基质,并且认为微生物为均衡生长且为简单的单一反应。
Monod 方程与米氏方程的主要区别如下表所示:Monod 方程:SK SS +=max μμ米氏方程:SK Sr r m +=max方程中各项含义: μ:生长比速 μmax :最大生长比速 S: 单一限制性基质浓度 K S : 半饱和常数 方程中各项含义: r:反应速率 r max :最大反应速率 S:底物浓度 K m :米氏常数 微生物生长动力学方程酶促反应动力学方程经验方程 理论推导的机理方程适用于单一限制性基质的情况 适用于单底物、无抑制的情况5、答:由于细胞的组成是复杂的,当微生物细胞内部所含有的蛋白质、脂肪、碳水化合物、核酸、维生素等的含量随环境条件的变化而变化时,建立起的动力学模型称为结构模型。
化学反应动力学练习题一、计算题1.340K 时N 2O 5分解反应有如下实验数据求60s 内和120s 到240s 的平均速率。
2.某基元反应A(g)+2B(g)D(g)+E(g),某温度下,将一定量的A 和B 通入一定体积的容器中。
(1)当A 和B 各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl 2 (g) COCl 2有下列实验数据求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O 52NO 2+21O 2速率常数随温度变化的实验数据如下,求该反应的活化能。
5.反应CO(CH2COOH) 2 CH 3COCH 3+2CO 2,在283K 时速率常数k 为 6.48×10-3 mol 〃L -1〃min -3,在333K 时速率常数k 为3.29mol 〃L -1〃min -1。
求303K时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol〃L-1,cB=0.3mol〃L-1时的反应速率为0.72mol〃L-1〃s-1,若温度不变增大反应物浓度,使 cA=1.2mol〃L-1,cB=0.6mol〃L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol〃L-1,c(O2)=0.080 mol〃L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
试计算C2H6(g) 的压强为1.33×104 Pa 时的起始分解速率υ9.295K时,反应 2 NO + Cl2→ 2 NOCl,反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程。
反应动力学 习题一、判断题:1、催化剂只能改变反应的活化能,不能改变反应的热效应。
.........................( )2、质量作用定律适用于任何化学反应...............................................( )3、反应速率常数取决于反应温度,与反应物、生成物的浓度无关。
................( )二、选择题:1.若 反 应:A + B → C 对 A 和 B 来 说 都 是 一 级 的, 下 列 叙 述 中正 确 的 是....( )。
(A) 此 反 应 为 一 级 反 应;(B) 两 种 反 应 物 中, 当 其 中 任 一 种 的 浓 度 增 大 2 倍, 都 将 使 反 应 速 率 增 大 2 倍;(C) 两 种 反 应 物 的 浓 度 同 时 减 半, 则 反 应 速 率 也 将 减 半;(D) 该 反 应 速 率 系数 的 单 位 为 s -1。
2. 反 应 A + B → 3D 的 E a ( 正 ) = m kJ·mol -1,E a ( 逆 ) = n kJ·mol -1, 则 反 应 的△r H m = ............ ( )。
(A) (m -n ) kJ·mol -1; (B) (n -m ) kJ·mol -1; (C) (m -3n ) kJ·mol -1; (D) (3n -m ) kJ·mol -1。
3. 下 列 关 于 催 化 剂 的 叙 述 中, 错 误 的 是................................................( )。
(A) 在 几 个 反 应 中, 某 催 化 剂 可 选 择 地 加 快 其 中 某 一 反 应 的 反 应 速 率;(B) 催 化 剂 使 正、 逆 反 应 速 率 增 大 的 倍 数 相 同;(C) 催 化 剂 不 能 改 变 反 应 的 始 态 和 终 态;(D) 催 化 剂 可 改 变 某 一 反 应 的 正 向 与 逆 向 的 反 应 速 率 之 比。
化学反应动力学练习题一、计算题1.340K时N2O5分解反应有如下实验数据时间0 60 120 180 240c (N2O5)/mol·L-10.160 0.113 0.080 0.056 0.040求60s内和120s到240s的平均速率。
2.某基元反应A(g)+2B(g) D(g)+E(g),某温度下,将一定量的A和B通入一定体积的容器中。
(1)当A和B各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl2 (g) COCl2有下列实验数据时间初始速率/mol-1·ls-1 CO Cl20.100.10 1.20×10-20.0500.10 6.00×10-30.0500.050 2.13×10-3求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O52NO2+21O2速率常数随温度变化的实验数据如下,求该反应的活化能。
T/K273 298 308 318 328 338k/s-17.87×10-7 3.46×10-5 1.35×10-4 4.98×10-4 1.50×10-3 4.87×10-35.反应CO(CH2COOH)2CH3COCH3+2CO2,在283K时速率常数k为 6.48×10-3 mol·L-1·min-3,在333K时速率常数k为3.29mol·L-1·min-1。
求303K 时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol·L-1,cB=0.3mol·L-1时的反应速率为0.72mol·L-1·s-1,若温度不变增大反应物浓度,使 cA=1.2mol·L-1,cB=0.6mol·L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:初始浓度/mol·L-1初始速率/mol·L-1·s-1 c(NO)C(O2)1 2 30.0200.0100.0100.0200.0200.0102.0×10-25.0×10-32.5×10-3(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol·L-1,c(O2)=0.080 mol·L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
反应动力学习题一、判断题:1、催化剂只能改变反应的活化能,不能改变反应的热效应。
.........................()2、质量作用定律适用于任何化学反应...............................................()3、反应速率常数取决于反应温度,与反应物、生成物的浓度无关。
................()二、选择题:1.若反应:A + B → C 对A 和B 来说都是一级的,下列叙述中正确的是....()。
(A) 此反应为一级反应;(B) 两种反应物中,当其中任一种的浓度增大2 倍,都将使反应速率增大2 倍;(C) 两种反应物的浓度同时减半,则反应速率也将减半;(D) 该反应速率系数的单位为s-1。
2. 反应A + B → 3D 的E a ( 正) = m kJ·mol-1,E a ( 逆) = n kJ·mol-1,则反应的△r H m = ............ ()。
(A) (m-n) kJ·mol-1;(B) (n-m) kJ·mol-1;(C) (m-3n) kJ·mol-1;(D) (3n-m) kJ·mol-1。
3. 下列关于催化剂的叙述中,错误的是................................................()。
(A) 在几个反应中,某催化剂可选择地加快其中某一反应的反应速率;(B) 催化剂使正、逆反应速率增大的倍数相同;(C) 催化剂不能改变反应的始态和终态;(D) 催化剂可改变某一反应的正向与逆向的反应速率之比。
4. 当速率常数的单位为mol-1·dm3·s-1时,反应级数为.............................................()(A)一级; (B)二级; (C)零级; (D)三级5. 对于反应2A + 2B → C,下列所示的速率表达式正确的是.............................()(A)⊿[A]⊿t=23⊿[B]⊿t(B)⊿[C]⊿t=13⊿[A]⊿t(C) ⊿[C]⊿t=12⊿[B]⊿t(D)⊿[B]⊿t=⊿[A]⊿t6. 反应2A + B → D的有关实验数据在表中给出,此反应的速率常数k/mol-2·dm6·min-1约为...............................................................................................................................()初始浓度最初速率[A]/mol· dm-3 [B]/mol·dm-3v/mol·dm-3·min-10.05 0.05 4.2×10-20.10 0.05 8.4×10-20.10 0.10 3.4×10-1(A) 3.4×102(B) 6.7×102(C) 3.4×103(D) 6.7×1037. 催化剂是通过改变反应进行的历程来加速反应速率。
这一历程影响.....................()(A)增大碰撞频率; (B)降低活化能;(C)减小速率常数; (D)增大平衡常数值。
8.下列叙述中正确的是..........................................................................................................( )(A )化学反应动力学是研究反应的快慢和限度的;(B )反应速率常数大小即是反应速率的大小;(C )反应级数越大,反应速率越大;(D )活化能的大小不一定总能表示一个反应的快慢,但可表示反应速率常数受温度影响的大小。
9. 当反应A 2 + B 2 → 2AB 的速率方程为v=k[A 2][B 2]时,则此反应.........................( )(A) 一定是基元反应; (B )一定是非基元反应;(C )不能肯定是否是基元反应; (D )反应为一级反应。
10. 某化学反应进行30min 反应完成50%,进行60min 反应完成100%,则此反应是( )(A )三级反应; (B )二级反应; (C )一级反应; (D )零级反应。
11. 某一级反应的速率常数为9.5×10-2min -1。
则此反应的半衰期为........................( )(A )3.65min; (B )7.29min; (C )0.27min; (D )0.55min 。
12. 放射性衰变过程是一级反应。
某同位素的半衰期为104年,问此同位素试样由100g 减少到1g 约需 ............................................................................................( )(A )4×104年; (B )5×104年; (C )6×104年; (D )7×104年。
13. 某反应的速率方程式是v=kc x (A)c y (B),当c(A)减少50%时,v 降低至原来的14 ,当c(B)增大2倍时,v 增大1.41倍,则x,y 分别为.......................................................( )(A )x=0.5, y=1; (B )x=2,y=0.7;(C )x=2 ,y =0.5; (D )x=2,y=2。
14. 下列叙述中正确的是..................................................................................( )(A )溶液中的反应一定比气相中的反应速率大;(B )反应活化能越小,反应速率越大;(C )加入催化剂,使正反应活化能和逆反应活化能减小相同数;(D )增大系统压力,反应速率一定增大。
15. 某基元反应 2A + B = C + D ,若其反应速率表示式可以是:(1) d(C)/dt =k1 (A)2 (B)或 (2) -d(A)/dt =k2 (A)2 (B)或 (3) 加催化剂后 d(C)/dt =k3 (A)2 (B)则这些速率常数k 之间的关系是 ( )(A) k 1 =k 2 =k 3 (B) k 1 ≠k 2 ≠k 3 (C) k 1 =k 2 ≠k 3 (D) k 1 =k 3 ≠k 216. 对于一个给定条件下的反应,随着反应的进行 ( )(A)速率常数k 变小 (B)平衡常数K 变大(C )正反应速率降低 (D)逆反应速率降低17. 当反应速率常数 k 的量纲为 dm3 .mol -1 .s -1 时,反应是 ( )(A) 2 级反应 (B) 1 级反应 (C) 1/2 级反应 (D) 1.5 级反应18. 某化学反应的速率常数的单位是mol.dm -3.s -1时,则该化学反应的级数是 ( )(A) 3/2 (B) 1 (C) 1/2 (D) 019. 对三级反应,其速率常数的单位是 ( )(A)(浓度)(时间)-1 (B) (时间)-1 (C) (浓度)-1 (时间)-1 (D) (浓度)-2 (时间)-120. 某化学反应的速率常数的单位是(时间)-1 ,则反应是 ( )(A) 零级反应(B) 三级反应(C) 二级反应(D) 一级反应21. 速率常数k 是( )(A) 无量纲的参数(B) 量纲为mol.dm-3 .s-1的参数(C) 量纲为mol2 .dm-3.s-1的参数(D) 量纲不定的参数22. 某一化学反应: 2A + B → C是一步完成的。
A的起始浓度为2 mol.dm-3,B的起始浓度是4 mol.dm-3 .1 s后,A 的浓度下降到1 mol.dm-3,该反应的反应速率为( )(A) 0.5 mol.dm-3 .s-1 (B) - 0.5 mol.dm-3 .s-1(B)- 1 mol.dm-3 .s-1 (D) 2 mol.dm-3 .s-123. 反应2O3 3O2,其速率方程式若为d(O3)/dt =k(O3)2(O2)-1或d(O2)/dt=k'(O3)2 (O2)-1,则速率常数k 和k' 的关系是( )(A) 2k= 3k' (B) k=k' (C) 3k= 2k' (D) -1/2k= 1/3k'24. NO2二聚反应的速率定律为-d[NO2]/dt=k[NO2]2,会使速率常数发生变化的条件是( )(A) 将体系的总压力加倍(B) 在反应混合物中加O2气(C) 反应混合物中加过量NO2 (D) 在CCl4溶液中进行反应而不在气相反应25. 若浓度的单位为mol.dm-3,时间的单位为min,则三级反应的速率的单位为( )(A) mol.dm-3 .min-1 (B) dm6.mol-2 .min-1(C) dm3 .mol-1 .min-1 (D) min-126. 下列说法中正确的是- ( )(A) 反应速率常数的大小即反应速率的大小(B) 反应级数和反应分子数是同义词(C) 反应级数越大,反应速率越大(D) 从反应的速率常数的单位可以推测该反应的反应级数27. 反应H2 (g) + I2(g) → 2HI(g) ,k = 0.16 dm3 .mol-1 .s-1,在781K时反应物的起始浓度:c(H2 )= 0.040 mol.dm-3,c(I2)= 0.050 mol.dm-3. 当c(H2 ) 减少一半时,反应速率是起始反应速率的( )(A) 0.30 倍(B) 0.50 倍(C) 0.60 倍(D) 0.40 倍28. 某一可逆反应达平衡后,若反应速率常数k发生变化时,则平衡常数K ( )(A) 一定发生变化(B) 不变(C) 不一定变化(D) 与k无关29. 25℃时,氢氟酸的电离常数为10-3.15,基元反应H+(aq)+F-(aq)=HF(aq)的速率常数为1011.00 dm3.mol-1.s-1,因此电离反应HF(aq)=H+(aq)+F-(aq)的速率常数为( )(A)1014.15 s-1 (B) 107.85 s-1 (C) 10-7.85 s-1 (D) 10-3.15 s-1三、填空题:1.某气相反应:2A (g) + B (g) → C (g) 为元反应,实验测得当A、B 的起始浓度分别为0.010 mol·L-1和0.0010 mol·L-1 时,反应速率为5.0 ×10-9 mol·L-1·s-1,则该反应的速率方程式为_______,反应速率系数k = _________。