初三化学实验室制取氧气上课讲义
- 格式:doc
- 大小:99.51 KB
- 文档页数:6

201 年初中化学专属讲义课题:实验室制取氧气学生姓名:授课教师:201 年月日酒精灯试管铁架台带导管的单孔塞子集气瓶水槽玻璃片发生装置收集装置课题内容:制取氧气知识点一 氧气的实验室制取一、实验室高锰酸钾制取氧气1.实验原理:高锰酸钾 加热 锰酸钾 + 二氧化锰 + 氧气2.实验步骤:① 查:检查装置的气密性。
② 装:将高锰酸钾装入干燥的试管,并在试管口放一团棉花,并用带导管的橡皮塞塞紧试管。
③ 定:将试管固定在铁架台上。
④ 点:点燃酒精灯,试管均匀受热后,就使酒精灯固定在试管底部加热。
⑤ 收:根据所选的收集装置来确定气体的收集方法。
⑥ 移:把导管移出水槽。
⑦ 熄:熄灭酒精灯。
3.验证和验满检验:用一根带火星的木条深入瓶内,如果木条复燃,证明瓶内的气体是氧气;验满:(用排水法收集)如果集气瓶口有气泡出现,说明气体收集满了。
(用向上排空气法收集)将带火星的木条放在集气瓶口,如果带火星的木条复燃,说明氧气收集满了。
4.注意事项:(1)试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水;(2)仪器组装:组装仪器时要按照先下后上,从左到右的顺序;(3)导气管稍伸入橡皮塞:有利于产生的气体排出;(4)试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂;(5)当气泡连续均匀冒出时开始收集,刚开始冒出的气泡是空气;(6)排气法收集气体时,导管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯;(7)实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的水倒流,炸裂试管。
二、双氧水(6%的过氧化氢水溶液)制取氧气1.实验原理:过氧化氢 二氧化锰 水 + 氧气2.实验步骤:(1)检查装置的气密性;(2)向锥形瓶中加入二氧化锰固体;(3)塞好带有长颈漏斗(或分液漏斗)和导管的橡皮塞;(4)向长颈漏斗(或分液漏斗)中加入双氧水,用排水法收集气体。
3.注意事项:(1)分液漏斗可以用长颈漏斗代替,但其下端应该深入液面以下,防止生成的气体从长颈漏斗中逸出;(2)导管只需略微伸入橡皮塞;装药品时,先装固体后装液体。




初三化学氧气的制取【本讲主要内容】氧气的制取【知识掌握】【知识点精析】一. 实验室制取氧气的反应原理1. 药品:过氧化氢溶液或高锰酸钾2. 反应原理:过氧化氢−−−→−二氧化锰水 + 氧气高锰酸钾−−→−加热锰酸钾 + 二氧化锰 + 氧气3. 催化剂和催化作用:(1)催化剂:在化学反应里能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生改变的物质。
(2)催化作用:催化剂在化学反应中所起的作用。
4. 化学反应的分类:化学反应可以分为化合反应、分解反应。
分解反应:由一种物质生成两种或两种以上其它物质的反应。
二. 氧气的实验室制法:1. 用高锰酸钾制取氧气的实验步骤(过氧化氢溶液制取氧气略)(1)检查装置的气密性:方法:如图所示,用带导管的橡皮塞塞住试管口,将导管的另一端插入盛水的烧杯中,用手握紧试管,如果导管口有气泡放出,说明装置不漏气。
原理:如果装置不漏气,里面的空气会受热膨胀沿导管放出。
(2)向试管中装入药品:方法:用纸槽取一定量的高锰酸钾小心装入试管,均匀铺平在试管的中下部。
在试管口塞一团棉花后再塞上带有导管的塞子。
原因:放一团棉花可防止加热时高锰酸钾粉末进入导管。
(3)固定试管:方法:将试管口略向下倾斜,铁夹夹在离试管口1/3处,将试管固定在铁架台上。
原因:防止加热时产生的冷凝水回流到热的试管底部,使试管受热不均匀而炸裂。
(4)向集气瓶中装水排空气:方法:将集气瓶盛满水,中间不能有气泡,从瓶口旁边将玻璃片推盖好将它们一起倒立在盛水的水槽中。
原因:防止收集的气体不纯。
(5)给试管加热:方法:点燃酒精灯,先将火焰在试管下方来回移动,让试管均匀受热,然后再对着药品的部位加热。
原因:防止试管因受热不均匀而炸裂。
(6)收集气体:方法:当导管口有连续均匀的气泡放出时,再把导管伸入盛满水的集气瓶口。
原因:开始排出的气体是装置内的空气,不能收集。
(7)停止加热:方法:先从水槽中移出导管,然后再熄灭酒精灯。
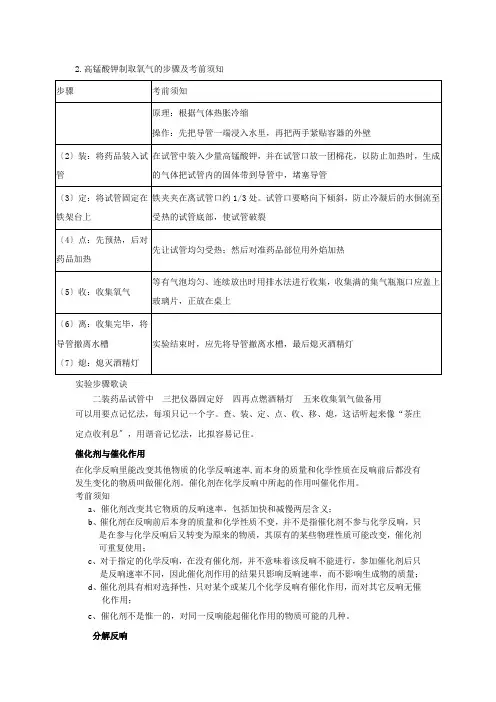
2.高锰酸钾制取氧气的步骤及考前须知实验步骤歌诀二装药品试管中三把仪器固定好四再点燃酒精灯五来收集氧气做备用可以用要点记忆法,每项只记一个字。
查、装、定、点、收、移、熄,这话听起来像“茶庄定点收利息〞,用谐音记忆法,比拟容易记住。
催化剂与催化作用在化学反响里能改变其他物质的化学反响速率,而本身的质量和化学性质在反响前后都没有发生变化的物质叫做催化剂。
催化剂在化学反响中所起的作用叫催化作用。
考前须知a、催化剂改变其它物质的反响速率,包括加快和减慢两层含义;b、催化剂在反响前后本身的质量和化学性质不变,并不是指催化剂不参与化学反响,只是在参与化学反响后又转变为原来的物质,其原有的某些物理性质可能改变,催化剂可重复使用;c、对于指定的化学反响,在没有催化剂,并不意味着该反响不能进行,参加催化剂后只是反响速率不同,因此催化剂作用的结果只影响反响速率,而不影响生成物的质量;d、催化剂具有相对选择性,只对某个或某几个化学反响有催化作用,而对其它反响无催化作用;e、催化剂不是惟一的,对同一反响能起催化作用的物质可能的几种。
分解反响由一种反响物生成两种或两种以上其他物质的反响,称为分解反响。
从反响形式上判断,分解反响的特点是“一变多〞。
课堂练习1、实验室制取氧气与工业制取氧气相比拟,以下表达正确的〔〕A、生产原料完全不同B、制取产物完全不同C、都是化学反响D、都利用了物质的化学性质1、实验室制取氧气与工业制取氧气相比拟,以下表达正确的〔〕A、生产原料完全不同B、制取产物完全不同C、都是化学反响D、都利用了物质的化学性质2、以下含氧化合物,不需要加热就能够直接产生O2的是A、H2O2B、MnO2C、Fe2O3D、KClO33、以下对用排水法收集满氧气的集气瓶处理正确的选项是〔〕A、将集气瓶从水中提起后,用玻璃片盖住瓶口,瓶口向上正放在桌上。
B、在水面下用玻璃片盖住瓶口,一起拿出水面,然后正放在桌上C、将集气瓶子从水中提取,倒立在桌上D、将集气瓶仍然留在水槽中,用时再取出来A.空气中的氧气主要来自于植物的光合作用C.用含有氧元素的物质反响才有可能产生氧气5、以下对催化剂描述正确的选项是A.任何化学反响都需要催化剂 B.催化剂在反响前后本身的质量发生了变化 C.只有分解反响才需要催化剂 D.某些化学反响可以有多种催化剂6、一氧化氮〔NONO2 〕A、用排水法B、用向上排空气法C、用排水法或向上排空气法D、用向下排空气法7、质量相等的两份药品a和b,a是混有少量二氧化锰的氯酸钾,b是纯洁的氯酸钾,将药品分别加热,那么收集到氧气的质量随反响时间变化的图象如下,其中正确的选项是〔〕O2 的说法不科学的是A.常用带火星的木条来检验空气中的O2B.硫在O2 里燃烧产生明亮的蓝紫色火焰C.工业上将空气液化后再进行别离来制取O2D.加热KClO3 制O2可用MnO2做催化剂9、过氧化氢〔化学式为H2O2〕溶液在二氧化锰作催化剂的条件下迅速分解出氧气和水。



《氧气的实验室制取与性质》讲义一、氧气的性质氧气是一种无色、无味、无臭的气体,在常温常压下不易溶于水。
氧气具有助燃性,能支持燃烧,许多物质在氧气中燃烧会比在空气中更加剧烈。
氧气的化学性质比较活泼,能与多种物质发生化学反应。
例如,金属单质如铁、铜等能在氧气中燃烧;非金属单质如碳、硫、磷等也能在氧气中燃烧;化合物如甲烷、乙醇等在氧气中也能燃烧。
氧气对于生物来说至关重要,人类和其他动物的呼吸过程都需要氧气,它参与细胞的呼吸作用,为生命活动提供能量。
二、氧气的实验室制取方法1、加热高锰酸钾制取氧气(1)实验原理:高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO₄△ K₂MnO₄+ MnO₂+O₂↑(2)实验装置:包括发生装置和收集装置。
发生装置:由铁架台(带铁夹)、酒精灯、试管、棉花、导管等组成。
收集装置:可以选择排水法或向上排空气法收集氧气。
(3)实验步骤:①查:检查装置的气密性。
将导管的一端放入水中,双手紧握试管外壁,如果导管口有气泡冒出,说明装置气密性良好。
②装:将药品装入试管,并在试管口塞一团棉花,以防止加热时高锰酸钾粉末进入导管。
③定:将试管固定在铁架台上,试管口略向下倾斜,防止冷凝水回流使试管炸裂。
④点:点燃酒精灯,先预热,然后集中在药品部位加热。
⑤收:当气泡连续均匀地冒出时开始收集氧气。
⑥离:收集完毕,先将导管撤离水槽。
⑦熄:最后熄灭酒精灯。
(4)注意事项:①试管口要略向下倾斜,防止药品中的水分受热后变成水蒸气,再冷凝成水珠倒流回试管底部,使试管炸裂。
②伸入试管内的导管不宜过长,稍露出橡皮塞即可,便于气体排出。
③用排水法收集氧气时,当气泡连续均匀冒出时再收集,否则收集的氧气不纯。
④收集满氧气的集气瓶应正放在桌面上,因为氧气的密度比空气大。
2、过氧化氢溶液在二氧化锰作催化剂的条件下制取氧气(1)实验原理:过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H₂O₂ MnO₂ 2H₂O + O₂↑(2)实验装置:发生装置由锥形瓶、长颈漏斗(或分液漏斗)、双孔橡皮塞、导管等组成。

黄冈中学初三化学实验室制取氧气
1、反应原理
①加热氯酸钾制取氧气:氯酸钾氯化钾+氧气。
②加热高锰酸钾制取氧气:高锰酸钾锰酸钾+二氧化锰+氧气
③分解过氧化氢制取氧气:过氧化氢水+氧气。
2、实验装置:(以加热高锰酸钾制氧气为例,如图所示)
3、操作步骤:
①检查装置的气密性。
②把药品装入试管内,使用高锰酸钾作反应物时在试管口放一团棉花。
③把试管固定在铁架台上,将集气瓶装满水并倒立在盛水的水槽中。
④点燃酒精灯,加热药品。
⑤收集气体。
⑥把导气管从水槽中移出水面。
⑦熄灭酒精灯。
4、收集方法:
①排水集气法(因为氧气不易溶于水)。
操作要点:把盛满水的集气瓶(无泡)倒立在水中,排水充气,取出放置。
②向上排空气法(因为氧气的密度略大于空气)。
操作要点:使导气管尽量伸入集气瓶底便于排尽空气。
5、检验:将带火星的木条伸入集气瓶内,若木条复燃,证明瓶内气体是氧气。
氧气可以使带火星的木条复燃
6、验满:若用向上排空气法收集氧气,验满时,取一根带火星的木条,放在集气瓶口,若木条复燃,则证明氧气已集满。
7、放置:因为氧气的密度大于空气的密度,故应正放在桌面上。
8、注意事项:
①在用氯酸钾或高锰酸钾制取氧气时,试管口应略向下倾斜,原因是防止加热时药品中的湿存水倒流炸裂试管。
②铁夹应夹在距试管口1/3处,原因是利于加热。
③导管伸入试管内要刚露出橡皮塞,原因是利于排出产生的气体。
④用排水法收集氧气时,不宜立即收集,待有连续均匀的气泡产生时再收集,原因是开始的气泡是试管内的空气,若立即收集则氧气不纯。
⑤排气法收集气体时,导管要伸入接近集气瓶底部,原因是利于充分排出瓶内空气。
⑥实验结束时,先将导管移出水面,再熄灭酒精灯,原因是防止水槽中的水倒吸炸裂试管。
⑦如果用高锰酸钾制氧气时,试管口应塞一小团棉花,原因是防止高锰酸钾粉末进入导管。
(二)、正确选用气体的收集方法
原则:易溶于水的气体选排空气法收集,根据气体的密度定“向上”或“向下”排气,若气体的密度大于空气的密度,采用向上排空气集气法;若气体的密度小于空气的密度,采用向下排空气集气法。
排气法操作简便,排水法收集的气体较纯。
(三)、氧气的工业制法
工业上制大量的氧气,主要是通过使空气液化,再分离液态空气而制得,这是物理方法,其主要过程为:
(四)、分解反应
由一种反应物生成两种或两种以上其他物质的反应叫做分解反应。
例如,高锰酸钾受热时分解生成了锰酸钾、二氧化锰和氧气,这个反应就是分解反应。
化合反应和分解反应都属于反应的基本类型,这两种反应可用字母表示为:
化合反应A+B→AB 分解反应AB→A+B
(五)、氧化反应
氧化反应是指物质跟氧发生的反应,生成物一般是氧化物,例如,磷、硫、铝在氧气中反应,生成物分别是五氧化二磷、二氧化硫、氧化铝,它们都是氧化物。
不要误认为氧化反应只是物质跟氧气的反应,氧化反应还包括物质跟含氧化合物的反应。
(六)、缓慢氧化
某些氧化反应进行得缓慢,甚至不容易被察觉,这种氧化叫做缓慢氧化。
例如,动植物的呼吸、食物的腐烂、酒和醋的酿造等都包含物质的缓慢氧化。
缓慢氧化与燃烧有所不同,燃烧是较剧烈的氧化反应,有发光、放热现象,但缓慢氧化时,放热,一般不发光;两者的相同点是:都是氧化反应。
三、难点知识剖析
(一)、催化剂和催化作用
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有变化的物质叫做催化剂(或叫做触媒),催化剂在化学反应中所起的作用叫做催化作用。
理解催化剂概念要注意几点:
1、催化剂能改变其他物质的化学反应速率,包括增大或减小两个方面。
例如,在用氯酸钾或过氧化氢制取氧气时,用二氧化锰作催化剂,是增大氯酸钾或过氧化氢分解的速率,今后还会学到一类催化剂,它可以减慢化学反应的速度。
2、催化剂本身的质量和化学性质不变,这并不是指催化剂不参与化学反应,而是催化剂参与化学反应后又转变为原来的物质,催化剂是反应条件。
3、催化剂可重复使用。
4、催化剂具有选择性,只对某一个或某几个反应有催化作用。
例如二氧化锰是氯酸钾分解的催化剂,但不是任何化学反应的催化剂。
5、催化剂只能改变化学反应速度,不能增加或减少生成物的质量。
(二)、化合反应与氧化反应
例1、有人设计用如图的装置来制取和收集氧气。
(1)图中有四处明显的错误,请指出错误并加以改正。
①错误;____________;改正:_______________。
②错误:____________;改正:_______________。
③错误:____________;改正:_______________。
④错误:____________;改正:_______________。
(2)回答图中指定仪器的名称:a______,b_____,c_____,d_____。
(3)用排水法收集氧气时,若要得到纯净的氧气,应在_______收集氧气。
(4)制备氧气时试管口没有略向下倾斜造成的后果是_________。
(5)此实验包括以下操作:①加热、②收集气体、③检查气密性、④装入高锰酸钾、⑤将导管从水中移出、⑥熄灭酒精灯。
正确的操作顺序是__________(填序号)。
(6)集满氧气的集气瓶应_______(填“正”或“倒”)放在桌上。
解析:
(1)①试管口朝上倾斜;应略向下倾斜;
②导管伸入试管内过长;导管略伸出橡皮塞;
③铁夹夹在试管口;应夹在离试管口1/3处;
④酒精灯外焰没对准药品加热;应将酒精灯移至试管底部药品的正下方。
(2)试管,铁架台,导管,集气瓶
(3)当气泡连续并比较均匀地放出时
(4)水倒流导致试管破裂
(5)③④①②⑤⑥
(6)正
例2:下列有关实验现象的描述正确的是
A.白磷在氧气中燃烧产生了大量的白雾
B.镁在空气中燃烧产生了白色的氧化镁
C.硫在空气中燃烧发出蓝紫色火焰产生了刺激性气体
D.铁在氧气里燃烧,火星四射,生成了黑色熔融物
解析:
本题是对能否准确描述实验现象的考查,A中的磷燃烧产生五氧化二磷固体,故现象应是产生大量的白烟,雾是指小液滴分散形成的;B中错误在于出现了生成物的名称;C选项中应是硫在氧气中燃烧产生了明亮的蓝紫色火焰。
正确答案为D
例3:加热氯酸钾制氧气时,忘记加入二氧化锰,其结果是
A.不能产生氧气B.生成氧气的速率慢
C.产生氧气的总量减少D.没有氯化钾生成。