大学物理:13-8 热力学第二定律的统计解释
- 格式:ppt
- 大小:432.50 KB
- 文档页数:12


热力学第二定律(英文:second law of thermodynamics)是热力学的四条基本定律之一,表述热力学过程的不可逆性——孤立系统自发地朝着热力学平衡方向──最大熵状态──演化,同样地,第二类永动机永不可能实现。
这一定律的历史可追溯至尼古拉·卡诺对于热机效率的研究,及其于1824年提出的卡诺定理。
定律有许多种表述,其中最具代表性的是克劳修斯表述(1850年)和开尔文表述(1851年),这些表述都可被证明是等价的。
定律的数学表述主要借助鲁道夫·克劳修斯所引入的熵的概念,具体表述为克劳修斯定理。
虽然这一定律在热力学范畴内是一条经验定律,无法得到解释,但随着统计力学的发展,这一定律得到了解释。
这一定律本身及所引入的熵的概念对于物理学及其他科学领域有深远意义。
定律本身可作为过程不可逆性[2]:p.262及时间流向的判据。
而路德维希·玻尔兹曼对于熵的微观解释——系统微观粒子无序程度的量度,更使这概念被引用到物理学之外诸多领域,如信息论及生态学等克劳修斯表述克劳修斯克劳修斯表述是以热量传递的不可逆性(即热量总是自发地从高温热源流向低温热源)作为出发点。
虽然可以借助制冷机使热量从低温热源流向高温热源,但这过程是借助外界对制冷机做功实现的,即这过程除了有热量的传递,还有功转化为热的其他影响。
1850年克劳修斯将这一规律总结为:不可能把热量从低温物体传递到高温物体而不产生其他影响。
开尔文表述参见:永动机#第二类永动机开尔文勋爵开尔文表述是以第二类永动机不可能实现这一规律作为出发点。
第二类永动机是指可以将从单一热源吸热全部转化为功,但大量事实证明这个过程是不可能实现的。
功能够自发地、无条件地全部转化为热;但热转化为功是有条件的,而且转化效率有所限制。
也就是说功自发转化为热这一过程只能单向进行而不可逆。
1851年开尔文勋爵把这一普遍规律总结为:不可能从单一热源吸收能量,使之完全变为有用功而不产生其他影响。

大学物理热力学第二定律知识点总结热力学第二定律是大学物理热学部分的重要内容,它揭示了热现象过程中的方向性和不可逆性。
理解和掌握热力学第二定律对于深入研究热学以及相关领域具有重要意义。
以下是对热力学第二定律相关知识点的详细总结。
一、热力学第二定律的表述1、克劳修斯表述热量不能自发地从低温物体传向高温物体。
这意味着热传递的过程具有方向性,如果没有外界的干预,热量只会从高温物体流向低温物体,而不会反向流动。
2、开尔文表述不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响。
也就是说,第二类永动机是不可能制成的。
第二类永动机是指一种能够从单一热源吸热,并将其全部转化为功,而不产生其他变化的热机。
二、热力学第二定律的微观解释从微观角度来看,热力学第二定律反映了大量分子热运动的无序性。
在一个孤立系统中,分子的热运动总是从有序趋向无序,这是一个自发的过程。
比如,将不同温度的气体混合在一起,它们会自发地达到温度均匀分布的状态,而不会自动地分离成原来的不同温度区域。
这是因为分子的无规则运动使得它们更容易趋向无序的分布。
三、熵熵是描述系统无序程度的热力学概念。
熵的增加表示系统的无序程度增加。
对于一个绝热过程,系统的熵永不减少。
如果是可逆绝热过程,熵不变;如果是不可逆绝热过程,熵增加。
熵的计算公式为:$dS =\frac{dQ}{T}$,其中$dQ$ 是微元过程中的吸热量,$T$ 是热力学温度。
四、卡诺循环与卡诺定理1、卡诺循环卡诺循环由两个等温过程和两个绝热过程组成,是一种理想的热机循环。
通过卡诺循环,可以计算出热机的效率。
卡诺热机的效率为:$\eta = 1 \frac{T_2}{T_1}$,其中$T_1$ 是高温热源的温度,$T_2$ 是低温热源的温度。
2、卡诺定理(1)在相同的高温热源和低温热源之间工作的一切可逆热机,其效率都相等,与工作物质无关。
(2)在相同的高温热源和低温热源之间工作的一切不可逆热机,其效率都小于可逆热机的效率。


热力学第二定律的表述理解热力学第一定律阐明了能量转换过程中的守恒关系,指出了不消耗能量而能不断输出功的第一类永动机确是一种幻想。
热力学第二定律则更深刻地揭示了能量的品质问题。
熵,或许发明这一物理量的先贤也未始能预料到其对自然科学甚至哲学竟能产生如此巨大的影响。
热力学第二定律有数种表达形式,最闻名于世的有克劳修斯表达和开尔文表达。
1.开尔文表述英国物理学家开尔文(1824~1907),1845年毕业于剑桥大学,1846年受聘为格拉斯哥大学自然哲学教授,长达50余年,1851年被选为英国皇家学会会员,1877年被选为法国科学院院士,1890年至1895年担任皇家学会会长,他对热学和电磁学的发展都作出了重要的贡献。
1851年开尔文在爱丁堡皇家学会会刊上发表了一篇论文,题目是“论热的动力理论”,文章指出:不存在这样一个循环过程,系统从单一热源吸收热量,使之完全变为有用功而不产生其他影响.表述中“单一热源”是指温度均匀且恒定的热源;“其他影响”指除了由单一热源吸热,把吸收的热用来做功以外的任何其他变化.若有其他影响产生时,把由单一热源吸来的热量全部用以对外做功是可能的.自然界任何形式的能都可能转化为热,但热却不能在不产生其他影响的条件下完全转变成其他形式的能.开尔文的论述虽然较克劳修斯晚一年,但他的论述更为明确,使得热力学第二定律的研究更加深入,此外,开尔文还从第二定律断言:能量耗散是普遍趋势.2.克劳修斯表述德国物理学家克劳修斯(1822~1888),曾在柏林大学学习4年,后于1848年毕业于哈雷大学.1850年他任柏林皇家炮工学校物理教授,1855年后他相继任苏黎士维尔茨堡和波恩大学物理教授.他除了建立热力学第二定律,引入态函数——熵,还对气体分子动理论做了较全面的论述,用统计平均的方法导出了理想气体的压强、温度和气体的平均自由程公式。
克劳修斯于1850年在《德国物理学年鉴》上率先发表了《论热的动力及能由此推出的关于热本质的定律》,把卡诺定理作了扬弃而改造成与热力学第一定律并列的热力学第二定律.他提出,热量总是自动地从高温物体传到低温物体,不可能自动地由低温物体向高温物体传递.或者说不可能把热量从低温物体传到高温物体,而不引起其他变化.即在自然条件下,这个转变过程是不可逆的,若想让热传递的方向逆转,则必须消耗功才能实现.以上两种表述是等效的,说明了热量不可能全部转化为机械功以及这一转化过程的方向性.人们一度曾设想一种能从单一热源吸收热量,使之完全转变成有用的机械功而不产生其他影响的第二类永动机,第二类永动机虽不违背热力学第一定律,但违背热力学第二定律,因而是不可能造成的.第二定律除了以上两种表述外,还有其他不同的表述,例如热效率为100%的热机是不可能制成的;不需要由外加功而可操作致冷的机器是不可能造成的等.第二定律无论采用何种表述,其内容实质相同,不外乎主张不可逆变化的存在.各种表述的实质在于说明一切与热现象有关的实际宏观过程都是不可逆的。


热力学第二定律具体内容:热力学第二定律是热力学定律之一,是指热永远都只能由热处转到冷处.热力学第二定律是描述热量的传递方向的分子有规则运动的机械能可以完全转化为分子无规则运动的热能;热能却不能完全转化为机械能.此定律的一种常用的表达方式是,每一个自发的物理或化学过程总是向著熵(entropy)增高的方向发展.熵是一种不能转化为功的热能.熵的改变量等于热量的改变量除以绝对温度.高、低温度各自集中时,熵值很低;温度均匀扩散时,熵值增高.物体有秩序时,熵值低;物体无序时,熵值便增高.现在整个宇宙正在由有序趋于无序,由有规则趋于无规则,宇宙间熵的总量在增加.克劳修斯表述不可能把热量从低温物体传到高温物体而不引起其他变化.开尔文表述不可能从单一热源吸取热量,使之完全变为有用功而不产生其他影响.开尔文表述还可以表述成:第二类永动机不可能造成.若要简捷热能不能完全转化为机械能,只能从高温物体传到低温物体。


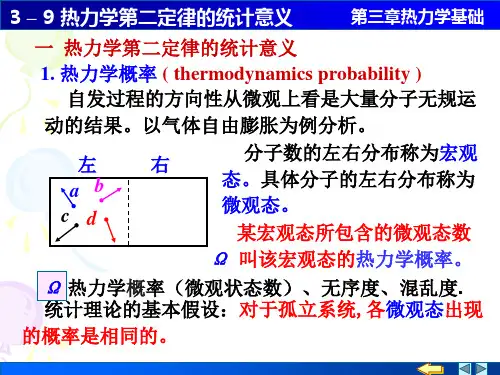
热力学第二定律的统计意义热力学第二定律是热力学中的一条基本定律,它表明在自然界中存在着一种趋势,即热量自热源向周围环境传递,而不会自动从低温体传向高温体,因此熵(或热力学不可逆性)总是增加的。
然而,这个定律的本质并不明确,这导致了许多学者对它的解释存在争议。
随着物理学的发展,人们发现这个定律与热力学的统计基础有着密切的关系。
首先,我们需要理解热力学中一个基本概念——熵。
熵是一种用来度量系统无序程度的物理量,表示了体系各个微观状态的分布不均匀程度。
通常来说,系统内互相独立的微观变化越多,其熵就越大。
例如,对于一个有序的水晶,在所有原子处于完美排列状态时,其熵最小。
而当温度升高时,原子会破坏这个有序状态,等效于增加了水晶的“混乱程度”,其熵也就增加了。
热力学第二定律实际上是在告诉我们一个事实:任何一个完全隔离的系统,熵不可能永远减少。
也就是说,熵的增加是一个不可逆的过程,这也是热量从高温体传向低温体时熵增加的原因。
概括而言,该定律表明了一个趋势,即系统中的能量将倾向于从高能量的状态向低能量的状态流动,从而使得系统的熵增加。
从统计学的角度来看,热力学第二定律是由这样一个事实推导而来的:在一个大的体系中,微观粒子的随机运动会经常导致某些相对独立事件的不完全或无法恢复性,这些事件包括:1. 分子/原子的碰撞: 分子或原子相互碰撞时,有一部分能量被转移给周围环境中的分子,这会导致大的系统中的能量总体降低;2. 动能的分布: 分子的运动速度分布不服从热力学平衡状态的Maxwell-Boltzmann分布时,也将导致无序增加;3. 热交换: 热量从高温体向低温体传递时,热力学不可逆性也将随之增加。
以上这些现象都会导致系统设在某个起始状态后一段时间后回不到原始状态的情况,这也就是在热力学第二定律中所描述的不可逆性增加。
这个过程是由大量微观粒子的无序运动造成的,也被称为热力学平衡状态的降解。
总体来说,热力学第二定律的统计意义是,它实际上是对许多微观随机过程导致的热力学不可逆性增加的描述。

热力学第二定律统计意义热力学第二定律是热力学中的重要定律之一,其统计意义可以通过热力学的统计学方法来解释。
热力学第二定律表明,在孤立系统中,不发生外界干扰的情况下,热量不可能从低温物体传递到高温物体。
这个定律的统计学意义是基于热力学理论中的熵的概念。
熵是一个衡量系统无序程度的物理量。
熵越大,系统的无序程度越高。
在孤立系统中,熵的增加是不可避免的,因为它与系统的无序程度有关。
因此,热力学第二定律可以用熵的概念来说明。
在热力学理论中,有一个重要的概念叫做微观状态。
微观状态是指一个系统在某个瞬间的所有粒子的位置、速度和动量等细节参数。
对于一个宏观体系来说,其微观状态的数量非常巨大,因此宏观热力学只考虑了一些平均量,如温度、压力和体积等。
但是,对于一个孤立的宏观体系来说,其微观状态是保持不变的,因此熵也是保持不变的。
但是,如果我们考虑一个孤立的宏观体系与其外界发生相互作用的情况下,就会发现熵的增加是不可避免的。
这是因为,外界的干扰会导致系统微观状态的变化,而微观状态的变化会导致熵的增加。
由于熵的增加代表系统的无序增加,因此热力学第二定律也就表明了系统无序程度的增加是不可避免的。
具体来说,考虑一个受到外界干扰的系统,如果其能量分布保持不变,那么其微观状态数量也是不变的。
这就意味着,任何微观状态的出现的概率都是相等的。
但是,我们可以发现,如果能量分布不均匀,例如在一个被分割成两部分的系统中,把高能量的粒子放在一侧,低能量的粒子放在另一侧,那么高能量与低能量之间就会产生一个能量差,从而导致能量从高温物体流向低温物体,也就是出现了“热流”的现象。
从统计学的角度来看,这种现象是微观状态变化所导致的。
高能量与低能量之间的差异会导致一些微观状态的出现概率比其他微观状态高,因此会引起一部分微观粒子流动的现象,也就是热流现象。
这种现象符合热力学第二定律的要求,也就表明了该定律的统计学意义。
综上所述,热力学第二定律的统计学意义是基于熵的概念,主要是通过微观状态变化引起的无序程度增加来解释的。