铜绿假单胞菌检验原始记录完整版
- 格式:docx
- 大小:53.50 KB
- 文档页数:2


黏液型铜绿假单胞菌感染实验鉴定和病例回顾分析铜绿假单胞菌(pseudomonas aeruginosa,Pa)在由各种原因所致的人体抵抗力低下时引起皮肤感染、呼吸道感染、泌尿道感染、烧伤感染等,亦可导致菌血症、心内膜炎、囊性纤维变性,该菌引起的慢性肺部感染占有较大的比例。
其临床表型分为黏液型及非黏液型。
黏液型铜绿假单胞菌(mucoid pseudomonas aeruginosa,mPa)与非黏液型在生长特点、致病性及药物敏感方面均存在差异。
现对我院分离的一株mPa进行回顾性分析,以此为临床诊疗提供一些帮助。
实验室鉴定一、研究对象临床微生物室分离的一株mPa,药敏试验同时采用纸片琼脂扩散法(K-B法)和肉汤稀释法(MIC法),作对照比较。
二、试剂和仪器深圳迪尔DL-96细菌测定系统及其提供的NE鉴定板条,普通公司的MH肉汤和MH琼脂平板,英国OXOID公司生产的药敏纸片,质控菌株铜绿假单胞菌ATCC27853、大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC25923均购自湖北省临检中心。
三、方法1.菌株鉴定及药敏试验取病患留取的晨痰做涂片和接种哥伦比亚血平板、含万古巧克力平板(三区划线),痰涂片一张行革兰氏染色,一张行萋-尼抗酸染色。
镜检为合格痰(上皮细胞25个/LP),未发现抗酸阳性杆菌。
平板在35℃、C02孵箱培养24h后观察,均长出水滴样菌落,在血平板的第三区,水滴样菌落>5个,半定量判定为4+,具有临床意义。
取巧克力平板上水滴样菌落分纯,第二天做氧化酶试验:阳性。
刮取黏液型菌落接种于营养肉汤,35℃孵育5h后,调节菌液浓度至0.5麦氏单位,按照试验要求接种迪尔公司提供的NE板条;无菌棉拭子蘸取MIC法多余的药敏液接种MH平板,贴药敏纸片。
35℃孵育48h判读结果。
2.结果48h后,利用迪尔DL-96细菌测定系统判读为铜绿假单胞菌(P:99.58),两种方式的药敏结果如下(以2017年更新的CLSI为判读标准):3.比较发现哌拉西林、头孢他啶的药敏结果不相符,美罗培南的K-B抑菌圈直径过大(标准菌株ATCC27853对美罗培南的抑菌圈直径为27~33mm)。


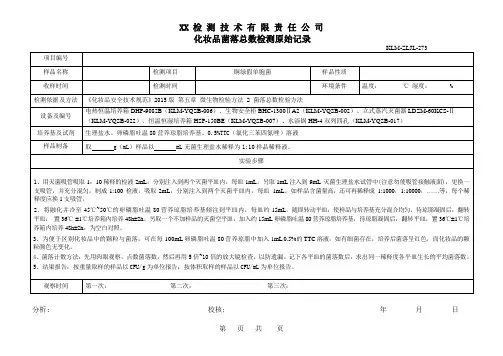

微生物限度检验记录一、检验目的:确认产品是否满足微生物限度要求,保证产品的安全性和质量。
二、检验项目:1.总大肠菌群:用于评估产品是否受到粪便污染。
2.霉菌和酵母菌:用于评估产品是否受到霉菌和酵母菌的污染。
3.沙门氏菌:用于评估产品是否受到沙门氏菌的污染,沙门氏菌是一种常见的食源性病原菌。
4.铜绿假单胞菌:用于评估产品是否受到铜绿假单胞菌的污染,铜绿假单胞菌是一种常见的致病菌。
5.谷氨酰胺酶阳性菌:用于评估产品是否受到谷氨酰胺酶阳性菌的污染,谷氨酰胺酶阳性菌是一种常见的致病菌。
三、检验步骤:1.样品准备:从产品中取得一定量的样品,确保样品的代表性。
2.样品处理:根据产品的不同特性,选择适当的方法进行样品处理,如水解、稀释等。
3.培养基制备:根据所需的检验项目,制备相应的培养基。
4.培养基接种:将处理后的样品接种到相应的培养基中,利用无菌技术确保操作的无菌。
5.培养:将接种过的培养基培养在适宜的温度和湿度条件下,培养一定的时间,一般为24-72小时。
6.检查结果:观察培养基上是否有菌落形成,记录菌落的数量和形态特征。
7.鉴定:对培养出的菌落进行进一步的鉴定,如形态学观察、生理生化特性测试等。
8.统计和分析:根据检查结果,统计并分析微生物的数量,计算出产品的微生物限度。
四、检验结果:1.总大肠菌群:每克不超过100个。
2.霉菌和酵母菌:每克不超过10个。
3.沙门氏菌:每克不得检出。
4.铜绿假单胞菌:每克不得检出。
5.谷氨酰胺酶阳性菌:每克不得检出。
五、检验记录样例:日期:2024年4月1日样品名称:XXX产品检验员:XXX检验项目:1.总大肠菌群结果:每克10个,符合微生物限度要求。
2.霉菌和酵母菌结果:每克2个,符合微生物限度要求。
3.沙门氏菌结果:未检出,符合微生物限度要求。
4.铜绿假单胞菌结果:未检出,符合微生物限度要求。
5.谷氨酰胺酶阳性菌结果:未检出,符合微生物限度要求。
六、结论:根据检验结果,XXX产品符合微生物限度要求,产品安全可靠。

铜绿假单胞菌检测(滤膜法)
录入时间:2015-4-27 10:30:42 来源:青岛海博生物
一、原理
将250mL水样用孔径为0.45μm的滤膜过滤,并将滤膜移至CN琼脂培养基上,于36℃士1℃恒温箱中培养48h,能够在溴化十六烷基三甲铵选择性培养基上生长并产生绿脓菌素,或者能够在溴化十六烷基三甲铵选择性培养基上生长并且氧化酶呈阳性、紫外光(360±20nm)照射下能发荧光、能够利用乙酰胺产氨的革兰氏阴性无芽孢杆菌,经证实为铜绿假单胞菌,则其检测结果为阳性。
二、培养基和试剂
1.假单胞菌琼脂基础培养基/CN琼脂(配制好之后低温避光保存)
2.金氏B(King’s B)培养基(配制好之后低温避光保存)
3.乙酰胺肉汤(用蒸馏水配制,配置好之后低温避光保存)
4.营养琼脂
5.氧化酶试剂
6.钠氏试剂(配制好之后低温避光保存)
7.设备和仪器
8.玻璃器具:所有玻璃器皿使用前需121℃高压蒸汽灭菌15分钟
9.恒温培养箱:36℃±1℃
10.紫外灯:波长应为360±20nm
11.滤膜:直径47mm,微孔径为0.45μm(处理方法:如滤膜未经灭菌,则使用前需先将
滤膜放入烧杯中,加入蒸馏水,置于沸水浴中煮沸灭菌3次,每次15 min。
前两次煮沸后需更换水,用蒸馏水洗涤2次~3次,以除去残留溶剂。
建议使用一次性无菌滤膜。
)12.显微镜:10×~100×
13.冰箱:0℃~8℃
三、操作流程图。

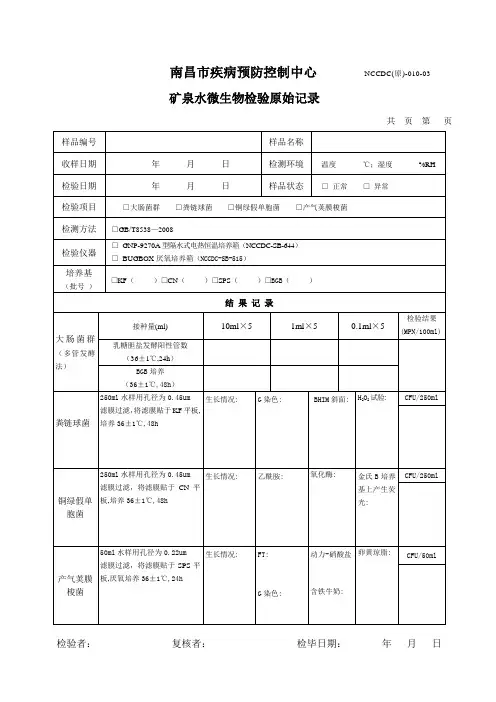
南昌市疾病预防控制中心NCCDC(原)-010-03
矿泉水微生物检验原始记录
共页第页样品编号样品名称
收样日期年月日检测环境温度℃;湿度%RH
检验日期年月日样品状态□正常□异常
检验项目□大肠菌群□粪链球菌□铜绿假单胞菌□产气荚膜梭菌
检测方法□GB/T8538—2008
检验仪器□GNP-9270A型隔水式电热恒温培养箱(NCCDC-SB-644)□BUGBOX厌氧培养箱(NCCDC-SB-515)
培养基
(批号)
□KF()□CN()□SPS()□BGB()
结果记录
大肠菌群(多管发酵法)
接种量(ml)10ml×5 1ml×5 0.1ml×5
检验结果
(MPN/100ml) 乳糖胆盐发酵阳性管数
(36±1℃,24h)
BGB培养
(36±1℃,48h)
粪链球菌250ml水样用孔径为0.45um
滤膜过滤,将滤膜贴于KF平板,
培养36±1℃,48h
生长情况:G染色: BHIM斜面: H2O2试验:CFU/250ml
铜绿假单
胞菌250ml水样用孔径为0.45um
滤膜过滤,将滤膜贴于CN平
板,培养36±1℃,48h
生长情况:乙酰胺: 氧化酶:金氏B培养
基上产生荧
光:
CFU/250ml
产气荚膜
梭菌50ml水样用孔径为0.22um
滤膜过滤,将滤膜贴于SPS平
板,厌氧培养36±1℃,24h
生长情况:FT:
G染色:
动力-硝酸盐
含铁牛奶:
卵黄琼脂:CFU/50ml
检验者:复核者:检毕日期:年月日。

铜绿假单胞菌的菌种鉴定全文共四篇示例,供读者参考第一篇示例:铜绿假单胞菌是一种广泛存在于自然环境中的革兰氏阴性杆菌,也是一种条件致病菌,常见于水和土壤中。
它可以引起多种感染疾病,如呼吸道感染、尿路感染和伤口感染等。
准确鉴定铜绿假单胞菌对于预防和治疗相关感染至关重要。
铜绿假单胞菌的鉴定主要通过形态学、生理学和生化学特征以及分子生物学方法进行。
下面将详细介绍铜绿假单胞菌的菌种鉴定方法。
1. 形态学特征鉴定我们可以通过铜绿假单胞菌在琼脂培养基上的形态学特征来初步鉴定。
铜绿假单胞菌在琼脂培养基上呈不规则的、细长的、呈青绿色的菌落,有时呈褐色或黄色。
在显微镜下观察,可见到细长的革兰氏阴性杆菌。
但仅凭形态学特征鉴定并不够准确,因为有些细菌形态相似,需要进一步进行生理学和生化学检测。
铜绿假单胞菌是一种革兰氏阴性杆菌,不发酵葡萄糖,产生氧化酶和嫌氧酶。
在进行生理学鉴定时,可以利用生理生化分析系统(API 系统)或者其他相关系统进行检测。
通过检测铜绿假单胞菌的碳水化合物利用情况、氧化还原反应及其他生理生化特征,可以更准确地鉴定。
铜绿假单胞菌具有一些特殊的生化学特征,如产生金属蛋白酶、松香酸酶和氢氰酸等。
这些特征可以通过生化学测试来确定。
铜绿假单胞菌还对氧化还原反应有特殊的反应,可以利用氧化还原试剂来进行鉴定。
4. 分子生物学方法鉴定随着分子生物学技术的发展,PCR扩增和16S rRNA测序已成为鉴定铜绿假单胞菌的重要手段。
通过PCR扩增细菌DNA中的特定基因片段,再通过测序比对16S rRNA序列,可以准确识别铜绿假单胞菌。
铜绿假单胞菌的菌种鉴定是一个综合性的过程,需要结合形态学、生理学、生化学和分子生物学等多个方面来确定。
只有准确鉴定了菌种,才能采取针对性的预防和治疗措施。
希望通过本文的介绍,读者对铜绿假单胞菌的菌种鉴定有了更加清晰的认识。
第二篇示例:铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的革兰氏阴性杆菌,广泛存在于自然界中的土壤、水体、植物等环境中。

保健用品微生物检验方法 第3部分:铜绿假单胞菌测定警示——使用本标准的人员应有正规实验室工作的实践经验。
本标准并未指出所有可能的安全问题。
使用者有责任采取适当的安全和健康措施,并保证符合国家有关法规规定的条件。
1 范围本标准规定了保健用品中微生物中铜绿假单胞菌的测定方法。
本标准适用于生产和经营的保健用品中的铜绿假单胞菌测定。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法GB 19489 实验室生物安全通用要求3 术语和定义下列术语和定义适用于本文件。
3.1铜绿假单胞菌 Pseudomonas aeruginosa属于假单胞菌属,为革兰氏阴性杆菌,氧化酶阳性,能产生绿脓菌素。
此外还能液化明胶,还原硝酸盐为亚硝酸盐,在42 ℃±1 ℃条件下能生长。
4 试剂和材料除另有规定外,所有试剂均为分析纯 。
实验用水符合GB/T 6682中二级水的要求。
4.1 灭菌生理盐水:详见附录A.1。
4.2 灭菌液体石蜡:详见附录A.2。
4.3 灭菌吐温-80:详见附录A.3。
4.4 SCDLP:详见附录A.4。
4.5 十六烷基三甲基溴化铵:详见附录A.5。
4.6 乙酰胺:详见附录A.6。
4.7 革兰氏染液:详见附录A.7。
4.8 绿脓菌素测定培养基:详见附录A.8。
4.9 硝酸盐蛋白胨水:详见附录A.9。
4.10 明胶液化培养基:详见附录A.10。
5 仪器和设备5.1 天平:感量0.1 g。
5.2 灭菌刻度吸管:10 mL、5 mL、1 mL。
5.3 高压灭菌器。
5.4 量筒:100 mL、200 mL、2000 mL。
5.5 恒温水浴箱或隔水式恒温箱:44.5 ℃±0.5 ℃。
5.6 无菌锥形瓶:100 mL、200 mL、250 mL、2000 mL。
GB 8538—2016铜绿假单胞菌方法学验证报告一、验证目的验证《食品安全国家标准饮用天然矿泉水检验法GB 8538-2016》-铜绿假单胞菌检验在本实验室的适用性。
二、验证方法样品采样方案依据GB4789.1-2016 《食品微生物学检验总则》的要求进行,本实验样品取三个不同品牌的饮用天然矿泉水的典型样品进行实验,严格按照GB8538-2016进行。
除上述实验程序外,为保证本次验证的科学性和准确性,本次实验添加阳性对照组,对照组由标准菌株铜绿假单胞菌(CMCC(B)10104)接种培养而成,与样品实验程序同时进行。
三、验证设备和试剂1.冰箱:SC-322 青岛海尔电器2.生化培养箱:SPX-150B-Z 上海博迅实业3.电位pH计:PHS-3C+(精确度0.01)成都世纪方舟科技有限公司4.恒温振荡器:SHA-A 江苏金坛环宇科学仪器厂5.菌落计数仪:Scan-500 北京五洲东方科技发展有限公司6.天平:JE-502 上海浦春计量仪器有限公司7.六联不锈钢过滤器北京中兴伟业仪器有限公司8.三用紫外分析仪:ZF-2 上海安亭电子仪器厂培养基和试剂:1.假单胞菌琼脂基础培养基北京陆桥技术股份有限公司2.绿脓菌素测定用培养基北京陆桥技术股份有限公司3.金氏B培养基北京陆桥技术股份有限公司4.营养琼脂北京陆桥技术股份有限公司5.氧化酶试剂北京陆桥技术股份有限公司6.乙酰胺肉汤北京陆桥技术股份有限公司7.三氯甲烷国药集团有限公司8.纳氏试剂北京陆桥技术股份有限公司四、验证环境1.依据《消毒与灭菌效果的评价方法与标准GB15981-1995》定期对高压蒸汽灭菌锅的灭菌效果进行检测评价并记录;2.依据《无菌室消毒灭菌操作规程》定期对对无菌室、生物安全柜进行清洁消毒灭菌并记录;3.依据《实验室质量控制规范食品微生物检测GB/T27405-2008》定期对对无菌室及生物安全柜进行沉降菌检测并记录;4.无菌室检验:详见《XXXX》;五、验证步骤1.操作步骤1. 1水样过滤在100级的洁净工作台进行过滤操作。
铜绿假单胞菌的临床分离和药敏情况分析目的分析铜绿假单胞菌的临床分离和药敏情况,指导临床合理使用抗生素。
方法对本院2016年1月~2017年10月临床分离的524株铜绿假单胞菌采用统一的方法、设备和判断标准进行耐药性检测,使用WHONET5.6进行数据分析。
结果铜绿假单胞菌耐药率在50%以上的抗生素包括复方新诺明、阿莫西林/克拉维酸、氯霉素、头孢噻肟、四环素、氨苄西林、呋喃妥因和头孢唑啉,敏感性高于70%的抗生素包括头孢他啶、哌拉西林、左旋氧氟沙星、头孢吡肟、美洛培南、环丙沙星、亚胺培南、哌拉西林/他唑巴坦、庆大霉素、阿米卡星和多粘菌素B。
结论铜绿假单胞菌的耐药机制复杂,应加强对铜绿假单胞菌的临床分布及耐药性监测,指导临床合理使用抗生素,采取有效的防范措施控制医院感染,采取多种治疗策略最大限度减少铜绿假单胞菌耐药性发展。
[Abstract] Objective To analyze the clinical isolation and drug susceptibility of Pseudomonas aeruginosa and to guide the rational use of antibiotics in clinic. Methods A total of 524 strains of pseudomonas aeruginosa clinically isolated from January 2016 to October 2017 in our hospital were tested for drug resistance using a uniform method,equipment and judgment criteria. And data analysis was performed using WHONET 5.6. Results Antibiotics with pseudomonas aeruginosa drug resistance rate above 50% included cotrimoxazole,amoxicillin/clavulanic acid,chloramphenicol,cefotaxime,tetracycline,ampicillin,nitrofurantoin and cefazolin. Antibiotics with sensitivity greater than 70% included ceftazidime,piperacillin,levofloxacin,cefepime,meropenem,ciprofloxacin,imipenem,piperacillin/tazobactam,gentamicin,amikacin and polymyxin B. Conclusion The mechanisms of drug resistance monitoring of pseudomonas aeruginosa are complicated. The clinical distribution and drug resistance of Pseudomonas aeruginosa should be strengthened to guide the rational use of antibiotics in clinic. Effective preventive measures should be taken to control nosocomial infections and various treatment strategies should be taken to minimize the development of pseudomonas aeruginosa drug resistance.[Key words] Pseudomonas aeruginosa;Drug-resistance;Antibiotics;Meropenem銅绿假单胞菌在自然界分布广泛,是土壤中存在的最常见的细菌之一,在水、空气、正常人的皮肤、呼吸道和肠道等都有本菌存在,该菌存在的重要条件是潮湿的环境,本菌为条件致病菌,是医院内感染的主要病原菌之一。
菌落总数测定原始记录事部:品名称:境温度:℃人:日期:依据:GB 4789.2 — 20101.主要:天平培养箱2.程:□ 菜取:称取 25g 品置盛有225ml 生理水的无菌均容器内均,1:10品匀液。
□空气品:室内面小于 30 ㎡,在角里中外三点距 1 米位置取取稀注平板室内面大于30 ㎡,在四角和中位置取取将数平板脂培养基打开平皿盖放置在工作台上,静置 5 分□手部取:被人五指并,用浸泡生理水的棉,从指尖到指端涂搽两次,剪去手接触部分棉棒,将棉放入10ML 的生理水中□餐具接触面取:用浸泡生理水的棉,在被物体表面取25CM2 的面,涂抹两次使其充分接触,剪去手接触部分棉棒,将棉放入10ML 的生理水中□空气品:直接培养箱培养□接触面品:用 1mL 无菌吸管吸取品匀液1mL ,沿管壁慢注于盛有9mL 生理水的无菌管震或者使其混合均匀制成 1 :100 液;按上面程序更吸管制作1:1000 液;分将□1 :10、□1 :100 、□1: 1000 液吸取1ML 于无菌平皿内,每个稀度做两个平皿,分取1ML 空白稀液作空白比;及将15-20ML的46度平培养板数培养基注平皿,并使其混合均匀;普通品36 ℃±1 ℃培养48h ±2h 。
水品30℃±1℃培养起止培养 72h ±3h 。
起:止:1 : 10 1: 100 1:1000 空白1 2 1 2 1 2 1 2察果(个)算果告3.算方法:1 )若只有一个稀度平板上的菌落数在适宜数范内,算两个平板菌落数的平均,平均乘以相稀倍数,作每克(或毫升)中菌落数果。
2 )若有两个稀度的平板菌落数在适宜数范内,按式(Ⅰ)算:N= ∑C/(n 1+0.1n 2)d⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯(Ⅰ)再将式中:N——样品中菌落总数;∑C——平板(含适宜范围菌落总数的平板)菌落数之和;n 1——第一个适宜稀释度平板数;n 2——第二个适宜稀释度平板数;d ——稀释因子(第一稀释度)。