人教社高中化学必修三金属晶体
- 格式:doc
- 大小:44.50 KB
- 文档页数:4










2020高中化学金属晶体教案金属阳离子所带电荷越高,半径越小,金属键越强,熔沸点越高,硬度也是如此。
接下来是小编为大家整理的2020高中化学金属晶体教案,希望大家喜欢!2020高中化学金属晶体教案一一、教材分析本节是人教版化学选修3《物质结构与性质》第三章第三节的教学内容,是在第三章第一节《晶体的常识》和第二节《分子晶体与原子晶体》基础上认识金属晶体。
学生已经具备了晶体和晶胞的初步知识,对微观粒子的排列也有了一定的认识。
能够较好的完成老师布置的课前预习。
本节教学内容包含知识点主要有金属的内部结构、、共性、电子气理论、金属晶体的结构与金属性质的关系、金属晶体的四种原子堆积模型等,需要三个课时才能完成。
本节课是第二课时,主要探究金属晶体4种基本堆积模型及与分子晶体、原子晶体比较。
二、教学目标1、知识技能目标:1)了解金属晶体内原子在二维空间的两种排列方式,2) 掌握简单立方堆积和体心立方堆积以及二者的特点和区别2 、过程方法目标:1)通过对金属晶体结构的学习与研究,培养学生观察能力,空间想像能力等2)通过两个学与问制作模型训练学生的动手能力和空间想象能力。
3、情感态度价值观:以小组讨论交流、实践活动制作模型的方式培养学生的合作意识和严谨的科学态度三、教学的重点和难点1、教学重点:金属晶体的4种基本堆积模型2、教学难点:金属晶体的4种基本堆积模型根据微观晶胞图片和动画的相关教学材料,制作成PPT,使微观的粒子直观化,形象化,增强学生的空间想象能力。
本节是第三节课,学生已经具备了晶体和晶胞的初步知识,对微观粒子的排列也有了一定的认识,在二维平面排列和非密置层堆积的问题上,学生能够独立完成。
本节中的难点在于密置层堆积形成的镁型和铜型的堆积方式,他正是本课的难点和重点,学生可以根据自己预习和模型的制作,再结合教师的多媒体展示,共同完成学习的目标。
四、教学方法:科学探究:质疑----实验----分析----解决---归纳---比较多媒体课件与自制教具相结合的互动探究式课堂教学模式师生探究模式:教师主动参与到学习小组的探究活动中,适时调控学生的探究进展和探究方向,在交流展示时适时恰当评价,调动学生的积极性,并形成集体性正确的观点和解题思路。
目标与素养:1.了解金属键的含义,能用“电子气理论”解释金属的一些物理性质。
(宏观辨识与微观探析)2.了解金属晶体的4种堆积模型。
(证据推理与模型认知)3.了解混合晶体石墨的结构与性质。
(宏观辨识与微观探析)一、金属键与金属晶体的性质1.金属键(1)概念:金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。
(2)成键粒子是金属阳离子和自由电子。
(3)金属键的强弱和对金属性质的影响1金属键的强弱主要决定于金属元素的原子半径和价电子数。
原子半径越大、价电子数越少,金属键越弱;反之,金属键越强。
2金属键越强,金属的熔、沸点越高,硬度越大。
2.金属晶体的性质(1)在金属晶体中,原子间以金属键相结合。
(2)金属晶体的性质:优良的导电性、导热性和延展性。
(3)用电子气理论解释金属的性质微点拨:1温度越高,金属的导电能力越弱。
2合金的熔、沸点比其各成分金属的熔、沸点低。
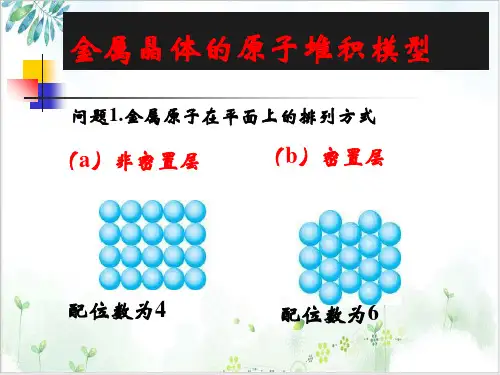
二、金属晶体的原子堆积模型1.二维平面放置金属原子在二维平面里放置得到两种方式,配位数分别为4和6,可分别称为非密置层和密置层。
2.三维空间模型(1)简单立方堆积:按非密置层(填“密置层”或“非密置层”)方式堆积而成,相邻非密置层原子的原子核在同一直线上的堆积,如图。
(2)体心立方堆积:按非密置层(填“密置层”或“非密置层”)方式堆积而成。
将上层金属原子填入下层的金属原子形成的凹穴中,并使非密置层的原子稍稍分离,每层均照此堆积,如图。
(3)六方最密堆积和面心立方最密堆积:六方最密堆积和面心立方最密堆积是按照密置层(填“密置层”或“非密置层”)的堆积方式堆积而成,配位数均为12,空间利用率均为74%。
六方最密堆积面心立方最密堆积按ABABABAB……的方式堆积按ABCABCABC……的方式堆积1.结构特点——层状结构(1)同层内,碳原子采用sp2杂化,以共价键相结合形成平面六元并环结构。
所有碳原子p轨道平行且相互重叠,p轨道中的电子可在整个碳原子平面中运动。
第二节金属晶体
金属有许多共同的物理性质,如容易导电、导热、有延展性、有金属光泽,等等。
金属为什么会具有这些性质呢?
我们已经知道离子晶体、分子晶体和原子晶体都有不同的特性,而这些特性一般是由它们的晶体结构所决定的。
那么,我们是否可以想象,金属的共同性质也是由金属的结构所决定的呢?
金属(除汞外)在常温下一般都是晶体。
通过X射线进行研究发现,在金属中,金属原子好像许多硬球一层一层紧密地堆积着,每一个金属原子周围有许多相同的金属原子围绕着。
图1-9是某种金属晶体的结构示意图。
由于金属原子的外层电子比较少,金属原子容易失去外层电子变成金属离子。
金属原子释出电子后形成的金属离子按一定规律堆积,释出的电子则在整个晶体里自由运动,称为自由电子(如图1-10)。
金属离子与自由电子之间存在着较强的作用,使许多金属离子结合在一起。
通过金属离子与自由电子之间的较强作用形成的单质晶体,叫做金属晶体。
在金属晶体里,自由电子不专属于某几个特定的金属离子,它们几乎均匀地分布在整个晶体中,被许多金属离子所共有。
上面我们介绍了有关金属晶体的一些知识,下面我们利用这些知识来简单解释金属的一些共同性质。
一、导电性
我们都知道金属容易导电,用铜、铝等制成的电线、电缆为我们的生活带来了很大的方便。
那么,金属为什么能导电呢?在金属晶体中,存在着许多自由电子,这些自由电子的运动是没有一定方向的。
但是在外加电场的条件下,自由电子就会发生定向运动,因而形成电流。
所以金属容易导电。
二、导热性
我们日常使用的烹饪器具,有许多是金属制品,这说明金属有很好的导热性。
金属的导热性也与金属晶体里自由电子的运动有关。
自由电子在运动时经常与金属离子碰撞,从而引起两者能量的交换。
当金属某一部分受热时,在那个区域里的自由电子能量增加,运动速度加快,于是,通过碰撞,自由电子把能量传给其他金属离子。
金属容易导热,就是由于自由电子运动时把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
三、延展性
大多数金属都具有较好的延展性,在加工时能被压成薄片或拉成细丝,制成各种材料和器具。
金属的延展性可以从金属晶体的结构特点加以解释。
当金属受到外力作用时,晶体中的各原子层就会发生相对滑动(如图1-11),由于金属离子与自由电子之间的相互作用没有方向性,滑动以后,各层之间仍能保持这种相互作用,在外力作用下,金属虽然发生了形变,但不会导致断裂。
所以,金属一般都有不同程度的延展性。
对于金属具有的一些共同性质我们作了简单的解释,但是不同的金属在某些性质方面,如密度、硬度、熔点等,又表现出很大的差别。
这些性质与金属原子本身、金属晶体中金属原子的排列方式等因素有关,在此就不作介绍了。
讨论
试举例比较离子晶体、分子晶体、原子晶体和金属晶体的物理性质。
习题
一、选择题
1.金属的下列性质中,不能用金属晶体结构加以解释的是
[ ]
A.易导电 B.易导热 C.有延展性 D.易锈蚀
2.金属晶体的形成是因为晶体中存
在 [ ]
A.金属离子间的相互作用
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
3.金属能导电的原因
是 [ ]
A.金属晶体中金属阳离子与自由电子间的作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
二、问答题
1.为什么金属容易导电、导热并具有延展性,而通常状况下离子晶体却没有这些性质?
2.有四种固态物质:Cu、Si、Ne、KCl。
下列四种有关性质的叙述各适用于哪种物质?
(1)由分子间作用力结合而成,熔点很低。
(2)固体易导电,熔点在1000℃左右。
(3)由共价键结合成网状晶体,熔点很高。
(4)固体不导电,但溶于水或熔融后可导电。