高考化学复习铝及铝合金
- 格式:ppt
- 大小:612.00 KB
- 文档页数:41

高考化学一轮复习:铝及其化合物知识点总结(一)铝单质——Al(两性单质)1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高,有良好的导电、导热性和延展性。
2、用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金。
3、铝合金特点:①密度小①强度高①塑性好①制造工艺简单①成本低①抗腐蚀力强4、化学性质:铝是较活泼的金属,自然界中没有铝单质(1)与非金属:4Al + 3O2 == 2Al2O3生成致密的氧化膜起保护作用。
(2)与酸的反应:2Al + 6HCl == 2AlCl3+ 3H2↑ 2Al + 6H+ == 2Al3+ + 3H2↑钝化:在常温下,铝与浓硝酸、浓硫酸反应,在表面生成致密的氧化膜,阻止进一步反应,保护铝。
(3)与碱的反应:2Al + 2NaOH + 6H2O == 2Na[Al(OH)4] + 3H2↑ 2Al + 2OH− + 6H2O == 2[Al(OH)4]− +3H2↑ (4)与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
(5)铝热反应:高温下铝与某些金属氧化物的反应(如Fe、Cr、Mn、V的氧化物)2Al + Fe2O3Al2O3 + 2Fe。
Al和Fe2O3的混合物叫做铝热剂(混合物)。
可用于焊接钢轨、冶炼金属。
(二)氧化铝——Al2O3(两性氧化物)白色固体,熔点高(2054①),常作为耐火材料和冶炼金属铝的原料。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
1、与酸的反应:Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O2、与碱的反应:Al2O3 + 2NaOH + 3H2O == 2Na[Al(OH)4] Al2O3 + 2OH− + 3H2O == 2[Al(OH)4]−3、电解熔融的氧化铝制备金属铝:(三)氢氧化铝——Al(OH)3(两性氢氧化物)白色难溶于水的胶状沉淀,是两性氢氧化物,加热易分解。

第2讲 铝及其重要化合物[考纲要求] 了解铝及其重要化合物的主要性质和应用。
考点一 铝的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝元素在地壳中含量丰富,仅次于硅。
自然界中的铝全部以化合态存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式: ①Al O 2⎪⎪⎪⎪――→ 常温形成致密的氧化膜――→ 点燃4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al 酸⎪⎪⎪⎪――→氧化性酸遇冷的浓硫酸或浓硝酸钝化――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4.对比记忆镁的化学性质铝镁与非金属反能被Cl 2、O 2氧化2Mg +O 2=====点燃2MgO应3Mg +N 2=====点燃Mg 3N 2 与水反应 反应很困难 能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑与碱反应 能溶于强碱溶液 不反应与某些氧化物反应能与Fe 2O 3、MnO 2、Cr 2O 3等金属氧化物发生铝热反应能在CO 2中燃烧:2Mg +CO 2=====点燃2MgO +C5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
深度思考1.铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较好的抗腐蚀性能? 答案 铝在常温下迅速被氧气氧化,形成一层致密的氧化膜,保护铝不再被氧化,因而铝制品通常具有较强的抗腐蚀性能。
2.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H 2SO 4或浓HNO 3?答案 常温下浓H 2SO 4、浓HNO 3能使铝钝化(在表面形成一层致密的氧化膜),阻止反应继续进行。

高考知识点铝元素高考知识点:铝元素铝(Al)是一种广泛应用的金属元素,其化学符号为Al,原子序数为13,在元素周期表中属于第3周期、3族元素。
铝元素的发现和应用对于高考化学知识非常重要。
1. 铝元素的发现历史铝元素最早由丹麦化学家汉斯·克里斯蒂安·厄尔斯泰德(Hans Christian Ørsted)于1825年发现。
他通过电解氯化铝的方法成功分离出金属铝,得到了纯度较高的铝样品,并确定了其化学性质。
2. 铝元素的物理性质铝元素是一种轻质、耐腐蚀的金属。
它的密度为2.7 g/cm³,熔点为660.32摄氏度,沸点为约2467摄氏度。
铝具有良好的导热性和导电性,属于典型的热电导金属。
3. 铝元素的化学性质(1)反应性:在常温下,铝元素比较稳定,不易与空气中的氧气发生反应。
然而,当铝暴露在空气中时,其表面会形成一层氧化铝(Al2O3)的致密薄膜,这层薄膜能够有效地防止进一步氧化。
(2)与酸反应:铝可以和酸类物质发生反应,生成相应的盐和氢气。
例如,铝和硫酸反应可以产生硫酸铝和氢气的反应。
4. 铝元素的应用铝是一种广泛应用的金属,其应用领域包括但不限于以下几个方面:(1)建筑领域:铝具有较低的密度和良好的耐腐蚀性,因此常用于制作建筑材料和构件,如铝合金窗户、铝合金门、铝合金屋顶等。
(2)电子领域:铝具有良好的导电性和导热性,因此广泛应用于电子器件的导线、散热片等部件。
(3)包装领域:铝具有较好的气密性和韧性,常用于制作食品和药品的包装材料,如铝箔和铝罐。
(4)航空航天领域:铝具有轻质、高强度的特点,被广泛应用于航空航天器的制造,如飞机、火箭等。
5. 铝元素的环境问题铝的生产和应用过程可能会对环境造成一定的影响。
例如,铝的生产需要大量的电能,其主要原料为铝矾土,采矿过程可能对土地和水资源造成一定的损害。
此外,铝与某些物质的结合可能会产生有毒的废弃物,对环境和生态系统造成污染。

第3讲从铝土矿到铝合金[考纲要求] 1.了解铝的主要性质及应用。
2.认识铝热反应及其应用。
3.了解铝的重要化合物的主要性质及应用。
考点一铝1.铝的结构和存在铝位于元素周期表______________,原子结构示意图为________________。
铝元素在地壳中含量丰富,仅次于____。
自然界中的铝全部以________态存在。
2.金属铝的物理性质________色有金属光泽的固体,有良好的____________、__________和传热性等,密度较小,质地柔软。
3.金属铝的化学性质根据下列转化关系,完成化学方程式。
①________________________________________________________________________;②________________________________________________________________________;③________________________________________________________________________;④________________________________________________________________________;⑤________________________________________________________________________;⑥________________________________________________________________________;⑦________________________________________________________________________。
1.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?2.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。
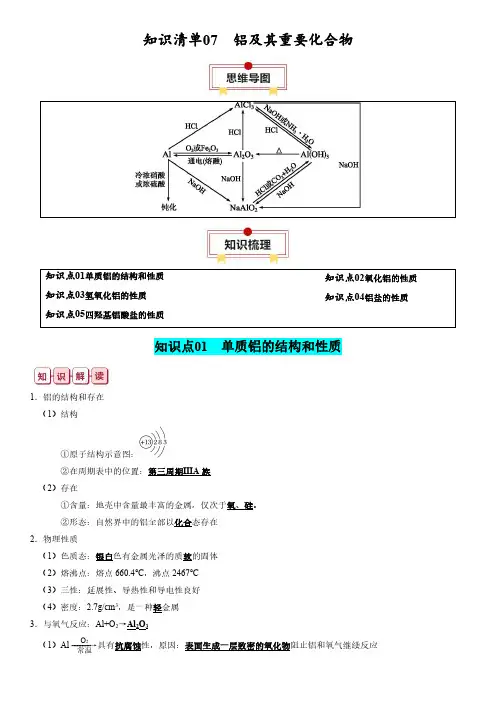
知识清单07铝及其重要化合物知识点01单质铝的结构和性质知识点03氢氧化铝的性质知识点05四羟基铝酸盐的性质知识点02氧化铝的性质知识点04铝盐的性质知识点01单质铝的结构和性质1.铝的结构和存在(1)结构①原子结构示意图:②在周期表中的位置:第三周期ⅢA 族(2)存在①含量:地壳中含量最丰富的金属,仅次于氧、硅。
②形态:自然界中的铝全部以化合态存在2.物理性质(1)色质态:银白色有金属光泽的质软的固体(2)熔沸点:熔点660.4℃,沸点2467℃(3)三性:延展性、导热性和导电性良好(4)密度:2.7g/cm 3,是一种轻金属3.与氧气反应:Al+O 2→Al 2O 3(1)Al -------→O 2常温具有抗腐蚀性,原因:表面生成一层致密的氧化物阻止铝和氧气继续反应(2)Al -------→O 2点燃放出大量的热,发出耀眼的白光4.铝热反应(1)实验装置(2)反应:2Al+Fe 2O 32Fe+Al 2O 3(3)本质:Al 和不活泼金属氧化物的置换反应(4)引发操作:加入少量KClO 3,插上Mg 条并点燃(5)特点:反应放出大量的热,得到熔融的金属(6)应用:冶炼V 、Cr 、Mn 等难熔金属;焊接钢轨①冶炼V :10Al+3V 2O 55Al 2O 3+6V ②冶炼Cr :2Al+Cr 2O 32Cr+Al 2O 3③冶炼Mn :4Al+3MnO 23Mn+2Al 2O 3④冶炼Cu :2Al+3Cu 2O6Cu+Al 2O 35.铝与酸的反应(1)氧化性酸①Al ---------------------→浓硝酸、浓硫酸常温钝化②Al ---------------------→浓硝酸、浓硫酸加热剧烈反应,分别放NO 2和SO 2气体③Al ----------→稀硝酸常温放NO 气体(2)非氧化性酸:Al ---------------------→稀盐酸、稀硫酸常温放H 2①关系式:2Al~6H +~3H 2↑②离子方程式:2Al+6H +2Al 3++3H 2↑6.铝与强碱溶液的反应(1)化学:2Al+2NaOH+6H 2O 2Na [Al (OH )4]+3H 2↑(2)离子:2Al+2OH -+6H 2O2[Al (OH )4]-+3H 2↑(3)铝和强碱溶液的反应过程①置换反应:2Al+6H2O2Al (OH )3+3H 2↑②中和反应:Al (OH )3+NaOH Na [Al (OH )4]③还原剂是Al ,氧化剂是H 2O7.铝与盐溶液的置换反应(1)CuSO 4-------→Al Cu ;AgNO 3-------→AlAg(2)FeCl 3-------→Al少量Fe 2+;FeCl 3-------→Al过量Fe易错点:铝的易错知识点(1)铝是活泼金属,但铝的抗腐蚀性强,因为铝的表面有一层致密的氧化物薄膜。

高考化学压轴题之铝及其化合物推断题(高考题型整理,突破提升)附答案解析一、铝及其化合物1.Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值(1)步骤①提高酸溶速率的措施__(任填一条即可)。
固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。
该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
【答案】加热/搅拌/粉碎/适当提高稀硫酸的浓度(任写一条) SiO2 4.9≤pH<5.5 使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3 + 2Cr3+ +7OH- + H2O =2Cr2O72− + 3Bi(OH)3↓+3Na+蒸发浓缩、冷却结晶、过滤洗涤干燥 Cr2O72− + 6Fe2++14H+ = 2Cr3+ + 6Fe3++7H2O 6.4×10−14 2.78【解析】【分析】铬铁矿中的FeO 、Cr 2O 3和Al 2O 3均能溶于硫酸,SiO 2不溶,过滤,向滤液中加入双氧水,氧化亚铁离子,步骤③的目的是使Fe 3+、Al 3+沉淀,过滤,向滤液中加入NaBiO 3、NaOH ,能将Cr 3+转化为Cr 2O 72−,过滤,将滤液蒸发浓缩、冷却结晶、过滤洗涤干燥得到Na 2Cr 2O 7·2H 2O 。


高考化学合金知识点归纳化学合金是通过将两种或更多金属或非金属物质进行合理配比和共熔混合,形成具有新的物理和化学性质的材料。
它在工业生产和科学研究中扮演着重要的角色。
下面将对高考化学中与合金相关的知识点进行归纳,以帮助考生复习备考。
一、合金的分类1. 根据成分分类:a. 金属合金:由两种或多种金属元素形成,如铜铝合金、铝镁合金等。
b. 非金属合金:由金属和非金属元素形成,如硬质合金。
2. 根据组织结构分类:a. 网状混合物:由多个金属固溶体相互共存而形成,如黄铜。
b. 相间混合物:由两种或多种金属的组成物理性质不同而分别存在的结构形成,如钢。
c. 基体中夹杂有金属物质:由一种或多种杂质在金属基体中形成,如钎料。
二、合金的性质1. 强度与韧性:合金的强度和韧性较纯金属有所提高,适用于制造高强度的结构材料。
2. 延展性和可塑性:合金的延展性和可塑性通常比纯金属差,但仍然具有一定程度的可加工性。
3. 熔点:合金的熔点通常低于其组成元素的熔点,使得加工更加方便。
4. 电导性和热导性:合金的电导性和热导性因成分和组织结构的不同而有所变化。
5. 抗蚀性:某些合金具有良好的抗腐蚀性能,可用于制造耐腐蚀设备。
三、常见的金属合金1. 铜合金:黄铜、铝青铜等,常用于制作零件、管道等。
2. 铝合金:铝铜合金、铝镁合金等,常用于制造飞机、汽车等工业产品。
3. 镍合金:镍铬合金、镍钴合金等,常用于制造航空发动机、化工设备等。
4. 钛合金:钛铝合金、钛锌合金等,常用于制造航空航天器材、人工关节等。
四、非金属合金的应用1. 硬质合金:由金属与非金属(如钨钴合金)或多种金属组合而成,用于制作刀具、模具等。
2. 聚合物基复合材料:由聚合物与纤维增强材料等组合而成,具有轻量化、高强度等优点,用于航空、轻工等领域。
五、合金的制备方法1. 熔融法:将合金成分按一定比例加热熔融后冷却固化。
2. 粉末冶金法:将金属粉末与非金属粉末按一定比例混合,经过成形和高温烧结制得合金。

高考化学铝知识点总结高考是每个学生学习生涯中的重要节点,考试科目的复习备考相当关键。
对于化学来说,铝是一个非常重要的元素,掌握铝的知识点对于高考化学的复习备考至关重要。
本文将系统总结高考化学中与铝相关的知识点,帮助学生更好地备考。
第一节:铝的基本性质1. 物理性质:铝是一种银白色的轻金属,具有良好的导电性和导热性。
它的密度相对较低,比强度较高,是一种重要的结构材料。
2. 化学性质:铝是活泼的金属,容易与氧气、氯气等发生反应。
在常温下,表面会形成一层氧化铝膜,保护铝不被进一步氧化。
3. 合金应用:铝可以与其他金属形成多种合金,如铝镁合金、铝铜合金等。
这些合金具有较高的强度和耐腐蚀性,广泛应用于航空航天、汽车制造等领域。
第二节:铝的制取与冶炼1. 制取方法:铝主要通过电解法制取,即利用电解质溶液中的氧化铝进行电解,使铝离子还原为铝金属。
2. 冶炼过程:铝冶炼主要包括压碎、浸出、纯化和电解等步骤。
其中,浸出是将铝矿经酸浸出,得到氧化铝的过程;纯化是通过氧确保铝产物的纯度;电解是最关键的步骤,通过电解氧化铝融液,得到纯度较高的铝金属。
第三节:铝的反应性1. 与非金属元素的反应:铝可以与氧气反应生成氧化铝,与硫反应生成硫化铝,与氯反应生成氯化铝等。
2. 与酸的反应:铝可以与稀酸反应生成对应的盐和氢气。
3. 与碱的反应:铝可以与碱反应生成相应的盐和氢气。
第四节:铝的应用1. 结构材料:铝具有良好的强度和轻质特性,广泛应用于航空航天、汽车制造等领域,例如飞机、汽车车身等。
2. 包装材料:铝具有良好的抗腐蚀性和隔热性,广泛应用于食品、药品等包装材料,例如铝箔。
3. 耐高温材料:铝可以作为喷气发动机等高温设备的结构材料,因为它具有较高的熔点和抗热膨胀性。
4. 防腐蚀涂层:由于铝本身会在表面形成氧化铝膜,因此可以作为其他金属的防腐蚀涂层材料,例如镀铝。
总结:通过对高考化学铝知识点的总结,我们可以清晰地了解到铝的基本性质、制取与冶炼方法、反应性以及广泛的应用领域。

第4章第3节 金属材料1.结合真实情境中的应用实例或通过实验探究,了解常见金属材料的主要性质,了解其在生产、生活中的应用。
2.结合实例认识金属性质的多样性,了解通过化学反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保护中的重要作用。
1.本节内容重点考查:(1)合金的物理性质与其成分金属的物理性质比较;(2)铝、铜及其重要化合物的主要性质。
题型较多,有选择题、流程图题、综合推断题及实验探究题。
流程图题、实验探究题难度较大。
2.复习备考过程中,多注重铁、铜、铝与其他金属材料相结合的流程图题和实验探究题。
内容索引第一环节 必备知识落实第二环节 关键能力形成第三环节 核心素养提升第一环节 必备知识落实1铝及其化合物的性质知识筛查1.铝的性质和应用(1)铝的原子结构与物理性质。
(2)金属铝的化学性质。
特别提醒常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是两者能使铝发生钝化,而不是铝与浓硫酸、浓硝酸不反应。
能与铝反应产生氢气的溶液可能呈酸性也可能呈强碱性。
(3)铝的制备及用途。
①制备:2Al2O3(熔融) 4Al+3O2↑。
②用途:a.纯铝用作导线。
b.铝合金制备汽车、飞机、生活用品等。
2.铝的重要化合物名称氧化铝(Al2O3)氢氧化铝[Al(OH)3]物理性质白色固体,熔点很高白色胶状物质,难溶于水化学性质与酸反应Al2O3+6H+══2Al3++3H2O Al(OH)3+3H+══Al3++3H2O 与碱反应Al2O3+2OH-+3H2O══2[Al(OH)4]-Al(OH)3+OH-══[Al(OH)4]-加热不分解2Al(OH)3 Al2O3+3H2O名称氧化铝(Al2O3)氢氧化铝[Al(OH)3]制备方法Al(OH)3加热分解①Al3+与氨水反应②向[Al(OH)4]-溶液中通入CO2③可溶性铝盐溶液与四羟基合铝酸盐溶液混合主要用途①作耐火材料②冶炼铝的原料①制药②净水作用知识巩固1.判断下列说法是否正确,正确的画“√”,错误的画“×”。
铝及其化合物【学习目标】1.铝及其化合物的性质及用途2.铝三角及图像问题3.铝热反应◆感知高考1. [2020·江苏]下列有关物质的性质与用途具有对应关系的是A. 铝的金属活泼性强,可用于制作铝金属制品B. 氧化铝熔点高,可用作电解冶炼铝的原料C. 氢氧化铝受热分解,可用于中和过多的胃酸D. 明矾溶于水并水解形成胶体,可用于净水【答案】D【解析】A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;故选D。
2.[2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是()A. 明矾可用作净水剂和消毒剂B. 利用铝热反应可冶炼高熔点金属C. 铝可用作包装材料和建筑材料D. 氢氧化铝可用作治疗胃酸过多的药物【答案】A【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。
C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
◆核心知识1.铝的结构和存在铝位于元素周期表,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
【答案】第3周期ⅢA族,。
2.金属铝及其化合物的化学性质(1)转化关系①理清知识主线Al→Al2O3←Al(OH)3→⎩⎪⎨⎪⎧NaAlO2AlCl3Al2(SO4)3KAl(SO4)2·12H2O②形成网络构建(2)重要反应方程式(用方程式回答下列问题)①用化学方程式表示除去铁粉中的铝粉。
冠夺市安全阳光实验学校铝及其化合物【考向分析】【要点讲解】要点1. 铝铝元素在元素周期表中位于第三周期ⅢA族。
铝为银白色金属,熔点为660.40C,沸点为24670C密度为2.7g·cm-3,导电性仅次于银、铜和金。
1.铝跟非金属反应:常温下,铝被空气里的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续与氧气反应。
铝在空气中强热:4Al+3O 22Al2O3(反应放出大量的热和耀眼的白光,因此铝可用于制造燃烧弹、信号弹、推进剂等。
铝与氮气在高温下反应:2Al+N 22AlN ,铝容易和卤素反应,常温下和氯气激烈化合生成三氯化铝;在溴中燃烧铝粉生成三溴化铝。
在高温下也能和硫、氮气、碳直接化合成Al2S3、AlN、Al4C3(2000℃)。
温馨提示:将未打磨的铝箔在酒精灯火焰上加热,发现铝箔发红卷缩,变暗失去光泽,熔化不落下(表面有氧化膜,因此不能燃烧)。
将已打磨的铝箔在酒精灯火焰上加热,发现铝箔也卷缩,变暗失去光泽,熔化不落下(打磨后铝箔表面又很快形成氧化膜,阻止了铝的燃烧)。
2.铝与酸反应(1)与非氧化性强酸(稀硫酸、盐酸)反应:2Al+3H2SO4=Al2(SO4)3+3H2↑2Al+6H+ =2Al3++3H2↑(2)常温下,铝、铁遇浓硫酸、浓硝酸发生钝化。
所以可用铝制容器盛装浓硫酸或浓硝酸。
(3)加热时,铝与热浓硫酸、浓硝酸反应:2Al+6H2SO4(浓)Al2(SO4)3+3SO2↑+6H2O(4)铝与稀硝酸反应不产生H2。
3.铝与强碱溶液反应:2Al+6H2O=Al(OH)3↓+3H2↑,Al(OH)3+NaOH=NaAlO2+2H2O。
上述两个反应叠加得:2Al+2NaOH+2H2O= 2NaAlO2+3H2↑温馨提示:Al既能与强酸反应,又能与强碱溶液反应,Al与酸、碱反应生成氢气的实质都是Al――→失3e-Al3+,所以Al无论与酸反应还是与碱反应,Al与H2的关系都是2Al~3H2。
目夺市安危阳光实验学校第二节铝及其重要化合物题号 1 2 3 4 5 5-1 6 6-1 7 8答案一、单项选择题1.铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家就会对人体造成危害。
下列关于铝元素的说法正确的是( )A.铝在空气中不易氧化是因为其性质不活泼B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物C.明矾可用于饮用水的杀菌消毒D.硫酸铝铵常用作面粉膨化剂,该物质不溶于水解析:铝在空气中会与O2反应生成致密的氧化物薄膜,A错误;Al(OH)3能与盐酸反应,可做胃药(胃舒平的主要成分即为其),B正确;明矾溶于水生成Al(OH)3胶体,具有吸附杂质的性能,通常用作净水剂,但不能用于杀菌消毒,C错误;铵盐都溶于水,D错误。
答案:B2.下列有关反应现象的描述错误的是( )A.镁在空气中燃烧发出耀眼的白光B.蘸有NaCl的铂丝在酒精灯上灼烧,火焰为黄色C.铝箔在空气中加热失去光泽,但熔化的铝并不滴落D.将一小块钠投入到盛有乙醇的烧杯中,钠漂浮在液面上,熔成小球,四处游动解析:镁在空气中燃烧反应为2Mg+O2=====点燃2MgO,现象为发出耀眼的白光,A正确;钠元素的焰色反应为黄色,B正确;因为Al在加热时生成的是Al2O3,且Al2O3的熔点比Al的熔点高,所以熔化的铝并不滴落,C正确;钠密度大于乙醇,不会浮在液面上,且钠与乙醇反应不太剧烈,不能熔成小球,D错误。
答案:D3.下列关于铝的叙述中正确的是( )A.铝合金是一种混合物,它比纯铝的熔点高B.由于铝的导电性比铜、银都强,所以常用其制造电线、电缆C.由于铝具有强还原性,所以可以通过铝热反应冶炼某些高熔点金属D.常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸解析:合金的熔点比成分金属低,A错误;导电性Ag>Cu>Al,但从价格上考虑,一般选择Al制造电线、电缆,B错误;可用铝热反应冶炼Cr、Mn、Fe、W等高熔点,活泼性比Al弱的金属,C正确;常温下铝被浓硫酸钝化,发生了化学反应,D错误。