4.物质结构基础-复习版
- 格式:pptx
- 大小:1.50 MB
- 文档页数:48

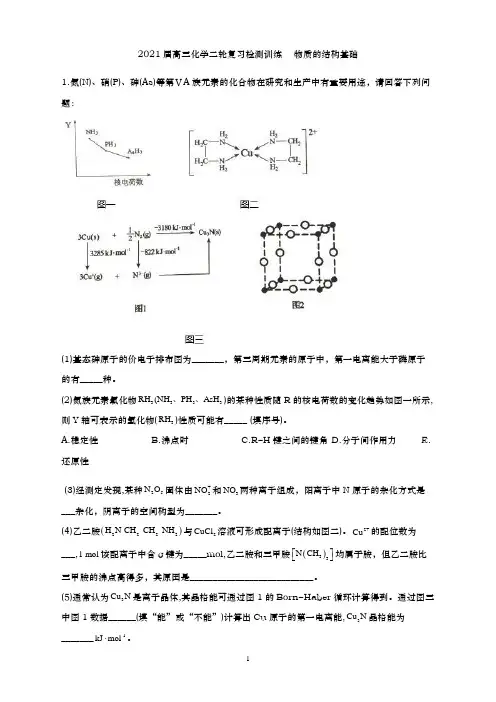
2021届高三化学二轮复习检测训练 物质的结构基础1.氮(N)、硝(P)、砷(As)等第ⅤA 族元素的化合物在研究和生产中有重要用途,请回答下列问题:(1)基态砷原子的价电子排布图为_______,第三周期元素的原子中,第一电离能大于磷原子的有_____种。
(2)氮族元素氯化物3333RH NH PH H (As 、、)的某种性质随R 的核电荷数的变化趋势如图一所示,则Y 轴可表示的氢化物(3RH )性质可能有_____ (填序号)。
A.稳定性 B.沸点时 C.R−H 键之间的键角 D.分子间作用力 E.还原性(3)经测定发现,某种25N O 固体由+2NO 和-3NO 两种离子组成,阳离子中N 原子的杂化方式是___杂化,阴离子的空间构型为_______。
(4)乙二胺()2222H N-CH -CH -NH 与2CuCl 溶液可形成配离子(结构如图二)。
2+Cu 的配位数为___,1 mol 该配离子中含σ键为_____mol,乙二胺和三甲胺()33N CH ⎡⎤⎣⎦均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是___________________________。
(5)通常认为3Cu N 是离子晶体,其晶格能可通过图1的Born −Haber 循环计算得到。
通过图三中图1数据______(填“能”或“不能”)计算出Cu 原子的第一电离能,3Cu N 晶格能为_______-1kJ mol ⋅。
(6)3Cu N 晶胞如图三中图2所示,+Cu 的半径为 pm a ,-3N 的半径为 pm b ,3Cu N 晶胞的密度为______-3g cm ⋅(列出计算式即可,阿伏加德罗常数的值用A N 表示)。
2.第23号元素钒在地壳中的含量并不少,我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在元素周期表中的位置为________。
(2)在过渡金属元素Fe 、Ti 、Mn 、Zn 、V 中,基态原子核外单电子数最多的是________。
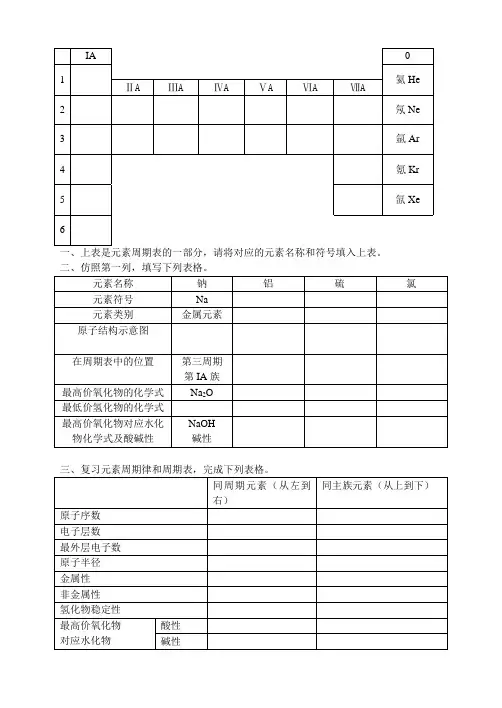
一、上表是元素周期表的一部分,请将对应的元素名称和符号填入上表。
二、仿照第一列,填写下列表格。
三、复习元素周期律和周期表,完成下列表格。
四、原子的组成(X AZ )电量关系: 质量关系:同位素:指 相同、 不同的原子。
五、原子和离子结构示意图1.当核外电子 核电荷数时,表示的是原子; 2.当核外电子 核电荷数时,表示的是阴离子; 3.当核外电子 核电荷数时,表示的是阳离子。
六、化学键类型[巩固练习]1、下列元素属于第二周期的是( ) A 、氢 B 、碳 C 、钠 D 、氯2、下列元素属于第IA 族的是( ) A 、氢 B 碳 C 、硫 D 、氯3、下列原子中,半径最小的是( )A )FB )NaC )S D)Cl 4、下列元素处于同一周期的是( ) A )C 、N 、F B )B 、S 、Cl C)LiNaK 5、下列元素属于同一主族的是( ) A 、H Na K B 、Na Mg Al C 、O S BrD 、C Si Cl6、下列第三周期元素中,化学性质最活泼的是( )A 、硅B 、磷C 、硫D 、氯 7、 下列物质的电子式,正确的是( )A )氯化钾KB OCC ND )氟化氢H+8、下列物质中只含有共价键的是( ) A )CaCl 2 B 、KCl C 、Cl 2 D 、KOH 9、.下列物质中,既含离子键,又含有共价键的化合物是 A.NaOH B.Na 2O C.CO 2 D.MgCl 210、对于第三周期从左到右的元素,下列说法中不正确的是( ) A )原子半径逐渐减小 B )金属性逐渐增强 C )最高正化合价逐渐增大 D )得电子能力逐渐增强 11、下列元素金属性最强的是( ) A 、Na B 、Mg C 、Al D 、K12、对于第VIIA 族从上到下的元素,下列说法正确的是( ) A )原子半径逐渐减小 B )非金属性逐渐增强 C )氢化物稳定性逐渐减弱 D )原子得电子能力逐渐增强13、考古学上常用14 6C 来测定文物的历史年代。

2021年高考化学专题复习:物质结构一、单选题(共15小题)1.泰雅紫是古代地中海沿岸出产的一种贵重染料,罗马帝王用法律规定,只有皇族与教主可穿用这种染料染的紫色衣袍.当时人们是从小的紫蜗牛中提取泰雅紫的,制备1.5g泰雅紫需要多达12000 只紫蜗牛,现知其结构为如下图所示的含澳有机化合物,下列说法不正确的是()A.泰雅紫分子的分子式为:C16H8N2Br2O2B. 1mol泰雅紫与H2加成最多需9molH2C.泰雅紫属于烃的衍生物D.检验泰雅紫中澳元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成2.最近,医学界通过用放射性14C标记C60的竣酸衍生物在特定的条件下可断裂DNA杀死细胞,从而可用于抑制艾滋病毒。
关于放射性14C的下列说法中,正确的是()A.与12C互为同位素B.是12C的同素异形体C.与14N所含中子数相同D.与C60中普通碳原子的化学性质不同3.为了探索月球上是否有生命存在的痕迹,就要分析月球岩石中是否包含有碳氢化合物。
科学家用氘盐酸(DCl)和重水(D2O)溶液处理月球岩石样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物。
这个实验不能用普通盐酸,其理由是()A.普通盐酸酸性太强B.普通盐酸有强挥发性C.普通盐酸与月球岩石中的碳化物无法反应D.无法区别月球岩石中原来含有的是碳化物,还是碳氢化合物4.已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D (A, B, C, D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是()A.分子C与D不能发生化学反应B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子C 固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键D.在25℃时,A的盐酸盐溶液的pH小于75.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20.下列判断正确的是()W X YA.四种元素的原子半径:r z>r X>r Y>r WB.四种元素形成的单质最多有6种C.四种元素均可与氢元素形成电子总数为18的分子D.四种元素中,Z的最高价氧化物对应的水化物酸性最强6.下列描述正确的是()A. 2004年我国首创用CO2合成可降解塑料聚二氧化碳,但该塑料仍然产生白色污染B.超临界流体是介于气态和液态之间的一种状态,故超临界流体CO2是合成的新物质C.澳大利亚开发出被称为第五形态的固体碳一“纳米泡沫”,其形似海绵,密度极小且有磁性。

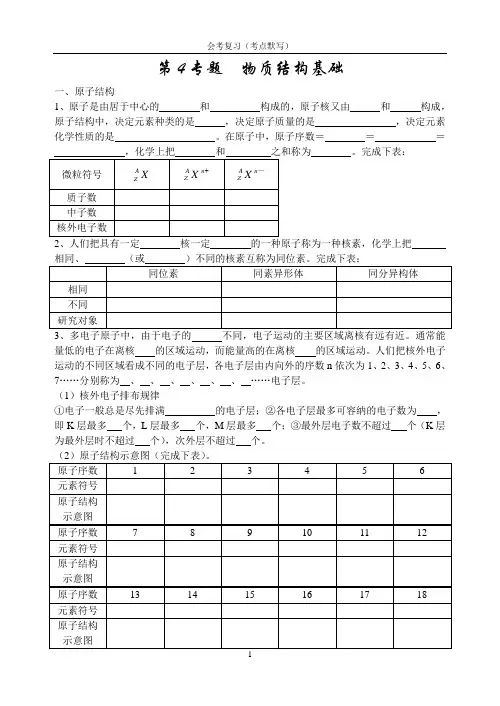
第4专题物质结构基础一、原子结构1、原子是由居于中心的和构成的,原子核又由和构成,原子结构中,决定元素种类的是,决定原子质量的是,决定元素化学性质的是。
在原子中,原子序数===之和称为。
完成下表:2、人们把具有一定核一定的一种原子称为一种核素,化学上把、多电子原子中,由于电子的不同,电子运动的主要区域离核有远有近。
通常能量低的电子在离核的区域运动,而能量高的在离核的区域运动。
人们把核外电子运动的不同区域看成不同的电子层,各电子层由内向外的序数n依次为1、2、3、4、5、6、7……分别称为、、、、、、……电子层。
(1)核外电子排布规律①电子一般总是尽先排满的电子层;②各电子层最多可容纳的电子数为,即K层最多个,L层最多个,M层最多个;③最外层电子数不超过个(K层为最外层时不超过个),次外层不超过个。
(2)原子结构示意图(完成下表)。
二、元素周期律和元素周期表1、元素的性质随原子序数的递增呈现变化的规律称为元素周期律。
①除H、He元素外,随原子序数的递增,元素原子最外层电子重复出现从递增到,呈现变化。
②除H、He元素外,随原子序数的递增,元素原子半径重复出现由到,呈现变化。
除稀有气体外,同周期从左往右原子半径逐渐,同主族从上往下原子半径逐渐。
③随着原子序数的递增,元素最高化合价重复从到,一个周期的中部开始出现负价,负价从依次递增到,呈现变化。
元素的最高正价等于,最高正价与最低负价的绝对值之和等于。
④随着原子序数的递增,元素的金属性重复出现由到,非金属性由到,呈现变化。
同周期从左往右金属逐渐,非金属性逐渐;同主族从上往下金属性逐渐,非金属性逐渐。
元素的金属性越强,它的单质越和水或酸反应置换出氢气,该元素的性越。
元素的非金属性越强,它的单质越和氢气化合,得到的气态越,该元素的性越。
(1)元素周期表的横行称为,元素周期表共有个周期,其中有个短周期(分别为周期),个长周期(分别为周期)及个不完全周期(即第周期)。


2011物质结构基础复习思考题物质结构基础复习题⼀、填空题1、Li 2分⼦按分⼦轨道理论表⽰的电⼦排布为222*121s s s σσσ,说明(答“有或⽆”)有 Li 2分⼦存在。
2、固溶体按溶质原⼦分布有⽆规律可分为有序固溶体和⽆序固溶体。
3、铺展是固、⽓界⾯变为液、⽓界⾯和固、液界⾯的过程。
4、根据分⼦轨道理论解释He 2分⼦不存在,是因为He 2分⼦的电⼦排布式为2*121s s σσ。
5、固体中的转变类型有四种,其中有序程度变化的是⾮晶态的晶化和结构驰豫,化学成分变化的是相分离,晶体结构变化的是同素异构转变。
6、共价键的特点是具有⽅向性和饱和性。
7、晶体中原⼦排列的紧密程度是反映晶体结构特征的⼀个重要因素。
为了定量地表⽰原⼦排列的紧密程度,通常应⽤配位数和致密度这两个参数。
8、反应扩散是指是随扩散原⼦增多超过基体固溶体溶解度极限⽽形成新相的扩散 .9、元素的电负性是指元素的原⼦在分⼦中吸引电⼦的能⼒,在周期表中,同⼀周期元素的电负性由左向右逐渐增⼤,⽽同⼀族元素的负电性由上到下逐渐减⼩。
⼆元合⾦中两组元的电负性差越⼤,越易形成形成的化合物,越不易形成(置换)固溶体。
10、⾦属典型的晶体结构类型有FCC 、BCC 和HCP ,其配位数相应为12、8、12;晶胞中原⼦数相应为4、2、6。
11低浓度⽅向进⾏,在此过程中扩散驱动⼒是化学位梯度(化学势梯度、化学⼒)。
12、刃型位错既可以作滑移运动,也可以作攀移运动,螺型位错只能作滑移运动,因为它没有多余的半原⼦⾯。
13、合⾦结晶过程中,形核时既需要结构(相起伏)起伏和能量起伏,⼜需要成分起伏。
14、⾦属结晶的过程是不断形核和长⼤的过程。
15、三元合⾦中两相平衡时,合⾦的成分点和两个平衡相的成分点,必须在同⼀直线上。
⼆、判断题(正确的打√,错误的打×)1、相变时新旧两相的化学势相等,化学势的⼀级偏微商也相等的相变称为⼀级相变。
×2、包晶转变是指由液相与⼀个固相相互作⽤,包覆原有固相形成的另⼀个新固相的转变。


高中化学基础知识复习(四)物质结构和元素周期律一、原子结构1、构成原子的微粒及属性质子(符号:,带电荷,相对质量约为)原子中子(符号:,带电荷,相对质量约为)核外电子(符号:,带电荷,相对质量约为)2、原子中各微粒的数量关系1)原子序数= = =2)质量数= +3、原子的核外电子排布1)原子的核外电子排布,电子总是从排起,当一层充满后再填充下一层,每一个电子层最多可容纳个电子。
最外层最多容纳个电子,次外层最多容纳个电子,倒数第三层最多容纳个电子。
电子层由内到外分别对应的符号是。
2)原子结构和离子结构示意图(写出下列原子或离子的结构示意图):N ,Na ,S ,Cl ,H-,F-,Al3+,S2-,K+。
在原子或分子中,核电荷数(质子数)核外电子数在阳离子a X m+中,核电荷数(质子数)核外电子数在阴离子a X n-中,核电荷数(质子数)核外电子数3) 前18号元素的原子结构的特殊性①原子核中无中子的原子:②最外层有一个电子的元素:③最外层有两个电子的元素:④最外层电子数等于次外层电子数的元素:⑤最外层电子数是次外层电子数2倍的元素:;是次外层电子数3倍的元素:;是次外层电子数4倍的元素:⑥电子层数与最外层电子数相等的元素:⑦电子总数为最外层电子数2倍的元素:⑧次外层电子数是最外层电子数2倍的元素:⑨内层电子数是最外层电子数2倍的元素:⑩原子半径最小的元素:,原子半径最大的元素:。
4、常见的等电子体写出核外有10电子微粒:1、分子2、阳离子3、阴离子写出核外有18电子微粒::1、分子2、阳离子3、阴离子5、元素、核素和同位素1)元素:具有的同一类原子的总称。
2)核素:具有的一种原子叫做核素。
3)同位素:概念:实例:;;“原子结构”练习题1、A+、B+、C-、D、E五种微粒(分子或离子),它们都分别含有10个电子,已知它们△有如下转化关系:①A++C-D+E↑②B++C-→2D(1)写出①的离子方程式;写出②的离子方程式。

2020年高考生物二轮复习热点专题训练-----细胞的物质与结构基础1.蛋白质在生物体内具有重要作用。
下列叙述正确的是()A.蛋白质化学结构的差异只是R基团的不同B.某些化学物质可使蛋白质的空间结构发生改变C.蛋白质控制和决定着细胞及整个生物体的遗传特性D.“检测生物组织中的蛋白质”需同时加入双缩脲试剂A和B【答案】B【解析】氨基酸化学结构的差异只是R基团的不同,A错误;某些化学物质,如蛋白酶可催化蛋白质水解,使蛋白质的空间结构发生改变,B正确;遗传物质DNA控制和决定着细胞及整个生物体的遗传特性,C错误;“检测生物组织中的蛋白质”,需先向组织样液中加入双缩脲试剂A液(0.1g/mL的NaOH溶液)1mL,摇匀后再加入双缩脲试剂B液(0.01g/mLCuSO4溶液)4滴并摇匀,D错误。
2.下列关于人体中蛋白质功能的叙述,错误的是A.浆细胞产生的抗体可结合相应的病毒抗原B.肌细胞中的某些蛋白质参与肌肉收缩的过程C.蛋白质结合Mg2+形成的血红蛋白参与O2运输D.细胞核中某些蛋白质是染色体的重要组成成分【答案】C【解析】抗原能和抗体特异性结合,病毒、细菌等病原体表面的蛋白质等物质,都可以作为引起免疫反应的抗原,可见,浆细胞产生的抗体可结合相应的病毒抗原,A正确;肌肉细胞中的某些蛋白质(如肌动蛋白等)参与肌肉收缩的过程,B正确;蛋白质结合Fe2+形成的血红蛋白参与O2的运输,C错误;染色体是细胞核的结构之一,染色体主要由DNA和蛋白质组成,D正确。
3.在真核细胞的内质网和细胞核中能够合成的物质分别是A.脂质、RNAB.氨基酸、蛋白质C.RNA、DNAD.DNA、蛋白质【答案】A【解析】内质网可以合成脂质,细胞核中可以发生转录合成RNA,A正确;蛋白质的合成场所是核糖体,B错误;内质网中不能合成RNA,细胞核中可以合成DNA和RNA,C错误;内质网中不能合成DNA,蛋白质的合成场所是核糖体,D错误。
4.(2019·全国卷Ⅱ)在真核细胞的内质网和细胞核中能够合成的物质分别是()A.脂质、RNA B.氨基酸、蛋白质C.RNA、DNA D.DNA、蛋白质答案 A解析真核细胞的内质网是细胞内蛋白质合成和加工,以及脂质合成的“车间”;细胞核中能够完成转录过程,可产生RNA,综合上述分析,A正确。
细胞的物质基础和结构基础一、选择题1.生物体的生命活动离不开水。
下列关于水的叙述,错误的是()A.在最基本生命系统中,H2O有自由水和结合水两种存在形式B.由许多葡萄糖分子合成糖原的过程中一定有H2O产生C.有氧呼吸时,生成物H2O中的氢来自线粒体中丙酮酸的分解D.H2O在光下分解,产生的[H]将固定的CO2还原成(CH2O)【答案】C【解析】A.细胞是最基本的生命系统,水在细胞中有自由水和结合水两种存在形式,A正确;B.葡萄糖是单糖,通过脱水缩合形成多糖—糖原的过程中一定有H2O产生,B正确;C.有氧呼吸时,生成物中H2O中的氢一部分来自有氧呼吸第一阶段葡萄糖的分解和有氧呼吸第二阶段线粒体中丙酮酸和水的分解,C错误;D.光合作用光反应中H2O在光下分解,产生的[H]用于暗反应中将固定的CO2(C3)还原成(CH2O),D正确。
故选C。
2.用高浓度的尿素溶液处理从细胞中分离纯化的蛋白质,可使其失去天然构象变为松散肽链;除去尿素后,蛋白质又可以恢复原来的空间结构,且蛋白质分子越小复性效果越好。
下列相关叙述正确的是()A.变性蛋白质不能与双缩脲试剂发生紫色反应B.蛋白质的空间结构的形成与氢键、二硫键等化学键有关C.胰岛素经高浓度尿素溶液处理后活性不变D.尿素与蛋白酶的作用效果相似【答案】B【解析】A.蛋白质变性后其空间结构改变,但其中的肽键没有断裂,变性蛋白质能与双缩脲试剂发生紫色反应,A错误;B.蛋白质的基本组成单位是氨基酸,氨基酸通过脱水缩合形成肽链,一条或几条肽链通过一定的化学键(如二硫键)形成具有一定空间结构的蛋白质。
蛋白质的空间结构的形成与氢键、二硫键等化学键有关,B正确;C.高浓度尿素溶液处理胰岛素后,可使其失去天然构象变为松散肽链,失去活性,C错误;D.尿素会使蛋白质失去天然构象变为松散肽链(称为“变性”),除去尿素后,蛋白质又可以恢复原来的空间结构(称为“复性”),但蛋白酶处理蛋白质,蛋白质变性后不能复性,D错误。
专题四-4晶体结构基础(教师版)专题四物质结构基础【备考指导】⾼中知识必备4.晶体的基本特征;晶体结构的堆积模型;晶胞的概念;原⼦晶体及其性质;分⼦晶体及其性质;⽯墨晶体;⾦属晶体及其性质;离⼦晶体及其性质;离⼦晶体的晶格能;⾮晶体、液晶等离⼦体等其他的物质聚集形态;【竞赛要求】课外知识拓展14.晶体⼊门①单纯考查某晶体的⽴体结构(主要考查⽴⽅晶胞)。
建⽴微观和宏观的桥梁是阿伏加德罗常数。
②考查原⼦簇化合物。
要弄清“化学环境”的含义。
凸多⾯体经常⽤到欧拉公式:点+⾯=棱+2。
③考查晶体缺陷的有关知识。
组成该晶体的粒⼦具有⾮整⽐数。
要搞清楚离⼦填充四⾯体、⼋⾯体或⽴⽅体空⽳等知识。
④简单的晶体结构,但解答时需要建⽴数学模型,⽅能快速作答。
例如根据数学知识对化学问题进⾏数学归纳,得出通式,再根据其通式解决化学问题。
【真题汇编】2.(09·华南理⼯)MgO的熔点⽐NaF的⾼,其原因是( )A.Mg和O之间的距离远⼤于Na和F之间的距离B.Mg和O的核电荷更少C.Mg和O之间的化学键更强D.Mg和O的范德华⼒更强解析 MgO的晶格能⽐NaF⾼,离⼦键就强。
答案 C。
3.(09·同济⼤学)下列物质按沸点降低顺序排列正确的是( )A.Cl4、CBr4、CCl4、CF4B.O2、S、Se、TeC.HF、HCl、HBr、HI D.F2、Cl2、Br2、I2解析⾼考基础题。
结构相似的分⼦,相对分⼦质量越⼤,熔沸点越⾼。
答案A。
5.(08·复旦⼤学)下列不属于同素异形体的⼀组物质是( )A.⽯墨、⾦刚⽯B.红磷、⽩磷C.氧⽓、臭氧D.青铜、黄铜解析青铜、黄铜是铜的两种合⾦,青铜是铜锡合⾦,黄铜是铜锌合⾦。
答案D。
12.某物质的晶体中含A、B、C三种元素,其排列⽅式如图所⽰,晶体中A、B、C的原⼦个数之⽐依次为( )A.2︰1︰1B.2︰3︰1C.2︰2︰1D.1︰3︰313.纳⽶材料的表⾯微粒数占微粒总数的⽐例极⼤,这是它有许多特殊性质的原因,假设某硼镁化合物的结构如图所⽰,则这种纳⽶颗粒的表⾯微粒数占总微粒数的百分数为( )A.22%B.70%C.66.7%D.33.3%14. 现有a A、bB、cC、dD、eE五种短周期元素,它们都是⽣命体不可缺少的重要元素已知它们的原⼦序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E 都有多种同素异形体。
第一章原子结构与性质.一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.例1.下列关于氢原子电子云图的说法正确的是A.通常用小黑点来表示电子的多少,黑点密度大,电子数目大B.黑点密度大,单位体积内电子出现的机会大C.通常用小黑点来表示电子绕核作高速圆周运动D.电子云图是对运动无规律性的描述例2.下列有关认识正确的是A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n -1D.各能层含有的电子数为2n22.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).掌握能级交错图和1-36号元素的核外电子排布式.①根据构造原理,基态原子核外电子的排布遵循图⑪箭头所示的顺序。
《期末复习物质结构与性质》全册要点复习【考点1】电子排布式的书写(1)1-35号元素氢H氦He锂Li铍Be硼B 碳C氮N氧O氟F氖Ne钠Na镁Mg铝Al硅Si磷P 硫S氯Cl氩Ar钾K钙Ca钪Sc钛Ti钒V铬Cr锰Mn 铁Fe钴Co镍Ni铜Cu锌Zn镓Ga锗Ge砷As硒Se溴Br(2)能级顺序1s2s2p3s3p4s3d4p(3例1.(2014·2011·江苏·21)(1)Cu+基态核外电子排布式为。
例2.(2012·江苏·21)(1)①Mn2+基态的电子排布式可表示为。
练1.写出下列微粒的电子排布式:K ,Fe ,Fe3+,Ni Cu 。
【考点2】元素第一电离能、电负性的大小比较(1)第一电离能I1:Na < Mg > Al < Si < P > S < Cl < ArH > Li > Na > K > Rb > CsF > Cl > Br > I(2)电负性:Na < Mg < Al < Si < P < S < ClH > Li > Na > K > Rb > CsF > Cl > Br > I例1.(2008·江苏·21)(1)C、N、O的第一电离能由小到大的顺序为。
【考点3】晶胞化学式、晶胞中某个微粒数、配位数的计算例1.(2013·江苏·21)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。
元素Y基态原子的3p 轨道上有4个电子。
元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为。
②该化合物的化学式为。
例1.(2013·江苏·21)例2.(2014·江苏·21)例3.(2009·江苏·21)例2.(2014·江苏·21)(5)Cu2O在稀硫酸中生成Cu和CuSO4。