曲克芦丁片微生物限度验证报告
- 格式:wps
- 大小:177.00 KB
- 文档页数:9

微生物限度检查检验方法验证报告
方案编制年月日方案审核年月日方案批准年月日
上海美宝生命科技有限公司
7
7.1试验样品
确认人:日期:
7.2 产品试验组微生物生长情况:批号:
检验人:日期:复核人:日期:7.3 供试品对照组微生物生长检查情况:批号:
检验人:日期:复核人:日期:
7.4 稀释剂对照组微生物生长检查情况:批号:
检验人:日期:复核人:日期:7.5 菌液组微生物生长检查情况:批号:
检验人:日期:复核人:日期:
7.6稀释剂对照组菌回收率计算
检验人:日期:复核人:日期:7.7 试验组菌回收率计算
检验人:日期:复核人:日期:
7.8 结果说明
经过验证,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的回收率分别为: %、 %、 %、 %、 %。
稀释剂回收率为: %、 %、 %、 %、 %。
7.9 结论
以上验证结果证明,本品(适合/不适合)采用上述方法进行微生物限度检查。
附录。

微生物限度检查法方法验证结果报告一、验证用样品:********片(批号:********)二、验证用菌种(1)枯草芽孢杆菌(Bacillus subtilis) [CMCC(B)63501](2)金黄色葡萄球菌(Staphylococcus aureus )[CMCC(B) 26003](3)大肠杆菌(Escherichia coli)[CMCC(F) 44102](4)白色念珠菌(Candida a lbicans )[CMCC(F )98001](5)黑曲霉菌(Aspergillus niger)[CMCC(F)98003]均为第3代,由山东省药品检验所提供三、方法中国药典2005年版二部附录XⅠ J。
四、培养基制备:(1)营养琼脂培养基批号********称取 32 g,加入 1000 ml蒸馏水(2)改良马丁琼脂培养基批号********称取 42 g,加入 1000 ml蒸馏水(3)MUG培养基批号********称取 23.37 g,加入 1000 ml蒸馏水(4)玫瑰红钠培养基批号********称取 31.5 g,加入 1000 ml蒸馏水(5)胆盐乳糖培养基批号********称取 38.5 g,加入 1000 ml蒸馏水五、菌数、霉菌数、酵母菌数计数方法学验证1、菌液制备:(1)取经30~35℃培养18~24小时,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌营养琼脂培养物,用0.9%无菌氯化钠溶液制成每ml含菌数为50~100cfu的菌悬液,做活菌计数备用。
(2)取经23~28℃培养24~48小时的白色念珠菌改良马丁琼脂培养物,用0.9%无菌氯化钠溶液制成每ml含菌数为50~100cfu的菌悬液,做活菌计数备用。
(3)取经23~28℃培养1周的黑曲霉菌斜面培养物,加3~5ml盐水洗下霉菌孢子,吸出孢子悬液,(用管口带有薄的无菌棉花能过滤菌丝的无菌毛细吸管)至无菌试管内,用0.9%无菌氯化钠溶液制成每ml含菌数为50~100cfu的菌悬液,做活菌计数备用。
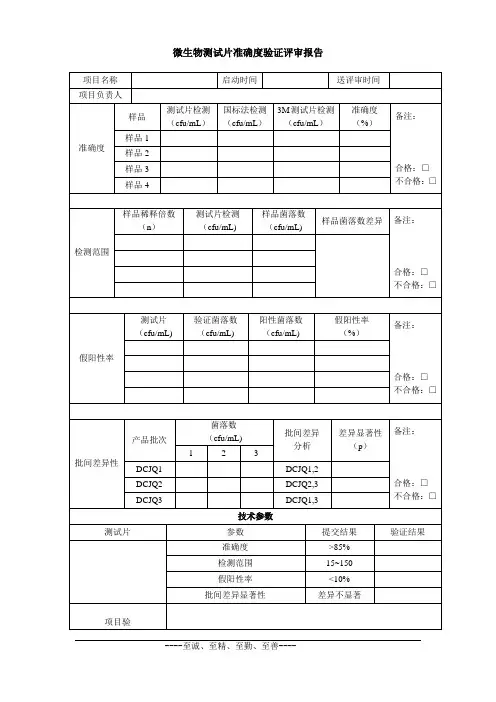

类别:验证文件编号:部门:验证中心曲克芦丁片微生物限度检查法验证方案起草人:年月日审核人:年月日批准日期:年月日xxxx制药有限公司实施日期:年月日目录一、目的二、依据三、范围四、验证小组成员及分工五、验证方式六、验证步骤一、目的:建立微生物限度检查法验证方案,以确认所采用的方法是否适合于曲克芦丁片的检查。
二、依据:国家药品监督管理局《药品生产质量管理规范》(2010年修订)、《中国药典》20xx年版二部药品质量分析方法验证指导原则。
三、范围:适用于本公司微生物限度检查法对曲克芦丁片的适用性。
四、验证小组成员及分工:五、验证方式:验证六、验证步骤:(一)细菌、霉菌与酵母菌计数方法的验证建立药品的微生物限度检查法,进行细菌、霉菌及酵母菌计数方法的验证,以确认所采用的方法适合于该药品的细菌、霉菌及酵母菌数的测定。
对各试验菌的回收率应注意进行验证。
1、验证用菌株大肠杆菌(Escherichia)[CMCC(B)44 102],金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B) 26 003〕,枯草芽孢杆菌(Bacillus subtilis)曲霉(Aspergillus niger) 〔CMCC(F)98 003〕。
2、菌液接种大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌新鲜培养物至营养肉汤培养基或营养琼脂培养基中,培养18~24小时;接种白色念珠菌的新鲜培养物至改良马丁培养基或改良马丁琼脂培养基中,培养24~48小时。
上述培养物用0.9%无菌氯化钠溶液制成每1ml含菌数为50~100cfu的菌悬液。
接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基中培养5~7天,加入3~5ml0.9%无菌氯化钠溶液,将孢子洗脱。
然后,吸出孢子悬液(用管口带有薄的无菌棉花或纱布能滤过菌丝的无菌毛细吸管)至无菌试管内,用0.9%无菌氯化钠溶液制成每1ml含孢子数50~100cfu的孢子悬液。
3、验证方法验证试验分四组,至少应进行在3次独立的平行试验,并分别计算供试品组和对照组试验的菌回收率。


药品补充申请—5、10 申报资料5-7变更药品规格(增加薄膜衣片)变更直接接触药品的包装材料或者容器(薄膜衣片增加铝塑泡罩包装)药物稳定性研究的试验资料及文献资料xxxx制药有限公司20xx年03月药物稳定性研究的试验资料及文献资料1、稳定性考察方法1.1、试验仪器高效液相色谱仪 XXX xxxx有限公司分析天平 xxx 上海天平仪器厂智能溶出试验仪 ZRS-8G 天津大学无线电厂紫外可见分光光度仪上海分析仪器厂1.2、药品供试样品:曲克芦丁片(铝塑泡罩式包装及固体药用塑料瓶包装)自制批号为:xx0510 xx0511 xx05122、稳定性试验方法2.1、加速试验将曲克芦丁片(xx0510 xx0511 xx0512)(铝塑泡罩式包装及固体药用塑料瓶包装),在温度40±2℃,相对湿度75%±5%的条件下放置6个月,分别于1个月、2个月、3个月、6个月末取样一次,按稳定性重点考察项目(性状、其他羟乙基衍生物、溶出度、崩解时限、含量)检测。
2.2、长期试验将曲克芦丁片(xx0510 xx0511 xx0512)(铝塑泡罩式包装、固体药用塑料瓶包装)在温度25±2℃,相对湿度60%±10%的条件下放置6个月。
每3个月取样一次,分别于0个月、3个月、6个月、9个月取样,按稳定性重点考察项目(性状、其他羟乙基衍生物、溶出度、崩解时限、含量)进行检测。
12个月以后,分别于18月、24月、36月取样进行检测。
将结果与0月比较以确定药品的有效期。
3、检验项目及结果3.1、加速试验20xx年05月16日到20xx年11月20日对曲克芦丁片(铝塑泡罩式包装及固体药用塑料瓶包装)进行了加速试验,对性状、其他羟乙基衍生物、溶出度、崩解时限、含量等项目进行了检测,试验结果见表1、表2、表3、表4-1、表4。
HPLC图谱见附件12、13、14、15。
3.2、长期试验从20xx年05月16日开始对曲克芦丁片进行了长期试验,对性状、其他羟乙基衍生物、溶出度、崩解时限、含量等项目进行了检测,试验结果见表5、表6、表7、HPLC图谱见附件16、17、18、19。

曲克芦丁注射液中细菌内毒素检查方法的研究罗婷;林玲【摘要】Objective:To establish a method for bacterial endotoxin test of Troxerutin Injection.Methods:According to the method for bacterial endotoxin test in Ch.P2010 (Appendix XI E),the study wasperformed.Results:The sample solution of Troxerutin injection at0.75mg/ml or lower concentration could eliminate the interference factors. Conclusion:The bacterial endotoxin test (gel - clot method) can be used as an alternative method for the rabbit pyrogen test to control pyrogen of products.%目的:对曲克芦丁注射液进行鲎试剂检查法研究,建立曲克芦丁注射液细菌内毒素检查法。
方法:按《中国药典》2010年版附录XI E进行实验,确立曲克芦丁注射液细菌内毒素检查法。
结果:曲克芦丁注射液样品在0.75mg/ml或更低浓度时与鲎试剂反应无干扰作用。
结论:可用细菌内毒素检查法(凝胶法)替代原家兔热原检查法控制产品热原。
【期刊名称】《北方药学》【年(卷),期】2015(000)001【总页数】2页(P7-8)【关键词】曲克芦丁注射液;细菌内毒素;干扰试验【作者】罗婷;林玲【作者单位】广东省广州市药品检验所广州 510160;广东省广州市药品检验所广州 510160【正文语种】中文【中图分类】R927.1曲克芦丁注射液主要成分是曲克芦丁,本品能抑制血小板的聚集,有防止血栓形成的作用。

曲克芦丁片溶出度测定方法的研究施洁明;林玲【期刊名称】《广东药学院学报》【年(卷),期】2012(28)3【摘要】Objective To investigate dissolution of troxerutin tablets from different enterprises and develop a method for determination of dissolution of troxerutin tablets. Methods According to the second dissolution method described in Pharmacopoeia of the Peoples Republic of China(2010 Edition,volume 2),to establish the dissolution condition by choosing the optimal dissolution medium,rotational speed and taking solution time. RP-HPLC was used . The sample was analyzed on a Kromasil C18 column using NaH2PO4 solution( pH 4.4) and acetonitrile( 80: 20) as mobile phase. The detection wavelength was 254 nm and flow rate was 0.5 ml/min. The methodology was examined for linear relationship, recovery and stability. Results The paddle method was used with 75 r/min rotational speed. 900 mL water was selected as release medium and rotational speed was 75 r/min,the solution was withdrawn after exactly 45 minutes. No less than 80% of the labelled amount was dissolved. Conclusion The method was suitable and feasible for the dissolution determination of troxerutin tablets,and might be used for evaluating and improving the quality of troxerutin tablets.%目的考察不同厂家曲克芦丁片的体外溶出度,建立曲克芦丁片的溶出度测定方法.方法依照《中国药典》2010年版二部溶出度测定第二法,通过对溶出介质、转速和取样时间的选择,确定曲克芦丁片的溶出度测定方法;采用反相高效液相色谱法测定曲克芦丁的含量,色谱柱为Kromasil-C18柱,流动相为NaH2P04溶液(pH4.4)-乙腈(体积比80:20),检测波长为254nm,流速为0.5mL/min,并对方法的线性相关性、回收率、稳定性进行了考察.结果溶出度测定方法确定为:采用桨法,以900mL水为溶出介质,转速为75r/min,取样时间为45min,限度不得低于标示量的80%.结论建立了适用可行的曲克芦丁片的溶出度测定方法,可用来评价和提高产品质量.【总页数】4页(P251-254)【作者】施洁明;林玲【作者单位】广州市药品检验所,广东广州510160;广州市药品检验所,广东广州510160【正文语种】中文【中图分类】R927【相关文献】1.心达康片溶出度测定方法研究及体外溶出度考察 [J], 王玮;李铜铃;庞其捷;许小红;李莉;孙健2.曲克芦丁片含量测定方法的研究 [J], 周春兰3.左炔诺孕酮片溶出度测定方法的建立及上市片溶出度的对比研究 [J], 李慧慧;余春梅;陈兰;陈仲祥4.复合维生素B片中维生素B2溶出度测定方法研究 [J], 叶爱琴5.阿莫西林胶囊溶出度测定方法研究 [J], 沈川;程义;曾令高;姜学美;沈丹丹因版权原因,仅展示原文概要,查看原文内容请购买。

药品补充申请—5、10 申报资料5-6
变更药品规格(增加薄膜衣片)
变更直接接触药品的包装材料或者容器(薄膜衣片增加铝塑泡罩包装)
原料药、辅料的来源
及质量标准、检验报告书
xxxx制药有限公司
20xx年03月
原料药、辅料的来源及质量标准、检验报告书
1、所用原料药、辅料明细表
2.1、xxxx制药有限责任公司《药品生产企业许可证》复印件
2.2、xxxx制药有限责任公司《药品GMP证书》复印件
2.3、xxxx制药有限责任公司《企业法人营业执照》复印件
2.4、曲克芦丁原料药国药准字批件复印件
2.5、曲克芦丁原料原料药购货发票及供需合同复印件
2.6、xxxx药用辅料有限公司《药品生产企业许可证》复印件
2.7、xxxx药用辅料有限公司《企业法人营业执照》复印件
2.8、xxxx药用辅料有限公司《药品生产企业许可证》复印件
2.9、xxxx药用辅料有限公司《企业法人营业执照》复印件
2.10、淀粉、预胶化淀粉、微晶纤维素、硬脂酸镁、胃溶型薄膜包衣粉、滑石
粉的批件复印件
3、原料药、辅料质量标准复印件:
3.1曲克芦丁原料药质量标准复印件
3.2 淀粉、预胶化淀粉、微晶纤维素、硬脂酸镁、胃溶型薄膜包衣粉、滑石粉
的质量标准复印件
4、原料药、辅料检验报告书复印件:
4.1 曲克芦丁原料药检验报告书复印件
4.2 淀粉、预胶化淀粉、微晶纤维素、硬脂酸镁、胃溶型薄膜包衣粉、滑石粉
的检验报告书复印件
1。
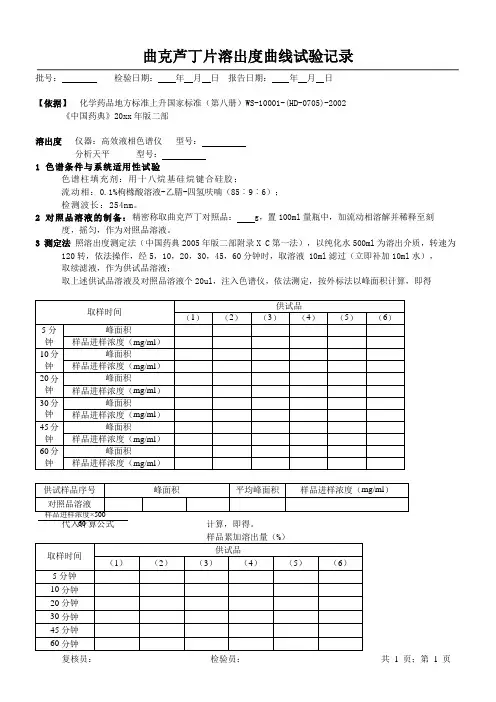
复核员: 检验员: 共 1 页;第 1 页批号: 检验日期: 年 月 日 报告日期: 年 月 日【依据】 化学药品地方标准上升国家标准(第八册)WS-10001-(HD-0705)-2002 《中国药典》20xx 年版二部溶出度 仪器:高效液相色谱仪 型号: 分析天平 型号: 1 色谱条件与系统适用性试验色谱柱填充剂:用十八烷基硅烷键合硅胶;流动相:0.1%枸橼酸溶液-乙腈-四氢呋喃(85︰9︰6); 检测波长:254nm 。
2 对照品溶液的制备:精密称取曲克芦丁对照品: g ,置100ml 量瓶中,加流动相溶解并稀释至刻 度,摇匀,作为对照品溶液。
3 测定法 照溶出度测定法(中国药典2005年版二部附录X C 第一法),以纯化水500ml 为溶出介质,转速为 120转,依法操作,经5,10,20,30,45,60分钟时,取溶液 10ml 滤过(立即补加10ml 水), 取续滤液,作为供试品溶液;取上述供试品溶液及对照品溶液个20ul ,注入色谱仪,依法测定,按外标法以峰面积计算,即得取样时间供试品(1) (2) (3) (4) (5) (6)5分钟 峰面积 样品进样浓度(mg/ml ) 10分钟 峰面积 样品进样浓度(mg/ml ) 20分钟 峰面积 样品进样浓度(mg/ml ) 30分钟 峰面积 样品进样浓度(mg/ml ) 45分钟 峰面积 样品进样浓度(mg/ml ) 60分钟 峰面积 样品进样浓度(mg/ml )供试样品序号 峰面积 平均峰面积 样品进样浓度(mg/ml ) 对照品溶液代入计算公式计算,即得。
样品累加溶出量(%) 取样时间 供试品(1)(2) (3) (4) (5) (6) 5分钟 10分钟 20分钟 30分钟 45分钟 60分钟样品进样浓度×50060复核员:检验员:共1 页;第2 页。

双波长分光光度法测定曲克芦丁片中曲克芦丁和微量芦丁的含量全红;白小红;杨雪【期刊名称】《山西医科大学学报》【年(卷),期】2005(36)5【摘要】目的紫外分光光度法同时测定曲克芦丁片中曲克芦丁和微量芦丁的含量.方法采用双波长分光光度法测定.结果该法测定曲克芦丁的工作曲线方程为△A=0.009 28 C-0.005 89,r=0.999 2(n=5),线性范围为0.00~43.04μg/ml,平均回收率为(94.6±1.5)%,日内RSD(相对标准偏差)为(0.14±0.05)%,日间RSD为(1.8±0.5)%;芦丁的工作曲线方程为△A=0.026 99 C-0.007 57,r=0.999 3(n=5),线性范围为0.00~42.48 μg/ml,平均回收率为(97.3±4.2)%,日内RSD为(0.13±0.05)%,日间RSD为(2.1±0.7)%.结论该法灵敏度高、重现性好、操作简便、易于普及.【总页数】3页(P592-594)【作者】全红;白小红;杨雪【作者单位】山西医科大学药学院药物分析教研室,太原,030001;山西医科大学药学院药物分析教研室,太原,030001;山西医科大学药学院药物分析教研室,太原,030001【正文语种】中文【中图分类】R927.2【相关文献】1.曲克芦丁对Belousov-Zhabotinskii振荡体系的扰动及其含量测定 [J], 叶丹妮;蔡卓;蒋翠文;岳伟超2.注射用曲克芦丁有效成分含量测定方法研究 [J], 金荣富;陈静;张晖;梁丽丽;贺文欣;宫文武;林溪铖;薛洪宝3.高效液相色谱法测定曲克芦丁氯化钠注射液中曲克芦丁的含量 [J], 岑志芳;林琼4.荷移-UV法测定曲克芦丁片中总黄酮含量 [J], 罗秀琴; 孙小祥5.注射用曲克芦丁发生临床ADR后动态浊度法测定细菌内毒素含量 [J], 于德志;方选;张琪;杨钊因版权原因,仅展示原文概要,查看原文内容请购买。
药品补充申请—5、10 申报资料5-3变更药品规格(增加薄膜衣片)变更直接接触药品的包装材料或者容器(薄膜衣片增加铝塑泡罩包装)质量研究工作的试验资料及文献资料试验单位:试验负责人:试验参加者:试验日期:资料保存处:联系人:电话:质量研究工作的试验资料及文献资料1、质量标准: 《化学药品地方标准上升国家标准》第八册(WS-10001-(HD-0705)-2002)及《化学药品地方标准上升国家标准》第三册(WS-10001-(HD-0226)-2002)2、试验仪器和药品2.1试验仪器高效液相色普仪 xxxxxx有限公司分析天平上海天平仪器厂微量分析天平上海精科科学仪器有限公司智能溶出试验仪 ZRS-8G 天津大学无线电厂紫外可见分光光度计上海分析仪器厂智能崩解时限检查仪 ZB-1C 天津大学精密仪器厂2.2药品供试药品: 曲克芦丁片自制批号为:xx0510 xx0511 xx0512对照药品:曲克芦丁片(糖衣片) xxxx制药有限公司生产批号:xx041513、处方:曲克芦丁 99.0g(含量按60.5%计算)淀粉 12.0g预胶化淀粉 20.0g微晶纤维素 6.0 g滑石粉 15.0g硬脂酸镁 3.0g制成 1000片4、工艺规程:4.1称取曲克芦丁原料药、淀粉、预胶化淀粉、微晶纤维素、滑石粉、硬脂酸镁分别过80目筛网。
4.2称取处方量曲克芦丁原料药、淀粉、预胶化淀粉、微晶纤维素混合15分钟后,再加入处方量的滑石粉、硬脂酸镁,混合15分钟使之均匀。
4.3混合均匀的药粉检验后,用直径为7.0mm的浅凹冲头压片。
4.4素片检验后,包薄膜衣。
4.5 分别进行包装。
5、质量研究:5.1【性状】按片剂的要求和三批小试实测数据进行描述:本品为薄膜衣片,除去包衣后显黄色。
见下表:5.3【重量差异】按质量标准进行实验,检测数据见下表:5.4【崩解时限】按质量标准进行实验,检测数据见下表:5.5 高效液相色谱法方法学研究5.5.1 仪器和试药高效液相色普仪 xxxxxx有限公司分析天平上海天平仪器厂5.5.2色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,以0.1%枸橼酸溶液-乙腈-四氢呋喃(85:9:6)为流动相;检测波长为254nm。
微生物限度检查法验证试验报告1、样品:奥氮平盐酸氟西汀胶囊(批号20140807,20140808,20140809),规格:12mg/25mg2、试液与稀释液:pH7.0无菌氯化钠-蛋白胨缓冲液(批号:)、0.9%无菌氯化钠(批号:)、1%红四氮唑(批号:)、含1%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液(批号:)。
3、主要的设备及器具:净化工作台(型号)、培养箱(型号)、电子天平(型号)、恒温摇床(型号)、生物安全柜(型号)、无菌培养皿、菌落计数器、接种环、、酒精棉球、酒精灯、刻度吸管(1ml,10ml)、锥形瓶、试管及试管塞、吸耳球、显微镜等。
4、验证试验用菌种:大肠埃希菌CMCC(B)44 102、枯草芽孢杆菌CMCC(B)63 501、金黄色葡萄球菌CMCC(B)26 003、白色念珠菌CMCC(F)98 001、黑曲菌CMCC(F)98 003,均由中国药品生物制品鉴定所提供。
5、对照培养基:4-甲基伞形酮葡萄苷酸(MUG)培养基(批号),胆盐乳糖发酵培养基(批号),胆盐乳糖培养基(批号);玫瑰红钠琼脂(批号);营养琼脂(批号),营养肉汤培养基(批号),均由中国食品药品检定研究院提供。
6、试验用培养基:营养琼脂培养基(批号);玫瑰红钠琼脂培养基(批号);营养肉汤培养基(批号);改良马丁培养基(批号),胆盐乳糖培养基(批号);4-甲基伞形酮葡萄苷酸(MUG)培养基(批号),由******公司提供(配制)。
7、试验方案按《中国药典》2010年版二部附录ⅪJ微生物限度检查法规定,本品微生物限度标准应为:1g供试品中,细菌数不得过1000cfu,霉菌和酵母菌数不得过100cfu,大肠埃希菌不得检出。
7.1 验证试验的目的对所采用的方法进行验证,确认该方法适用于本品的微生物限度检查,即确认本品在该检验量及检验条件下无抑菌活性或其抑菌活性已被充分消除至可忽略不计,以确保检验结果的准确、可靠及检验方法的完整性。
批号:检验日期:年月日报告日期:年月日【依据】化学药品地方标准上升国家标准(第八册)WS-10001-(HD-0705)-2002《中国药典》20xx年版二部【性状】本品为。
(规定:为糖衣片或薄膜衣片,除去包衣后显黄色、黄绿色或浅棕黄色。
)结论:【鉴别】取本品适量,除去包衣,研细,照一下实验方法试验:(1)取本品适量(约相当于曲克芦丁20mg),加水20ml、盐酸1ml和锌粉少量,置水浴上加热,。
(规定:应显持续的红色)结论:(2)取本品适量(约相当于曲克芦丁20mg),加水20ml和三氯化铝少量,溶液(规定:显亮黄色。
)结论:(3)取本品,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,滤过,精密量取5ml,置 50ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml中含曲克芦丁20ug);照紫外-可见分光光度法(中国药典20xx年版二部附录IV A)测定,波长(nm)252 253 254 255 256吸光度波长(nm)345 346 347 348 349吸光度波长(nm)281 282 283 284 285吸光度(规定:在254nm与347nm波长处有最大吸收,在283nm的波长处有最小吸收)结论:【检查】室温:相对湿度: %其他羟乙基芦丁衍生物仪器:高效液相色谱仪型号:分析天平型号:照高效液相色谱法(中国药典20xx年版二部附录V D)测定,色谱条件同含量测定项下方法。
供试品溶液的制备:精密称取本品(除去包衣)的细粉(约相当于曲克芦丁15mg),置25ml量瓶中,加流动相溶解并稀释至刻度,摇匀,滤过,取续滤液,作为供试品溶液;测定法取供试品溶液10ml,照含量测定项下的色谱条件,注入液相色谱仪,记录色谱图至主峰保留时间的2倍,按面积归一化法计算。
色谱图中总峰面积: mv.sec;色谱图中杂质峰面积和: mv.sec;色谱图中杂质峰面积和占色谱图中总峰面积百分比:;(规定:除主峰外,其他物质峰面积之和不得大于总峰面积的40%。
曲克芦丁片生产工艺验证方案1. 引言曲克芦丁片是一种常用的中药制剂,主要由曲克芦丁提取物作为原料制成。
为了确保曲克芦丁片的质量和稳定性,需要进行生产工艺的验证。
本文档旨在提出一种曲克芦丁片生产工艺验证方案,以确保生产过程符合规范和质量要求。
2. 目标本文档的目标是验证曲克芦丁片的生产工艺能够稳定、可行,并符合药品生产质量管理规范。
具体目标包括: - 验证曲克芦丁片的原料质量符合要求; - 验证曲克芦丁片的生产工艺能够稳定地产出符合质量要求的产品; - 确定关键控制点,建立相应的控制措施,以确保产品的一致性和质量稳定性。
3. 方案概述曲克芦丁片的生产过程包括原料采集、原料检验、提取工艺、干燥工艺、包装等环节。
本验证方案将对每个环节进行验证,以确保生产工艺的稳定性和产品质量的一致性。
3.1 原料采集和检验验证原料采集是曲克芦丁片生产的第一步,必须确保采集到的原料符合质量要求。
针对原料的外观、气味、含水量、杂质等指标进行检验和验证。
3.2 提取工艺验证提取工艺是曲克芦丁片生产的核心步骤,直接关系到产品质量。
在提取工艺验证过程中,需要验证提取工艺的参数设置是否合理,包括提取温度、提取时间、溶剂用量等。
3.3 干燥工艺验证干燥工艺是曲克芦丁片生产的重要环节,关系到产品的稳定性和质量。
通过验证不同干燥条件下产品的含水量、颜色、质地等指标,确定最佳的干燥工艺参数。
3.4 包装验证包装是曲克芦丁片保护和包装的最后一道工序,需要验证包装材料的适用性和包装工艺的可靠性,以确保产品在包装过程中不受到外界污染和损坏。
4. 验证方法和步骤本文档将根据每个环节的特点,制定相应的验证方法和步骤。
4.1 原料采集和检验验证方法•采用随机抽样的方法,在不同产地采集曲克芦丁原料;•对原料进行外观、气味、含水量、杂质等方面的检验;•与采购的标准进行对比分析,验证原料是否符合要求。
4.2 提取工艺验证方法•设计一系列的提取实验,包括不同的提取温度、提取时间、溶剂用量等参数的组合;•通过测定提取液中曲克芦丁的含量,确定最佳的提取工艺参数;•验证最佳提取工艺参数下的重复性和一致性。
类别:验证文件编号:V-TM-xxx
部门:验证中心
曲克芦丁片
微生物限度检查验证报告
起草人:年月日
审核人:年月日批准日期:年月日
xxxx制药有限公司
实施日期:年月日
目录
一、验证方案及参考资料目录
二、验证内容
三、验证评价
四、验证小结及结论
五、验证报告的审核
六、验证报告的批准
七、验证合格证书的发放
一、验证方案及参考资料目录
1、验证方案(见附件1)
2、参考资料目录《中国药典》20xx年版二部
二、验证内容
品名:曲克芦丁片
(一)细菌、霉菌与酵母菌计数方法的验证
1、验证用菌株大肠埃希菌(Escherichia)[CMCC(B)44 102],金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B) 26 003〕,枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B) 63 501〕,白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕,黑曲霉(Aspergillus niger) 〔CMCC(F)98 003〕。
2、菌液制备接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌新鲜培养物至营养肉汤培养基中,35℃培养24小时,接种白色念珠菌的新鲜培养物至改良马丁培养基中,27℃培养24小时。
取上述培养物用0.9%无菌氯化钠溶液制成每1ml含菌数为50~100cfu的菌悬液,做活菌计数用。
接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基,27℃培养5~7天,加入3~5ml0.9%无菌氯化钠溶液,将孢子洗脱。
然后,吸出孢子悬液(用管口带有薄的无菌棉花或纱布能滤过菌丝的无菌毛细吸管)至无菌试管内,用0.9%无菌氯化钠溶液制成每1ml 含孢子数50~100cfu的孢子悬液,做活菌计数用。
3、供试液的制备取供试品10g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1∶10的供试液。
用pH7.0无菌氯化钠-蛋白胨缓冲液稀释成1∶100的供试液。
4、验证方法验证试验分四组,至少应进行在3次独立的平行试验,并分别计算供试品组和对照组试验的菌回收率。
⑴试验组取1ml 1:10供试液和1ml 含菌数为50~100cfu菌悬液,分别注入2个平皿中,立即倾注营养琼脂培养基,待凝固后倒置培养。
细菌:35℃培养48小时;霉菌和酵母菌数:27℃培养72小时。
⑵菌液组取上述试验菌液各1ml,分别注入2个平皿中,立即倾注营养琼脂培养基,待凝固后倒置培养。
细菌:35℃培养48小时;霉菌和酵母菌数:27℃培养72小时。
⑶供试品对照组取1:10供试液1ml,分别注入2个平皿中,立即倾注营养琼脂培养基,待凝固后倒置培养。
细菌:35℃培养48小时;霉菌和酵母菌数:27℃培养72小时。
⑷稀释剂对照组为考察供试液制备过程中微生物受影响的程度,用相应的稀释液替代供试品,加入试验菌,使最终浓度为每1ml供试液含50~100cfu 试验菌,按试验组的供试液制备方法和菌落计数方法测定其菌数。
5、计算公式:
试验组平均菌落数-供试品对照组平均菌落数
试验组的菌回收率(%)=------------------------------------------×100%
菌液组平均菌落数
稀释剂对照组平均菌落数
稀释剂对照组的菌回收(%)=------------------------×100%
6、测定结果:
6.1细菌常规法回收率测定结果:
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
白色念珠菌
1
2 平均值
操作者:复核者:日期:年月日
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
珠菌 2
平均值
操作者:复核者:日期:年月日
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
白色念珠菌
1
2 平均值
操作者:复核者:日期:年月日6.2、霉菌和酵母菌常规法回收率测定结果:
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
珠菌 2
平均值
操作者:复核者:日期:年月日
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
白色念珠菌
1
2 平均值
操作者:复核者:日期:年月日
批号菌落计数回收率(%)
菌种名称平皿试验组菌液组
供试品对
照组
稀释液
对照组
稀释剂对
照组
试验组
大肠埃希菌
1
2 平均值
金黄色葡萄球菌
1
2 平均值
枯草芽孢杆菌
1
2 平均值
白色念1 2
操作者:复核者:日期:年月日
6、结果判断。
(二)大肠埃希菌的验证
1、菌种大肠埃希菌(Escherichia coli)[CMCC(B)44 102]
2、菌液制备接种大肠埃希菌的新鲜培养物至营养肉汤培养基35℃培养24小时。
用0.9%无菌氯化钠溶液制成每1ml含菌数为10~100cfude菌悬液。
3、供试液的制备取供试品10g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1∶10的供试液。
4、验证方法
(1)试验组取1:10供试液10ml及10~100cfu大肠埃希菌试验菌加入增菌培养基中,以大肠埃希菌检查法进行检查。
(2)阴性菌对照组取1:10供试液10ml及10~100cfu金黄色葡萄球菌加入100ml,方法同试验组。
5、测定结果
批号:BL MUG Indole 报告
试验组
阴性菌对照组
操作者:复核者:日期:年月日
批号:BL MUG Indole 报告
试验组
阴性菌对照组
操作者:复核者:日期:年月日
批号:BL MUG Indole 报告
试验组
阴性菌对照组
操作者:复核者:日期:年月日
6、结果判断。
三、验证评价:
6、结果判断。
四、验证小结与结论;。
五、验证报告的审核:
验证方法微生物限度
检查法
验证品种曲克芦丁片审核部门审核意见
审核日期审核人
六、验证报告批准:
验证方法微生物限度
检查法
验证品种
曲克芦丁片
意见
批准人批准日期
七、验证合格证书的发放:(见附件2)。