吸光度法测定花青素含量
- 格式:doc
- 大小:22.00 KB
- 文档页数:2

四种原花青素含量测定方法比较一、本文概述原花青素(Procyanidins)是一类广泛存在于植物中的多酚类化合物,因其强大的抗氧化和生物活性,近年来在营养学、食品科学、医药学等领域受到了广泛关注。
其中,四种主要的原花青素——儿茶素(Catechin)、表儿茶素(Epicatechin)、没食子儿茶素(Gallocatechin)和表没食子儿茶素(Epigallocatechin)的含量测定对于评估食品营养价值、研究药物作用机制以及监控产品质量具有重要意义。
本文旨在比较和分析目前常用的四种原花青素含量测定方法,包括高效液相色谱法(HPLC)、紫外可见分光光度法(UV-Vis)、荧光光谱法(Fluorometry)和质谱法(MS),以期为相关领域的研究和实践提供有益的参考。
通过比较这些方法的准确性、灵敏度、操作简便性以及成本效益等方面的优劣,我们期望能为科研人员和企业选择最适合的原花青素含量测定方法提供指导。
二、方法概述原花青素(Procyanidins)是一类广泛存在于植物中的多酚类化合物,具有强效的抗氧化性能,对多种疾病具有预防和治疗作用。
由于其生物活性的重要性,对原花青素含量的准确测定显得尤为重要。
目前,常用的原花青素含量测定方法主要包括高效液相色谱法(HPLC)、紫外可见分光光度法、薄层色谱法(TLC)和毛细管电泳法(CE)。
这些方法各有优缺点,适用于不同的样品类型和实验条件。
高效液相色谱法(HPLC)具有高分辨率、高灵敏度、高重现性等优点,可以同时分离和测定多种原花青素。
但是,该方法需要昂贵的仪器设备和专业的操作人员,且样品处理过程繁琐,分析时间较长。
紫外可见分光光度法是一种简便、快速的测定方法,适用于大量样品的初步筛选。
然而,该方法只能测定总原花青素的含量,无法区分不同种类的原花青素,且易受样品中其他色素的干扰。
薄层色谱法(TLC)是一种基于原花青素在薄层板上的分离和显色进行测定的方法。

花青素检测内容和方法花青素(Anthocyanins)是一类广泛存在于植物中的天然色素,具有丰富的抗氧化和抗炎特性。
以下是关于花青素检测的50条内容和方法:1. 花青素的检测可以通过分光光度法进行,该方法通过测量样品吸收特定波长的光来确定花青素的含量。
2. 除了分光光度法,高效液相色谱法(HPLC)也是一种常用的花青素检测方法,可以准确测量不同类型的花青素。
3. 在花青素检测中,常用的溶剂包括甲醇、乙腈和水,这些溶剂可以帮助提取样品中的花青素。
4. 还可以使用质谱法(MS)结合色谱法进行花青素的鉴定和定量分析,能够提高检测的精准度和准确性。
5. 花青素的含量可以通过比色法进行测定,该方法通过添加试剂产生有色产物来测量花青素的浓度。
6. 采用高性能液相色谱-质谱联用技术(HPLC-MS)可以对花青素进行定性和定量分析,具有高灵敏度和选择性。
7. 使用紫外-可见分光光度法(UV-Vis)可测定花青素的吸光度,从而推算花青素的浓度。
8. 考虑到植物样品中可能存在其他干扰物质,需要对样品进行预处理,如蛋白质去除和净化,以提高花青素的检测灵敏度和准确性。
9. 对于不同环境下的花青素含量变化调查,可以通过原子吸收光谱分析(AAS)确定植物中金属离子对花青素生成的影响。
10. 考虑到花青素的稳定性,检测前样品处理和存储条件至关重要,如低温保存、光照避免、氧气隔离等。
11. 比较两个或多个样品中花青素的含量,可以通过内标法(Internal standard method)进行定量,以减小实验误差。
12. 回收率试验可以通过添加已知浓度的花青素作为标准品,验证提取方法的效果和准确性。
13. 花青素的结构分析可以使用质谱联用色谱技术(LC-MS)进行,以确定不同花青素的分子结构和质量。
14. 对于不同类型的花青素,还可以使用凝胶层析法(Gel Filtration Chromatography)进行分离和检测。
15. 非离子表面活性剂(Non-ionic surfactants)可以在样品制备中用来改善花青素的提取率和稳定性。

花青素提取实验报告花青素提取实验报告植物中的花青素是一类具有丰富颜色的天然色素,广泛存在于花朵、果实、叶子等植物组织中。
花青素不仅为植物赋予了吸引力的色彩,还具有很多生物活性,如抗氧化、抗炎、抗癌等。
因此,对花青素的提取和研究具有重要意义。
本实验旨在探究不同溶剂对花青素提取效果的影响,并比较不同植物材料中花青素的含量差异。
实验选取了红花、紫苏和紫甘蓝三种常见的植物材料作为研究对象。
实验步骤如下:1. 材料准备:准备红花、紫苏和紫甘蓝三种植物材料,并将其分别洗净、切碎备用。
2. 提取溶剂选择:选取乙醇、醋酸乙酯和水三种常用溶剂作为提取试剂,分别标注为A、B和C。
3. 提取过程:将每种植物材料分别加入三个烧杯中,每个烧杯中加入适量的提取溶剂,浸泡一段时间后,用搅拌棒搅拌均匀。
4. 过滤:将提取液用滤纸过滤,去除固体颗粒。
5. 浓缩:将过滤后的提取液分别倒入烧杯中,放在加热板上进行浓缩,直至溶剂蒸发完全。
6. 称量:将浓缩后的花青素溶液称量并记录。
7. 分光光度计测定:将每个烧杯中的花青素溶液分别转移到试管中,使用分光光度计测定吸光度。
8. 计算花青素含量:根据吸光度值,利用标准曲线计算出花青素的含量。
实验结果如下:在本实验中,我们选取了红花、紫苏和紫甘蓝三种植物材料进行花青素提取实验。
通过比较不同溶剂对花青素提取效果的影响,我们发现乙醇溶剂(A)对三种植物材料中花青素的提取效果最好。
在红花提取实验中,乙醇溶剂(A)的吸光度值最高,表明乙醇溶剂对红花中花青素的提取效果最佳。
紫苏和紫甘蓝的提取实验结果也是如此。
这可能是因为乙醇具有较好的溶解性,能够更好地溶解植物组织中的花青素。
此外,我们还发现不同植物材料中花青素的含量存在差异。
红花中花青素含量最高,紫苏次之,紫甘蓝最低。
这可能与不同植物材料的生长环境、基因差异等因素有关。
通过本实验,我们深入了解了花青素的提取过程以及不同溶剂对提取效果的影响。
同时,我们也发现了不同植物材料中花青素含量的差异。

花青素检测内容和方法花青素检测是一项重要的化学分析技术,用于测定植物和食品中的花青素含量。
花青素是一类常见的天然色素,具有抗氧化和抗炎作用,因此对其含量进行快速和准确的测定具有重要的科学和应用意义。
以下为50条关于花青素检测内容和方法的详细描述:1. 花青素是一类具有紫、蓝、红等颜色的天然色素,主要存在于植物的花朵、果实和叶子中。
2. 花青素的主要类型包括花色素苷、原花青素和异花青素等,它们在植物中起着色素和抗氧化作用。
3. 花青素检测的方法包括分光光度法、高效液相色谱法、质谱法等,常用的是分光光度法和高效液相色谱法。
4. 分光光度法是利用物质吸收特定波长的光线进行测定,通过比色法或比浊法来测定花青素的含量。
5. 高效液相色谱法是利用高效液相色谱仪进行测定,通过分离和检测样品中的花青素成分来计算含量。
6. 质谱法是利用质谱仪进行测定,通过记录花青素分子的质荷比来确定其含量。
7. 花青素检测常用的标准曲线方法是通过不同浓度的标准品制备标准曲线,再根据待测样品吸光度的测定值来计算含量。
8. 花青素的提取方法包括有机溶剂提取、酸碱水提取、超声波提取等,不同样品可选择合适的提取方法。
9. 有机溶剂提取是利用乙醇、丙酮等有机溶剂将花青素从植物组织中提取出来,然后通过浓缩和干燥得到提取物。
10. 酸碱水提取是利用酸性或碱性水溶液将花青素从植物组织中提取出来,可以有效保留花青素的天然结构。
11. 超声波提取是利用超声波功率促使样品中的花青素溶解在有机溶剂或水中,提高了提取效率。
12. 花青素的测定结果可根据测定方法的不同而有所差异,因此需要在同一实验条件下进行多次重复测定来确保结果的准确性。
13. 在花青素检测过程中,可能会受到样品中其他化合物的干扰,因此需要进行干扰检查和修正。
14. 花青素检测结果可以用于评价植物的品质、食品的营养价值和天然色素的应用价值。
15. 花青素检测在食品工业中具有重要的应用,如在果汁、酒类、饮料等产品中进行质量控制。

花青素检测方法(花色素苷)
A1 花青素的测定方法
A1.1 方法来源:企业内控方法
A1.2 方法原理:
A1.3 试剂:
A1.3.1 甲醇(AR)
A1.3.2 盐酸(AR)
A1.3.3 2%盐酸甲醇:盐酸:甲醇=2:100(V/V)A1.4 仪器和用具:
A1.4.1 电子天平(1/100000)
A1.4.2 玻璃仪器:容量瓶
A1.4.3 超声波清洗器
A1.4.4 紫外分光光度计
A1.4.5 比色皿(1cm)
A1.5 步骤
精密称取样品20mg,加60ml 2%盐酸甲醇超声溶解,取出冷却,定容至100ml,摇匀,过滤,待测。
A1.6 测定
用1cm 玻璃比色皿在540nm 波长下测定其吸光度A,用2%盐酸甲醇溶液作空白对照。
(吸光度应控制在0.3~0.7之间,否则应调整试样液浓度,再重新测定吸光度。
)
A1.7 计算
A × V
X = × 100%
1020 × W × 100
其中: X:花青素含量,%;
A:样品在波长为540nm处的吸光度值;
V:样品稀释体积,mL;
W:样品的称样量,g;
1020:飞燕草素的比吸光值。

香草醛法测定原花青素的含量说明:原花青素的抗氧化性受到聚合物的影响,以乙酸为溶剂,香草只与原花青素中的末端的黄烷-3-醇发生缩合生成红色产物,由红色产物吸光度测定原花青素含量。
通过正交实验和单因素实验考查了硫酸香草醛法测定原花青素含量的合适条件,比色条件为硫酸浓度30%,香草醛浓度1%,反应T为30℃,反应时间为30分钟。
以儿茶素为标准品绘制标准曲线测定原花青素含量。
一、器材/试剂紫外分光光度计恒温水浴锅电子天平儿茶素标准品(浓度>=98%);香草醛 ( 分析纯) ;硫酸 ( 分析纯) ;冰乙酸 ( 分析纯) ;实验用水为二级反渗透去离子水。
二、实验步骤1.配制试剂( 1 )配制儿茶素标准品溶液:称取一定量的儿茶素标准品,分别用去离子水定容至一定体积,配制成物质的量浓度为0.025~0.25 mm o l · mL 的儿茶素标准品溶液;( 2 )配制香草醛乙酸溶液:称取一定量的香草醛,分别用乙酸定容至一定体积,配制成浓度为1 %;( 3 )配制硫酸乙酸溶液:量取一定体积的浓硫酸,分别用乙酸定容至一定体积,配制成浓度为3 0 %的硫酸乙酸溶液。
(4)样品溶液:原花青素溶液以火棘果为原料,按液固比 6:1加入 4 0 %乙醇溶液,4 5 ℃下浸提 1.5 h,问歇搅拌,连提3次,过滤,滤液旋蒸,回收溶剂。
浓缩液经过预处理好的AB一8树脂吸附,用去离子水洗涤、6 0%乙醇溶液洗脱,收集洗脱液,6 0%乙醇洗脱液即为样品溶液。
2、扫描最大吸收波长取0.5mL儿茶素标准品溶液,加入2.5mL30%的硫酸乙酸溶液,2.5mL 1%的香草醛乙酸溶液,混合均匀,30℃水浴中避光反应15min。
以无水乙酸做参比,在可见光区(400~800nm)进行光谱扫描。
确定最大吸收波长,以后在此波长下测定样品的含量。
3、绘制标准曲线(在最大波长吸收处测得吸光度)浓度0.025 0.035 0.045 0.055 0.065 0.075 0.085 0.095A(儿茶素)0.105 0.115 0.125 0.135 0.145 0.155 0.165 0.175A(儿茶素)0.185 0.195 0.205 0.215 0.225 0.235 0.245A(儿茶素)测原花青素样品的吸光度,通过以上标准曲线所得的标准曲线回归线方程计算得样品浓度。

花青素含量计算公式
花青素的含量可以通过多个公式来计算,这里为您提供两种公式:
方法一:
花青素的得率为R,花青素的质量为m(g),最终体积为V(ml),光程为
L(cm),消光系数为ε(L·cm·g-1),稀释因子为DF,矢车菊花素-3-葡萄糖苷的分子量为MW(g/mol)。
花青素的质量分数w为:w = m / V × 100%
花青素的含量C(mg/100g)可以表示为:C = (A MW DF V) 100 / (ε L Wt),其中A是吸光度,Wt是称样量(g)。
方法二:
花青素含量(mg/100 g 鲜质量)=ΔD×DV×VF×M/(ε×m)×100 000。
式中:ΔD 表示;DV 表示稀释体积,为 20 mL;VF 表示稀释倍数,为 10;m 表示样品质量,为 2 g;100 000 表示单位换算;D 表示总吸光度;ε 表示消光系数,取 26 900 L/(mol·cm);M 为花青素分子质量,取 g/mol。
花青素含量的最终结果以干质量表示:含量(mg/kg 干质量)=含量
(mg/100 g 鲜质量)/ 紫甘薯出干率(%)×10。
请注意,上述公式仅供参考,使用时需根据具体实验条件和要求进行相应的调整。
同时,为了获得更准确的结果,建议进行多次测量并取平均值。

花青素检测内容和方法花青素是一类具有强烈吸收红外光的化合物,广泛存在于植物中。
它们赋予了许多植物花朵、水果和蔬菜明亮的颜色。
花青素不仅可以提供视觉上的吸引力,还具有抗氧化和抗炎症等生物活性。
因此,检测花青素的含量和质量对食品、药物和其他相关领域的研究非常重要。
花青素含量的检测方法有许多种,下面将介绍一些常用的方法:1. 分光光度法:分光光度法是一种常见且简便的检测花青素含量的方法。
它基于花青素对特定波长的光有很强的吸收能力。
通过将样品溶解在适合的溶剂中,使用紫外-可见光谱仪测量吸光度,然后根据不同波长下的吸光度值来计算花青素的含量。
这种方法可以测量花青素的总含量。
2. 高效液相色谱法:高效液相色谱法(HPLC)是一种准确测定花青素含量的常用方法。
它基于为花青素分离和检测提供了高分辨能力的高效液相色谱仪。
首先,样品中的花青素会被分离出来,然后通过波长选择性检测器进行定量分析。
这种方法可以同时测量多种不同类型的花青素,并且具有高灵敏度和高选择性。
3. 液相色谱质谱联用法:液相色谱质谱联用法(LC-MS)是一种更为精确的花青素检测方法。
它将高效液相色谱与质谱技术结合起来,可以通过质谱仪的高分辨率和灵敏度来确定花青素的结构和含量。
这种方法对于复杂的样品和低浓度的花青素分析非常有用。
4. 薄层色谱法:薄层色谱法是一种简单快速的花青素分析方法。
它基于花青素在薄层色谱板上迁移的性质,并通过与特定试剂反应形成具有色素的斑点来检测花青素。
该方法不需要复杂的仪器设备,适用于初步评估样品的花青素含量。
5. 酶联免疫吸附测定法:酶联免疫吸附测定法(ELISA)是一种基于抗体-抗原反应的花青素检测方法。
通过使用特异性的抗体来检测花青素,可以实现高灵敏度和高选择性的分析。
这种方法对于复杂样品和低浓度花青素的检测非常有效。
总之,准确测定花青素含量对于食品、药物和化妆品等行业至关重要。
上述介绍的不同方法可以根据实际需要选择合适的进行花青素的检测。

保健食品检验与评价技术规范》2003 版中“保健食品中原花青素的测定《保健食品检验与评价技术规范》2003 版中“保健食品中原花青素的测定原花青素含量测定方法1、原理原花青素是含有儿茶素和表儿茶素单元的聚合物。
原花青素本身无色,但经过用热酸处理后,可以生成深红色的花青素离子。
本方法用分光光度法测定原花青素在水解过程中生成的花青素离子。
计算试样中原花青素含量。
2 、试剂2.1 甲醇分析纯2.2 正丁醇分析纯2.3 盐酸分析纯2.4硫酸铁铵NH4Fe(SO4)2?12H2溶液:用浓度2mmol/l盐酸配成2%(w/v)的溶液。
2.5 原花青素标准品葡萄籽提取物,纯度95%3、仪器3.1 分光光度计3.2 回流装置4、分析步骤4.1 试样的制备4.1.1 片剂取20 片试样,研磨成粉状。
4.1.2 胶囊挤出20粒胶囊内容物,研磨或搅拌均匀,如内容物含油,应将内容物尽可能挤出。
4.1.3 口服液摇匀后取样4.2 提取4.2.1 粉状试样称取50-100mg 试样置于50ml 容量瓶中,加入30ml 甲醇,超声处理20min,放冷至室温后,加甲醇至刻度,摇匀,离心或放置至澄清后取上清液备用。
422含油试样称取50mg试样置于小烧杯中,用20ml甲醇分数次搅拌,将原花青素洗入50ml 容量瓶中,直至甲醇提取液无色,加甲醇至刻度,摇匀。
5.2.3 口服液吸取适量试样(取样量不超过1ml)置于50ml容量瓶中,加甲醇至刻度,摇匀。
4.3 测定4.3.1标准曲线称取原花青素标准品10.0mg溶于10ml甲醇中,吸取该溶液0、0.1、0.25、0.5、1.0、1.5ml置于10ml容量瓶中,加甲醇至刻度,摇匀。
各取1ml 测定。
与试样测定方法相同。
4.3.2 试样测定将正丁醇与盐酸按95:5 的体积比混合后,取出6ml 置于具塞锥瓶中,再加入0.2ml硫酸铁铵溶液和1ml试样溶液,混匀,置沸水浴回流,精确加热40min后,立即置冰水中冷却,在加热完毕15min后,于546nm波长处测吸光度,由标准曲线计算试样中原花青素的含量。
葡萄籽提取物中原花青素含量的最佳测定方法葡萄籽提取物-原花青素被誉为“最强效的自由基清除剂”,其抗氧化能力是VC的20倍,VE的50倍。
也是唯一能透过血脑屏障的抗氧化剂,因此在促进皮肤新陈代谢,分解黑色素,以及提高机体免疫力,延缓衰老方面的应用极为广泛。
葡萄籽提取物由原花青素、儿茶素、表儿茶素、没食子酸等多酚类物质组成的,由于原花青素的成分极其复杂,目前的研究实验中还无法提供原花青素的标准品,因此Bate-Smith 和Porter法只能测定葡萄籽提取物中原花青素的相对含量。
一、Bate-Smith法、Porter法测定葡萄籽原花青素含量西安源森生物实验室对Bate-Smith法和Porter法测定原花青素相对含量实验进行了研究:(一)Bate-Smith法测定葡萄籽原花青素含量【实验目的】由于目前没有原花青素的标准品,因此此方法测定的只是葡萄籽提取物中原花青素的相对值,其含量用原花青素指数(procyanidolic index)来表示。
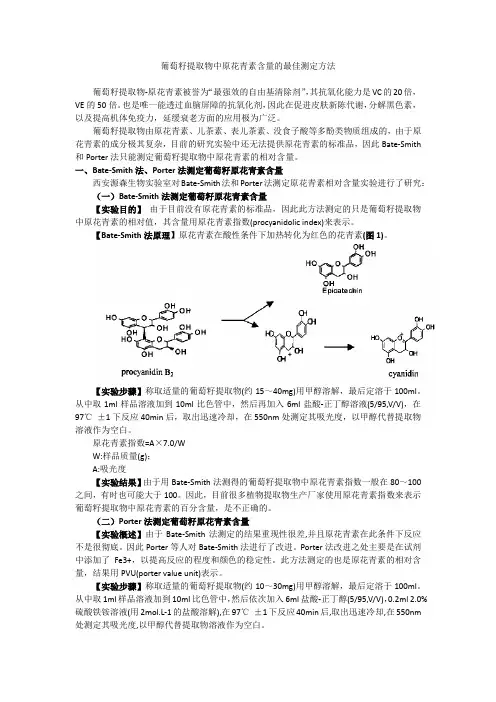
【Bate-Smith法原理】原花青素在酸性条件下加热转化为红色的花青素(图1)。
【实验步骤】称取适量的葡萄籽提取物(约15~40mg)用甲醇溶解,最后定溶于100ml。
从中取1ml样品溶液加到10ml比色管中,然后再加入6ml盐酸-正丁醇溶液(5/95,V/V),在97℃±1下反应40min后,取出迅速冷却,在550nm处测定其吸光度,以甲醇代替提取物溶液作为空白。
原花青素指数=A×7.0/WW:样品质量(g);A:吸光度【实验结果】由于用Bate-Smith法测得的葡萄籽提取物中原花青素指数一般在80~100之间,有时也可能大于100。
因此,目前很多植物提取物生产厂家使用原花青素指数来表示葡萄籽提取物中原花青素的百分含量,是不正确的。
(二)Porter法测定葡萄籽原花青素含量【实验概述】由于Bate-Smith法测定的结果重现性很差,并且原花青素在此条件下反应不是很彻底。

市售蓝莓类产品的原花青素含量测定陈安平;黄勇军;汪胜峰【摘要】采用紫外分光光度法对市场上蓝莓类产品中原花青素含量进行测定,在546 nm处测定吸光度,试验表明原花青素在10μg/mL~150μg/mL之间呈现良好的线性关系,认为以蓝莓为主要成分产品非常有必要标示原花青素含量,原花青素可以作为蓝莓类产品的质量控制指标。
%To determine the content of (Proanthocyanidins) in blueberry products on the market by ultraviolet spectroscopy, absorbencies of samples were detected at 546 nm, the result indicated that there was a good linear relationship between the absorbency and the content of PC in the range of 10 μg/mL-150 μg/mL.It's suggested to label the content of PC and use it as a key indicator for blueberry products.【期刊名称】《食品研究与开发》【年(卷),期】2016(000)001【总页数】4页(P170-173)【关键词】蓝莓;原花青素;紫外分光光度法【作者】陈安平;黄勇军;汪胜峰【作者单位】浙江尖峰健康科技有限公司,浙江金华321000;浙江尖峰健康科技有限公司,浙江金华321000;浙江尖峰健康科技有限公司,浙江金华321000【正文语种】中文原花青素(Proanthocyanidins,简称PC)是植物王国中广泛存在的一大类多酚类化合物的总称。
这类化合物由不同数目的黄烷醇聚合而成,在无机酸存在和加热处理下能产生红色的花青素。
花青素的测定方法1:原花色素的测定方法(分光光度法)本方法适用于各种植物组织、器官及其制剂(如葡萄子与松树皮提取物)中原花色素含量的测定。
1. 方法提要原花色素(也称缩合单宁)是黄烷-3-醇的寡聚体与多聚体,属多酚类化合物。
与其他酚类化合物不同,黄烷醇(缩合单宁,单体,双体等)在酸性介质中可与香草醛反应,生成在500nm处有最大吸收的有色物质,可通过比色测其含量。
2. 仪器分光光度计。
3. 试剂所用水为去离子水或同等纯度蒸馏水。
(1)香草醛、甲醇、浓盐酸均为分析纯级。
(2)提纯的原花色素或儿茶素。
(3)4%香草醛甲醇液。
(4)标准使用液:将提纯的原花色素溶于蒸馏水,制成1mg/mL 储备液,将储备液稀至浓度为1×10-2mg/mL至1mg/mL的标准使用液。
标准使用液应于测定当天配制。
如无提纯的原花色素,可用儿茶素代替,配制方法同上。
4. 测定步骤(1)样品中原花色素的制备:植物材料经4倍体积丙酮+水(7+3,体积比)或者经60%甲醇提取,40℃以下减压蒸馏去除有机溶剂,水相再经乙醚洗涤后定容。
冰冻干燥的固体原花色素制剂,直接溶于水中(先加少量甲醇助溶)制成原花色素液。
原花色素液于5℃下暗环境中保存备用。
(2)样品测定:用锡箔将试管(14mm×20mm)包裹严,仅留管口用于加样。
向管内加入试样0.5mL,再加3.0mL 4%香草醛甲醇液混合,然后加入1.5mL浓盐酸,彻底混匀,室温下显色15min。
也可在暗环境下进行以上操作。
最后在500nm处比色。
可按以上操作步骤制得标准曲线(即0.1mg原花色素在500nm 处的吸收值为0.55)。
5. 结果计算计算原花色素量的公式,原花色素(1×10-3mg)=A500nm÷0.55×100×V式中V——试样稀释体积(倍数)。
6. 注释(1)本方法的检测范围为(5~500)×10-3mg/0.5mL样液。
香草醛法测定原花青素的含量说明:原花青素的抗氧化性受到聚合物的影响,以乙酸为溶剂,香草只与原花青素中的末端的黄烷-3-醇发生缩合生成红色产物,由红色产物吸光度测定原花青素含量。
通过正交实验和单因素实验考查了硫酸香草醛法测定原花青素含量的合适条件,比色条件为硫酸浓度30%,香草醛浓度1%,反应T为30℃,反应时间为30分钟。
以儿茶素为标准品绘制标准曲线测定原花青素含量。
一、器材/试剂紫外分光光度计恒温水浴锅电子天平儿茶素标准品(浓度>=98%);香草醛 ( 分析纯) ;硫酸 ( 分析纯) ;冰乙酸 ( 分析纯) ;实验用水为二级反渗透去离子水。
二、实验步骤1.配制试剂( 1 )配制儿茶素标准品溶液:称取一定量的儿茶素标准品,分别用去离子水定容至一定体积,配制成物质的量浓度为0.025~0.25 mm o l · mL 的儿茶素标准品溶液;( 2 )配制香草醛乙酸溶液:称取一定量的香草醛,分别用乙酸定容至一定体积,配制成浓度为1 %;( 3 )配制硫酸乙酸溶液:量取一定体积的浓硫酸,分别用乙酸定容至一定体积,配制成浓度为3 0 %的硫酸乙酸溶液。
(4)样品溶液:原花青素溶液以火棘果为原料,按液固比 6:1加入 4 0 %乙醇溶液,4 5 ℃下浸提 1.5 h,问歇搅拌,连提3次,过滤,滤液旋蒸,回收溶剂。
浓缩液经过预处理好的AB一8树脂吸附,用去离子水洗涤、6 0%乙醇溶液洗脱,收集洗脱液,6 0%乙醇洗脱液即为样品溶液。
2、扫描最大吸收波长取0.5mL儿茶素标准品溶液,加入2.5mL30%的硫酸乙酸溶液,2.5mL 1%的香草醛乙酸溶液,混合均匀,30℃水浴中避光反应15min。
以无水乙酸做参比,在可见光区(400~800nm)进行光谱扫描。
确定最大吸收波长,以后在此波长下测定样品的含量。
3、绘制标准曲线(在最大波长吸收处测得吸光度)浓度0.025 0.035 0.045 0.055 0.065 0.075 0.085 0.095A(儿茶素)0.105 0.115 0.125 0.135 0.145 0.155 0.165 0.175A(儿茶素)0.185 0.195 0.205 0.215 0.225 0.235 0.245A(儿茶素)测原花青素样品的吸光度,通过以上标准曲线所得的标准曲线回归线方程计算得样品浓度。
花青素的提取、测定仪器材料试剂:仪器:旋转蒸发仪,真空泵,分光光度计,真空干燥箱,水浴锅,天平材料:新鲜的紫葡萄和青葡萄试剂:无水乙醇,盐酸,铁氰化钾,三氯乙酸,硫酸亚铁实验步骤一、花青素的提取:1、挑选新鲜的紫葡萄薄洗净晾干,分离出果肉、果皮、籽粒2、将分离晾干的紫色葡萄果皮,80℃下干燥1h。
3、称取2g磨成粉末4、用含有1%盐酸的乙醇溶液浸提2次,合并提取液5、讲合并提取液进行抽滤6、60℃减压浓缩7、真空干燥8、得粗提取液二、提取条件的优化:--完整版学习资料分享----确定最佳提取方案然后对果皮、果肉、籽粒进行提取,测定最佳提取部位。
三、纯化纸层析法提纯1.取准备好的滤纸条(2×20cm),将其一端剪去两侧,中间留一长约1.5cm,宽约0.5cm的窄条,并在滤纸剪口上方折叠出一条直线,作为画滤液细线的基准线。
2.用毛细吸管沾少许滤液在折线上描绘4~5次,注意要画得匀、直、细,每次画完细线要等其自然变干后再画第二根线。
3.在大试管中加入常用的展开剂有V(丁醇)∶V(乙酸)∶V(水)=4∶1∶5,V(正丁醇)∶V(2mol/LHCl)=1∶1,V(乙酸)∶V(浓HCl)∶V(水)=15∶3∶82,1%盐酸,V(浓HCl)∶V(水)=3∶97等(即层析液)。
然后将滤纸条固定于软木塞上,插入试管内,使窄端浸入溶剂中(色素点要略高于液面,滤纸条边缘不可碰到试管壁),盖紧软木塞,直立于阴暗处进行层析。
4.展开后剪下色斑,以酸化甲(乙)醇洗涤、浓缩,即可得到样品。
四、花青素的测定1.采用普鲁士蓝法测定花青素的还原能力。
取一定浓度的样品溶液1 mL,加入磷酸盐缓冲液和1%K3Fe(CN)6各2.5 mL,混合均匀,混合液50 ℃保温20 min,快速冷却,加入10 %的三氯乙酸溶液2.5 mL,离心10 min。
取上清液2.5 mL,加入等量蒸馏水和0.1%的FeCl3 1mL,摇匀,10min后700nm下测定吸光值A700,以抗坏血酸为对照。
吸光度法测定花青素含量
一、试验器材
1 材料与试剂
花青素标样;体积分数95%的乙醇;盐酸、甲醇、正丁醇、硫酸铁铵,均为分析纯。
2 仪器与设备
超声波细胞粉碎机、微波炉、低速大容量多管离心机、UV—1200 型紫外可见分光度计、pHS—3C型酸度计、RE—52型旋转蒸发仪、电子恒温水浴锅。
二.
1、标准曲线的绘制
准确配制质量浓度为0.50 mg/mL的花青素标准溶液,分别吸取0,0.1,0.2,0.3,0.4,0.5mL置于6支10mL 具塞比色管中,各加入甲醇溶液至1.0mL,然后加入6.0mL正丁醇—盐酸溶液(体积比为95∶5)和0.2mL 质量分数为2%的硫酸铁铵溶液(临用时配制),摇匀后,置沸水浴中加热40 min,然后迅速冷却,在波长400~600 nm处进行扫描,确定其最大吸收波长530nm,于最大吸收波长处测定花青素标准溶液吸光度,得到标准曲线方程。
将待测溶液在最大吸收波长下的吸光度值(平行6次)。
再通过标准曲线得出其浓度。
西安隆泽生物工程有限责任公司花青素含量测定方法(行标)编号:起草人/日期:审核人/日期:批准人/日期:版本号:编写依据:CP2005USP29EP5修订号:颁布日期:实施日期:操作程序注意事项一、仪器与试剂紫外一可见光分光光度计。
甲醇(AR)36%浓盐酸(AR)2%盐酸-甲醇溶液:36%HCl(浓盐酸)5ml加85ml甲醇。
对照样品(花青素含量25%)二、样品溶液制备准确称取样品约20mg(W1),置50mL容量瓶中,加入约40mL2%盐酸-甲醇溶液,在超声水浴中(20℃左右)振荡溶解20min,放置10min至室温后,用2%盐酸-甲醇溶液定容,再吸取5mL用2%盐酸-甲醇溶液稀释至100mL过滤,取过滤液作为供试样品溶液,准备测定。
三、对照样品溶液制备准确称取对照样品约20mg(W2),其他处理同样品溶液制备.四、测定用1㎝比色皿,以2%盐酸-甲醇溶液做空白,在540nm处测定供试样品溶液的吸光度(A1)、对照样品溶液的吸光度(A2)。
计算公式如下(以飞燕草素计):A1×W2含量(%)=x KA2×W1西安隆泽生物工程有限责任公司式中:A1——样品吸光度W1——样品称样量(g)A2——对照样品吸光度W2——对照样品称样量(g)K——对照样品纯度注意:样品溶液吸光度应保持在0.3~0.7之间。
否则,调整样品稀释倍数。
五、误差范围以绝对偏差判定。
绝对偏差=测量值—平均值1、同一时间平行样测定结果绝对偏差为±0.2%。
2、不同时间、不同人员平行样测定结果绝对偏差为±0.2%。
西安隆泽生物工程有限责任公司。
吸光度法测定花青素含量
一、试验器材
1 材料与试剂
花青素标样;体积分数95%的乙醇;盐酸、甲醇、正丁醇、硫酸铁铵,均为分析纯。
2 仪器与设备
超声波细胞粉碎机、微波炉、低速大容量多管离心机、UV—1200 型紫外可见分光度计、pHS—3C型酸度计、RE—52型旋转蒸发仪、电子恒温水浴锅。
二.
1、标准曲线的绘制
准确配制质量浓度为0.50 mg/mL的花青素标准溶液,分别吸取0,0.1,0.2,0.3,0.4,0.5mL置于6支10mL具塞比色管中,各加入甲醇溶液至1.0mL,然后加入6.0mL正丁醇—盐酸溶液(体积比为95∶5)和0.2mL质量分数为2%的硫酸铁铵溶液(临用时配制),摇匀后,置沸水浴中加热40 min,然后迅速冷却,在波长400~600 nm处进行扫描,确定其最大吸收波长530nm,于最大吸收波长处测定花青素标准溶液吸光度,得到标准曲线方程。
将待测溶液在最大吸收波长下的吸光度值(平行6次)。
再通过标准曲线得出其浓度。