高中化学第二章化学键与分子间作用力2.2共价键与分子的空间构型第4课时分子的空间构型与分子性质学案
- 格式:doc
- 大小:147.00 KB
- 文档页数:7


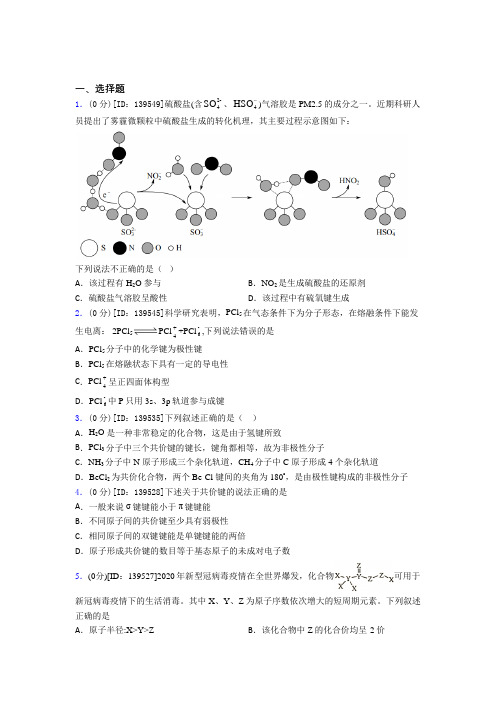
一、选择题1.(0分)[ID :139549]硫酸盐(含2-4SO 、4HSO)气溶胶是 PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( )A .该过程有 H 2O 参与B .NO 2是生成硫酸盐的还原剂C .硫酸盐气溶胶呈酸性D .该过程中有硫氧键生成 2.(0分)[ID :139545]科学研究表明,PCl 5在气态条件下为分子形态,在熔融条件下能发生电离: 2PCl 5PCl +4+PCl -6,下列说法错误的是 A .PCl 5分子中的化学键为极性键B .PCl 5在熔融状态下具有一定的导电性C .PCl +4呈正四面体构型 D .PCl -6中P 只用3s 、3p 轨道参与成键3.(0分)[ID :139535]下列叙述正确的是( )A .H 2O 是一种非常稳定的化合物,这是由于氢键所致B .PCl 3分子中三个共价键的键长,键角都相等,故为非极性分子C .NH 3分子中 N 原子形成三个杂化轨道,CH 4分子中 C 原子形成 4 个杂化轨道D .BeCl 2为共价化合物,两个 Be-Cl 键间的夹角为180°,是由极性键构成的非极性分子4.(0分)[ID :139528]下述关于共价键的说法正确的是A .一般来说σ键键能小于π键键能B .不同原子间的共价键至少具有弱极性C .相同原子间的双键键能是单键键能的两倍D .原子形成共价键的数目等于基态原子的未成对电子数5.(0分)[ID :139527]2020年新型冠病毒疫情在全世界爆发,化合物可用于新冠病毒疫情下的生活消毒。
其中X 、Y 、Z 为原子序数依次增大的短周期元素。
下列叙述正确的是A .原子半径:X>Y>ZB .该化合物中Z 的化合价均呈-2价C.元素的非金属性:X>Z D.Z的简单阴离子比Na的简单阳离子半径大6.(0分)[ID:139577]短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。


一、选择题1.(0分)[ID:139552]下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()A.H2+CuO=Cu+H2O B.2Na2O2+2H2O=4NaOH+O2↑C.H2+Cl2=2HCl D.2NaOH+Cl2=NaCl+NaClO+H2O2.(0分)[ID:139531]下列说法正确的是()A.非极性键只能存在单质中,不可能存在化合物中B.阴、阳离子间通过静电引力所形成的化学键是离子键C.冰中H2O分子间存在氢键,H2O分子内存在极性共价键D.HBr比HCl的热稳定性差,说明HBr的分子间作用力比HCl弱3.(0分)[ID:139526]吡啶是含有一个氮原子的六元杂环化合物,结构简式如下图,可以看作苯分子中的一个(CH)被取代的化合物,故又称为氮苯。
下列有关吡啶的说法正确的是A.吡啶分子中含有Π的大π键B.吡啶分子为非极性分子C.吡啶的分子式为C5H6ND.吡啶分子中含有10个σ键4.(0分)[ID:139599]下列说法中正确的是A.随着核电荷数的递增同主族元素的单质熔点不断升高B.草酸二甲酯分子中σ键和π键个数比为6:1C.DNA的双螺旋结构与氢键无关D.原子的价电子排布为(n-1)d6~8ns2的元素一定位于元素周期表d区5.(0分)[ID:139595]下列叙述中正确的是A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸B.无机含氧酸分子中含有几个羟基,它就属于几元酸C.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸D.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强6.(0分)[ID:139588]M、X、Y、Z、W是原子序数依次增大的短周期元素,Z的最外层电子数是次外层电子数的3倍,M和Y二者原子核外电子数之和等于W的原子核外电子数。
由五种元素组成的化合物结构如图所示(箭头表示共同电子对由W提供)。

一、选择题1.硫酸盐(含2-4SO 、4HSO -)气溶胶是 PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( )A .该过程有 H 2O 参与B .NO 2是生成硫酸盐的还原剂C .硫酸盐气溶胶呈酸性D .该过程中有硫氧键生成 答案:B【详解】A .根据图示中各微粒的构造可知,该过程有H 2O 参与,选项A 正确;B .根据图示的转化过程,NO 2转化为HNO 2,N 元素的化合价由+4价变为+3价,化合价降低,得电子被还原,做氧化剂,则NO 2的是生成硫酸盐的氧化剂,选项B 不正确;C .硫酸盐(含SO 24-、HSO 4-)气溶胶中含有HSO 4-,转化过程有水参与,则HSO 4-在水中可电离生成H +和SO 24-,则硫酸盐气溶胶呈酸性,选项C 正确;D .根据图示转化过程中,由SO 23-转化为HSO 4-,根据图示对照,有硫氧键生成,选项D 正确;答案选B 。
2.最近《科学》杂志评出“十大科技突破”,其中“火星上‘找’到水的影子”名列第一。
下列关于水的说法中正确的是( )A .水的离子积不仅只适用于纯水,升高温度一定使水的离子积增大B .水的电离和电解都需要电,常温下都是非自发过程C .水中氢键的存在既增强了水分子的稳定性,也增大了水的沸点D .加入电解质一定会破坏水的电离平衡,其中酸和碱通常都会抑制水的电离 答案:A【详解】A .水的离子积不仅只适用于纯水,也适应于水溶液,因为水的电离是吸热的,所以升高温度,水电离平衡正向移动,一定使水的离子积增大,故正确;B .水的电离不需要电,常温下是自发过程,故错误;C.水中氢键存在于分子之间,不影响水分子的稳定性,氢键增大了水的沸点,故错误;D.加入电解质不一定会破坏水的电离平衡,如强酸强碱盐不会影响水的电离平衡,故错误。
故选A。
3.下列描述中正确的是A.CS2为V形的极性分子B.PH3的空间构型为平面三角形C.SF6中有4对完全相同的成键电子对SO的中心原子均为sp3杂化D.SiF4和2-4答案:D【详解】A.根据价电子对互斥理论,中心碳原子只有两对价电子对,CS2为直线形的非极性分子(与CO2的结构相似),A项错误;B.根据杂化轨道理论:VSEPR模型、中心原子杂化和分子几何形状的关系判断,PH3的空间构型为三角锥形,B项错误;C.SF6分子中S原子的价电子全部用来成键,与F形成6对共用电子对,C项错误;D.SiF4的中心原子形成了4个σ键,SO的中心原子的价层电子对数是4,所以中心原子均为sp3杂化,D项正确;故答案为D。
第2课时价电子对互斥理论等电子原理课标解读重点难点1.了解杂化轨道的三种类型(sp3、sp2、sp)。
2.初步认识分子的空间构型。
3.能运用杂化轨道理论和价层电子对互斥模型判断分子的空间构型。
4.结合实例说明“等电子原理”的应用。
1.判断分子中心原子的杂化轨道类型。
(重点)2.用价层电子对互斥理论及杂化轨道理论推断分子的空间构型。
(难点)课前自主导学一、杂化轨道理论与分子空间构型1.sp3杂化与CH4分子的空间构型(1)杂化轨道的形成碳原子2s轨道上的1个电子进入2p空轨道, 2s轨道和 2p轨道“混合”,形成的4个sp3杂化轨道。
图示为:(2)sp3杂化轨道的空间指向碳原子的4个sp3杂化轨道指向,每个轨道上都有一个未成对电子。
(3)共价键的形成碳原子的4个轨道分别与4个H原子的轨道重叠形成4个相同的σ键。
(4)CH4分子的空间构型CH4分子为空间结构,分子中C—H键之间的夹角都是。
2.sp2杂化与BF3分子的空间构型(1)sp2杂化轨道的形成硼原子2s轨道上的1个电子进入2p轨道。
1个2s轨道和 2p轨道发生杂化,形成能量相等、成分相同的 sp2杂化轨道。
图示为:(2)sp2杂化轨道的空间指向硼原子的3个sp2杂化轨道指向,3个sp2杂化轨道间的夹角为。
(3)共价键的形成硼原子的3个轨道分别与3个氟原子的1个2p轨道重叠,形成3个相同的σ键。
(4)BF3分子的空间构型BF3分子的空间构型为,键角为。
3.sp杂化与BeCl2分子的空间构型(1)杂化轨道的形成Be原子2s轨道上的1个电子进入2p轨道,1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的个sp杂化轨道。
图示为:(2)sp杂化轨道的空间指向两个sp杂化轨道呈,其夹角为。
(3)共价键的形成Be原子的2个sp杂化轨道分别与2个Cl原子的1个轨道重叠形成相同的σ键。
思考交流:1.任意不同的原子轨道都可以杂化吗?二、价层电子对互斥模型1.理论分子中的价电子对(包括电子对和孤电子对)由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取的空间构型。
第3课时分子的空间构型与分子性质
课程学习目标
1.了解极性分子、非极性分子、手性分子等概念。
2.能举例说明等电子原理的含义及应用。
3.认识分子的空间构型与分子极性的关系,能运用有关理论预测分子的极性。
知识记忆与理解
知识体系梳理
一、等电子原理
1.定义: 相同相等的或具有相同的和等特征,这就是等电子原理的基本观点。
2.等电子原理的应用
利用等电子原理可以判断一些简单分子或离子的立体构型。
①S、P等离子具有AX
4的通式,价电子总数为32,中心原子采取杂化,空间构型呈四面体形。
②S、P等离子具有AX 3的通式,价电子总数为26,中心原子采取杂化,空间构型呈三角锥形。
二、分子的对称性
1.依据的旋转或借助对称面的反映能够复原的分子称为对称分子。
2.手性碳原子
当连接在碳原子上时,这个碳原子是不对称碳原子,称为手性碳原子。
3.含有手性碳原子的分子是手性分子。
三、分子的极性
1.极性分子和非极性分子
极性分子:分子内存在的分子称为。
非极性分子:分子内没有的分子
2.分子极性的判断方法
①双原子分子的极性取决于键的极性
以极性键结合的双原子分子是分子,如HCl、CO、NO等;以非极性键结合的双原子分子是分子,如H2、O2、N2等。
同种原子形成的双原子分子都是分子。
②多原子分子的极性取决于分子的空间构型
含有极性键的多原子分子,空间结构对称的是分子,空间结构不对称的是分子。
3.分子的极性对物质性质的影响
分子的极性对物质的熔点、沸点、溶解性等物理性质有显著的影响,一般情况下,由极性分子构成的物质易溶于溶剂,由非极性分子构成的物质易溶于溶剂,这在化学上称为“相似相溶规则”。
基础学习交流
1.水是极性溶剂,苯是非极性溶剂。
试判断构成下列物质的分子是不是极性分子,并比较这些物质在水和苯中的溶解性大小。
溴单质氨气甲烷氟化氢
2.请指出下表中分子的空间构型,判断其中哪些属于极性分子,哪些属于非极性分子,并与同学交流讨论你的判断方法。
分子的空间构型与分子的极性
预习检测
1.下列叙述中正确的是( )。
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性键只存在于双原子单质分子中
D.非极性分子中一定含有非极性共价键
2.下列分子属于非极性分子的是( )。
A.HCl
B.CO
C.N2
D.NH3
3.将几种分子晶体在水和四氯化碳中的溶解情况填入下表(填“易溶”或“不易溶”):
在两种溶剂中溶解情况存在差异的原因是
思维探究与创新
重点难点探究
探究:分子极性的判断
互动探究
下列叙述正确的是( )。
A.NH3是极性分子,分子中N原子处在由3个H原子所组成的三角形的中心
l4是非极性分子,分子中C原子处在由4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在由2个H原子所连成的线段的中点
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的线段的中点
探究拓展
下列分子中,属于非极性分子的是。
①SO2②BeCl2③BF3④SO3⑤NH3
名师点拨
分子极性的判断方法
判断AB n型分子是否有极性,关键是看分子的空间构型。
1.根据所含键的类型及分子的空间构型判断
只含有非极性键的分子一般是非极性分子,例如P4、C60(O3除外)等。
如果含有极性键的分子的空间构型为直线形、正四面体形、三角双锥形、正八面体形等对称结构,则为非极性分子;如果含有极性键的分子的空间构型为V形、三角锥形、四面体(非正四面体)形等非对称结构,则为极性分子。
2.判断AB n型分子极性的经验规律
若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。
如:BF3、CO2、CH4、SO3等分子中,B、C、S等元素的化合价的绝对值等于其主族序数,则BF3、CO2、CH4、SO3等分子为非极性分子;H2O、NH3、SO2、PCI3等分子是极性分子。
技能应用与拓展
当堂检测
1.下列分子属于极性分子的是( )。
A.NH3
B.CO2
C.Cl2
D.CH4
2.下列各组分子中都属于含极性键的非极性分子的是( )。
A.CO2、H2S
B.C2H4、CH4
C.Cl2、C2H2
D.NH3、HCl
3.二氯苯的同分异构体有非极性分子和极性分子两种,其中属于非极性分子的结构简式是;属于极性分子的结构简式是。
总结评价与反思
思维导图构建
学习体验分享
参考答案
知识记忆与理解
知识体系梳理
一、1.化学通式且价电子总数分子离子立体构型化学键类型
2.①sp3 ②sp3
二、1.对称轴
2.四个不同的原子或基团
三、1.正、负两极极性分子正、负两极
2.①极性非极性非极性②非极性极性
3.极性非极性
基础学习交流
1.【答案】溴单质、甲烷、苯是非极性分子,氨气、氟化氢和水是极性分子。
根据“相似相溶规则”,溴单质、甲烷易溶于苯,不易溶于水;氨气、氟化氢不易溶于苯,但易溶于水。
2. 【答案】
分子的空间构型与分子的极性
预习检测
1. 【解析】对于抽象的选择题可用反例法以具体的物质判断正误。
如O2、H2、N2等A项正确;以极性键结合起来的分子不一定是极性分子,若分子空间结构对称,正、负电荷中心重合,就是非极性分子,如CH4、CO2、CCl4、CS2等,B项错误;非极性键也存在于某些多原子共价化合物中,如H2O2、C2H4、C2H5OH等和某些离子化合物中,如Na2O2,C项错误;非极性分子中不一
定含有非极性共价键,如CH4、CO2,D项错误。
【答案】A
2.【答案】C
3. 【答案】
根据“相似相溶规则”,极性溶质易溶于极性溶剂,水、蔗糖、磷酸是极性分子;非极性溶质易溶于非极性溶剂,碘、萘、四氯化碳是非极性分子
思维探究与创新
重点难点探究
互动探究
【解析】本题主要考查常见物质的结构和空间构型。
NH3是空间构型为三角锥形的极性分子,A 项错误;CCl4是以C原子为中心的正四面体形分子,B项错误;CO2是C原子在2个O原子中点的直线形分子,D项错误;而水分子是O原子在两个H原子中间的“V”形分子,即,故C项正确。
【答案】C
探究拓展
【答案】②③④
技能应用与拓展
当堂检测
1.【解析】CO2、CH4的正、负电荷中心重合,Cl2只有非极性键,都是非极性分子。
【答案】A
2. 【解析】此题考查键的极性和分子的极性。
A项中CO2结构为,H2S结构为,所以都含极性键,但H2S是极性分子;B项中C2H4结构为,CH4为正四面体结构,都
含极性键,且都属于非极性分子;C项中Cl2不含极性键,D项中NH3、HCl为极性分子,都不符合题意。
【答案】B
3.【解析】苯是平面正六边形结构,二氯苯的同分异构体属于非极性分子的结构应是对称结构,即;属于极性分子的结构是不对称结构,即和。
【答案】;和。