第二章 原子结构与性质
- 格式:ppt
- 大小:12.91 MB
- 文档页数:96


原子结构与性质一、原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f 等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。
这种电子云轮廓图称为原子轨道。
s、p、d、f能级的原子轨道数分别为1、3、5、7,同一能层的相同能级的不同原子轨道方向不一样,但能量相等。
2.基态原子的核外电子排布(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
(2)泡利原理每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
洪特规则特例高考题型归纳(1)----电子排布原子结构示意图、电子排布式、电子排布图(轨道式)全部的、价电子的限定条件的:如多少种运动状态不同的电子、多少种能量不同的电子、最高能层的、最高能级的、有多少成对电子、多少不成对电子、某能级的电子云形状(球形、哑铃纺锤)等等注意:熟悉前四周期各种元素的原子、离子的电子排布,特别注意铬、铁、铜原子和离子。
(离子是在原子电子排布式的基础上从右往左失去电子)例题:1.按要求完成以下试题(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
答案D C(2)基态Fe原子价层电子的电子排布图(轨道表达式)为___________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案哑铃(纺锤)(3) Zn原子核外电子排布式为________________________________。

1. 简要说明原子轨道量子数及它们的取值范围?解:原子轨道有主量子数n ,角量子数l ,磁量子数m 与自旋量子数s ,对类氢原子(单电子原子)来说,原子轨道能级只与主量子数n 相关R n Z E n22-=。
对多电子原子,能级除了与n 相关,还要考虑电子间相互作用。
角量子数l 决定轨道角动量大小,磁量子数m 表示角动量在磁场方向(z 方向)分量的大小,自旋量子数s 则表示轨道自旋角动量大小。
n 取值为1、2、3……;l =0、1、2、……、n -1;m =0、±1、±2、……±l ;s 取值只有21±。
2. 在直角坐标系下,Li 2+ 的Schrödinger 方程为________________ 。
解:由于Li 2+属于单电子原子,在采取“B -O” 近似假定后,体系的动能只包括电子的动能,则体系的动能算符:2228ˆ∇-=mh T π;体系的势能算符:r e r Ze V 0202434ˆπεπε-=-= 故Li 2+ 的Schrödinger 方程为:ψψE r εe mh =⎥⎦⎤⎢⎣⎡π-∇π-20222438 式中:z y x ∂∂+∂∂+∂∂=∇2222222,r = ( x 2+ y 2+ z 2)1/23. 对氢原子,131321122101-++=ψψψψc c c ,其中 131211210,,-ψψψψ和都是归一化的。
那么波函数所描述状态的(1)能量平均值为多少?(2)角动量出现在 π22h 的概率是多少?,角动量 z 分量的平均值为多少?解: 由波函数131321122101-++=ψψψψc c c 得:n 1=2,l 1=1,m 1=0; n 2=2, l 2=1,m 2=1; n 3=3,l 3=1,m 3=-1;(1)由于131211210,,-ψψψψ和都是归一化的,且单电子原子)(6.1322eV nz E -=故(2) 由于 1)l(l M +=||, l 1=1,l 2=1,l 3=1,又131211210,,-ψψψψ和都是归一化的,故()eV c eV c c eV c eV c eV c E c E c E c E cE ii i 232221223222221323222121299.1346.13316.13216.13216.13-+-=⎪⎭⎫ ⎝⎛⨯-+⎪⎭⎫ ⎝⎛⨯-+⎪⎭⎫ ⎝⎛⨯-=++==∑2223232221212h h h M c M c M c M cM ii i ++==∑则角动量为π22h 出现的概率为:1232221=++c c c(3) 由于π2hm M Z ⨯=, m 1=0,m 2=1,m 3=-1; 又131211210,,-ψψψψ和都是归一化的, 故4. 已知类氢离子 He +的某一状态波函数为:()022-023021e 222241a r a r a ⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛π (1)此状态的能量为多少?(2)此状态的角动量的平方值为多少? (3)此状态角动量在 z 方向的分量为多少? (4)此状态的 n , l , m 值分别为多少? (5)此状态角度分布的节面数为多少?解:由He +的波函数()002302/1222241a 2r 2-e a r a ⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛π=ψ,可以得到:Z=2,则n =2, l =0, m =0 (1) He +为类氢离子,)(6.1322eV n z E -=,则eV eV eV n z E 6.13)(226.13)(6.132222-=⨯-=-=(2) 由l =0,21)l(l M+=2,得0)10(02=+=+=221)l(l M(3) 由|m |=0, m M Z =,得00=== m M Z(4) 此状态下n =2, l =0, m =0(5) 角度分布图中节面数= l ,又l =0 ,故此状态角度分布的节面数为0。


第二章《原子结构与性质》导学案第一节共价键(第二课时共价键的键参数等电子原理)【学习目标】1.通过阅读思考、数据分析,认识键能、键长、键角等键参数的概念,能用键参数――键能、键长、键角说明简单分子的某些性质。
2通过讨论交流、问题探究等活动,知道等电子原理,会判断简单的等电子体,能结合实例说明“等电子原理的应用。
【学习重点】键参数的概念、“等电子原理”及应用【学习难点】用键参数说明简单分子的结构和某些性质【自主学习】旧知回顾:1.化学反应的实质是反应物分子内旧键的断裂和生成物分子内新键的形成。
当物质发生化学反应时,断开反应物的化学键要_吸收_(放出或吸收)能量;而形成生成物的化学键要__放出__(放出或吸收)能量。
2.s轨道与s轨道形成σ键时,电子并不是只在两核间运动,只是电子在两核间出现的概率大。
因s轨道是球形的,故s轨道与s轨道形成σ键时,无方向性。
两个s 轨道只能形成σ键,不能形成π键。
两个原子间可以只形成σ键,但不能只形成π键。
新知预习:1.键能、键长和键角是共价键的三个键参数。
键能是气态基态原子形成1 mol化学键释放的最低能量。
键能的单位是 kJ·mol-1 。
键长是指形成共价键的两个原子之间的核间距,因此原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
键角是指在原子数超过2的分子中,两个共价键之间的夹角。
在多原子分子中键角是一定的,这表明共价键具有方向性。
键角是描述分子立体结构的重要参数。
2.等电子原理是原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
如 CO和N2 等。
【同步学习】情景导入:N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么?要解决这个问题就要了解这些分子中共价键的构成和共价键的键参数。
活动一、共价键的价参数1.阅读思考:(1)阅读教材P30页内容,结合表2-1,思考键能的概念是什么?键能与分子的稳定性有何关系?【温馨提示】①键能是气态基态原子形成1 mol化学键释放的最低能量。


原子与分子的结构与性质原子与分子是构成物质的最基本单位,在化学和物理学中扮演着重要的角色。
他们的结构以及性质对于了解物质的本质、化学反应以及材料科学等方面都有着至关重要的影响。
本文将通过介绍原子与分子的结构和性质来探讨它们在科学研究和实际生活中的重要性。
一、原子的结构与性质1.1 原子的组成原子是构成物质的最小单位,由带正电荷的质子、不带电荷的中子以及带负电荷的电子组成。
质子和中子聚集在原子的中心,形成了原子核,而电子则环绕在原子核外层。
1.2 原子的结构模型原子的结构模型可以追溯到希腊时代的“质点模型”,但最为广泛接受的原子结构是由尼尔斯·玻尔提出的“波尔模型”。
波尔模型认为电子绕原子核转动的轨道是固定的,且电子能量是量子化的。
这个模型成功地解释了氢原子光谱等实验现象,并奠定了量子力学的基础。
1.3 原子的性质原子的性质主要通过其原子核和电子的特性来决定。
质子和中子的数量决定了原子的质量数,而电子的数量决定了原子的电荷性质。
不同原子的质子和中子的数量不同,因此原子的质量也不同。
电子在原子核周围的运动轨道也不同,这导致了不同元素的化学性质的差异。
二、分子的结构与性质2.1 分子的组成分子是由两个或多个原子以共用或共享电子的方式结合而成的。
在分子中,原子通过化学键相互连接,形成了复杂的结构。
2.2 分子结构的确定分子结构的确定是化学研究的重要内容之一。
通过实验技术如X射线晶体学、核磁共振等,科学家可以决定分子中各个原子的相对位置和空间排列。
这对于了解分子的性质和功能至关重要。
2.3 分子的性质分子的性质主要由其组成原子和化学键的特性所决定。
分子的大小、形状、化学键的类型等都会影响分子的性质。
分子的性质与其所在的化学物质有关,不同的分子之间会发生化学反应,形成新的物质。
三、原子与分子的应用3.1 化学反应原子与分子是理解化学反应过程的基础。
在化学反应中,原子和分子之间的化学键会被打破和形成,从而导致物质的转化。

第二章 原子结构和性质教学目的:通过H 原子薛定谔方程的求解,了解原子结构中量子数的来源,类氢离子波函数的图形及其物理意义。
掌握多电子原子的原子轨道能级等,推导原子基态光谱项。
教学重点:1.类氢离子波函数量子数的物理意义。
2.掌握多电子原子的原子轨道能级、电离能的求解。
3.推导等价、非等价电子的原子光谱项,掌握基态原子谱项的快速推算法。
第一节 单电子原子的薛定谔方程及其解引言:前面介绍了量子力学的概念,建立了量子力学的基础,下面我们要讨论原子结构的核心问题,即原子中电子的运动状态,其中最简单的体系就是原子核外只有一个电子的体系,也叫单电子原子结构,如氢原子和类氢离子(H ,Li 2+,He +,Be 3+……)。
一.建立单电子原子的Schrodinger 方程r Ze mh M h H e N 022********ˆπεππ-∇-∇-= 假设在研究电子运动时核固定不动,r Ze mh H 0222248ˆπεπ-∇-= 为了解题方便通常将x,y ,z 变量变换成极坐标变量r ,θ,φ由图可得如下关系:⎪⎭⎪⎬⎫⋅=⋅⋅=⋅⋅=θφθφθcos sin sin cos sin r z r y r x得极坐标形式的Schrodinger 方程:048sin 1sin sin 110222222222=⎪⎪⎭⎫⎝⎛++∂∂+⎪⎭⎫ ⎝⎛∂∂∂∂+⎪⎭⎫ ⎝⎛∂∂∂∂ψπεπφψθθψθθθψr Ze E h m r r r r r r二、单电子Schrodinger 方程的一般解。
1. 变数分离法把含三个变量的微分方程化为三个各含一个变量的常微分方程来求解。
令()()r R r =φθψ,,Θ(θ)Φ(φ)()()φθ,,Y r R =代入薛定鄂方程,经过数学变换得三个方程:R(r)方程 ()()k E r hm r h mZe r r R r r r R =++⎪⎭⎫ ⎝⎛∂∂∂∂⋅2222022821πεπ Θ方程22sin )(sin )(sin m k =+⎪⎭⎫ ⎝⎛∂Θ∂⋅∂∂⋅Θθθθθθθθ Φ方程222)()(1m =∂Φ∂⋅Φ-φφφ 2. Φ方程的解Φ方程整理得:0222=Φ+Φm a a φ这是一个常系数2阶齐次线性方程,它的特征方程为022=+m p i m p ±=微分方程的两个特解为φim Ae m =Φ m m ±= A 由归一化求得: π21=A ∴φπim e m 21=Φ 这是解的复数形式,由于Φ是循环坐标所以()()πφφ2+Φ=Φm m 于是πφπφφ2)2(im im im im e e e e ⋅==+ 即12=πim e由欧拉公式12sin 2cos 2=+=m i m e im πππ故m 的取值必须为: 2,1,0±±=m 即取值是量子化的称为磁量子数。

第二章原子结构第1节电子的发现与汤姆孙模型一、物质结构的早期探究①我国西周的“五行说”;古希腊的亚里士多德认为万物的本质是土、水、火、空气四种“元素”,天体则由第五种“元素”——“以太”构成;古希腊哲学家德谟克利特等人建立了早期的原子论。
②1661年,玻意耳以化学实验为基础建立了科学的元素论.③19世纪初,道尔顿提出了原子论,认为原子是元素的最小单位.④1811年,意大利化学家阿伏伽德罗提出了分子假说,指出分子可以由多个相同的原子组成.结论:在物质的结构中存在着分子、原子这样的层次,宏观物质的化学性质决定于分子,而分子则由原子组成.原子是构成物质的不可再分割的最小颗粒,它既不能创生,也不能消灭.二、电子的发现及汤姆孙模型19世纪末物理学的三大发现:①1895年伦琴发现了X射线;②X射线发现后不久,贝克勒尔发现了放射性;③1897年汤姆孙发现了电子汤姆孙的原子模型:原子带正电的部分充斥整个原子,很小很轻的电子镶嵌在球体的某些固定位置,正像葡萄干嵌在面包中那样三、“阴极射线”性质(1)电性的确定方法一:让阴极射线进入已知电场,由所受电场力方向确定带电的性质.方法二:让阴极射线进入磁场,由所受洛伦兹力的方向,根据左手定则确定带电的性质.(2)比荷的测定方法①让粒子通过正交的电磁场,如图所示,让其做直线运动,根据二力平衡条件,即F洛=F电(Bq v=qE)得到粒子的运动速度v=E B.②在其他条件不变的情况下,撤去电场,如图2-1-2所示,保留磁场,让粒子只在磁场中运动,由洛伦兹力提供向心力即Bq v=m v2R,根据磁场情况和轨迹偏转情况,由几何知识求出其半径R.③由以上方法确定粒子比荷的表达式:qm=EB2R.1.早期原子论是由谁创立的()A.阿伏伽德罗B.汤姆孙C.玻意耳D.德谟克利特2.下列说法不正确的是()A.汤姆孙研究阴极射线,用测定粒子比荷的方法发现了电子B.电子的发现证明了原子是可分的C.汤姆孙认为原子里面带正电荷的物质应充斥整个原子,而带负电的电子,则镶嵌在球体的某些固定位置D.汤姆孙原子模型是正确的3.历史上第一个发现电子的科学家是()A.贝可勒尔B.道尔顿C.伦琴D.汤姆孙4.关于电荷的电荷量,下列说法错误的是()A.电子的电荷量是由密立根油滴实验测得的B.物体所带电荷量可以是任意值C.物体所带电荷量最小值为1.6×10-19C D.物体所带的电荷量都是元电荷的整数倍5.(多选)汤姆孙对阴极射线的探究,最终发现了电子,由此被称为“电子之父”.关于电子的说法正确的是()A.任何物质中均有电子B.不同的物质中具有不同的电子C.电子质量是质子质量的1836倍D.电子是一种粒子,是构成物质的基本单元6.(多选)关于阴极射线的性质,下列说法正确的是()A.阴极射线带负电B.阴极射线带正电C.阴极射线中的负电粒子的比荷与氢离子的基本相同D.阴极射线中的负电粒子的带电荷量与氢离子的相同7.(多选)如图所示是汤姆孙的气体放电管的示意图,下列说法中正确的是()A.若在D1、D2之间不加电场和磁场,则阴极射线应打到最右端的P1点B.若在D1、D2之间加上竖直向下的电场,则阴极射线应向下偏转C.若在D1、D2之间加上竖直向下的电场,则阴极射线应向上偏转D.若在D1、D2之间加上垂直纸面向里的磁场,则阴极射线不偏转8.如图所示,在阴极射线管正上方平行放一通有强电流的长直导线,则阴极射线将()A.向纸内偏转B.向纸外偏转C.向下偏转D.向上偏转9.(多选)如图所示,一只阴极射线管,左侧不断有电子射出,若在管的正下方放一通电直导线AB时,发现射线径迹往下偏,则()A.导线中的电流由A流向BB.导线中的电流由B流向AC.若要使电子束的径迹往上偏,可以通过改变AB中的电流方向来实现D.电子束的径迹与AB中的电流方向无关10.在汤姆孙测电子比荷的实验中,采用了如图所示的阴极射线管,从电子枪C出来的电子经过A、B间的电场加速后,水平射入长度为L的D、G 平行板间,接着在荧光屏中心F出现荧光斑.若在D、G间加上方向向下,场强为E的匀强电场,电子将向上偏转;如果再利用通电线圈在D、G电场区加上一垂直纸面的、磁感应强度为B的匀强磁场(图中未画),荧光斑恰好回到荧光屏中心,接着再去掉电场,电子向下偏转,偏转角为θ,试解决下列问题.(1)说明图中磁场沿什么方向;(2)根据L、E、B和θ,求出电子的比荷.【答案】(1)垂直纸面向里(2)em=E sin θB2L11.汤姆孙用来测定电子的比荷(电子的电荷量与质量之比)的实验装置如图所示.真空管内的阴极K发出的电子(不计初速、重力和电子间的相互作用)经加速电压加速后,穿过A′中心的小孔沿中心轴O1O的方向进入到两块水平正对放置的平行极板P和P′间的区域,平行极板间距为b.当极板间不加偏转电压时,电子束打在荧光屏和中心O点处,形成了一个亮点;加上偏转电压U后,亮点偏离到O′点,(O′点与O点的竖直间距为d,水平间距可忽略不计)此时,在P和P′间的区域,再加上一个方向垂直于纸面向里的匀强磁场.调节磁场的强弱,当磁感应强度的大小为B时,亮点重新回到O点.求打在荧光屏O点的电子速度的大小.【答案】UBb第2节原子的核式结构模型一、α粒子散射实验汤姆孙的葡萄干面包模型卢瑟福的原子核式模型分布情况正电荷和质量均匀分布,负电荷镶嵌在其中正电荷和几乎全部质量集中在原子中心的一个极小核内,电子质量很小,分布在很大空间内受力情况α粒子在原子内部时,受到的库仑斥力相互抵消,几乎为零少数靠近原子核的α粒子受到的库仑力大,而大多数离核较远的α粒子受到的库仑力较小二、卢瑟福的原子模型及原子大小(1)核式结构模型:①原子的内部有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核内,带负电的电子绕核运动.②原子的核式结构模型又被称为行星模型.(2)原子的大小:①原子直径数量级:10-10 m.②原子核直径数量级:10-15_m. 1.下列能揭示原子具有核式结构的实验是()A.光电效应实验B.伦琴射线的发现C.α粒子散射实验D.氢原子光谱的发现2.卢瑟福提出原子的核式结构学说的根据是α粒子轰击金箔的实验,在实验中他发现α粒子()A.全部穿过或发生很小的偏转B.全部发生很大的偏转,甚至有的被反弹回C.绝大多数不发生或只发生很小的偏转,有极少数发生很大的偏转,个别甚至被反弹回D.绝大多数发生很大的偏转,甚至被反弹回,只有少数穿过3.(多选)α粒子散射实验结果表明()A.原子中绝大部分是空的B.原子中全部正电荷都集中在原子核上C.原子内有中子D.原子的质量几乎全部都集中在原子核上4.在α粒子散射实验中,不考虑电子和α粒子的碰撞影响,是因为() A.α粒子与电子根本无相互作用B.α粒子受电子作用的合力为零,是因为电子是均匀分布的C.α粒子和电子碰撞损失能量极少,可忽略不计D.电子很小,α粒子碰撞不到电子5.(多选)如图所示为卢瑟福和他的同事们做α粒子散射实验装置的示意图,荧光屏和显微镜一起分别放在图中A、B、C、D四个位置时,观察到的现象,下述说法中正确的是()A.放在A位置时,相同时间内观察到屏上的闪光次数最多B.放在B位置时,相同时间内观察到屏上的闪光次数只比A位置稍少些C.放在C、D位置时,屏上观察不到闪光D.放在D位置时,屏上仍能观察一些闪光,但次数极少6.(多选)英国物理学家卢瑟福用α粒子轰击金箔,发现了α粒子的散射现象.如图所示,O表示金原子核的位置,则能正确表示该实验中经过金原子核附近的α粒子的运动轨迹的是()BD7.如图所示,根据α粒子散射实验,卢瑟福提出了原子的核式结构模型.图中虚线表示原子核所形成的电场的等势线,实线表示一个α粒子的运动轨迹.在α粒子从a运动到b,再运动到c的过程中,下列说法中正确的是() A.动能先增大,后减小B.电势能先减小,后增大C.电场力先做负功,后做正功,总功等于零D.加速度先变小,后变大8.(多选)α粒子散射实验中,当α粒子最接近原子核时,α粒子符合下列哪种情况()A.动能最小B.势能最小C.α粒子与金原子组成的系统的能量最小D.所受原子核的斥力最大9.如图所示,实线表示金原子核电场的等势线,虚线表示α粒子在金核电场中散射时的运动轨迹.设α粒子通过a、b、c三点时速度分别为v a、v b、v c,电势能分别为εa、εb、εc,则()A.v a>v b>v c,εb>εa>εcB.v b>v c>v a,εb<εa<εcC.v b>v a>v c,εb<εa<εcD.v b<v a<v c,εb>εa>εc10.在卢瑟福α粒子散射实验中,金箔中的原子核可以看作静止不动,下列各图画出的是其中两个α粒子经历金箔散射过程的径迹,其中正确的是()C第3节玻尔的原子模型一、玻尔理论的内容轨道量子化:轨道半径只能够是一些不连续的、某些分立的数值能量量子化:与轨道量子化对应的能量不连续的现象跃迁假说:原子从一种定态(设能量为E2)跃迁到另一种定态(设能量为E1)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即hν=E2-E1(或E1-E2).总而言之根据玻尔的原子理论假设,电子只能在某些可能的轨道上运动,电子在这些轨道上运动时不辐射能量,处于定态.只有电子从一条轨道跃迁到另一条轨道上时才辐射能量,辐射的能量是一份一份的,等于这两个定态的能量差.这就是玻尔理论的主要内容二、氢原子的能级结构氢原子在不同能级上的能量和相应的电子轨道半径为E n=E1n(n=1,2,3,…);r n=n2r1(n=1,2,3,…),式中E1≈-13.6 eV,r1=0.53×10-10 m.三、原子能级跃迁(1)能级跃迁:处于激发态的原子是不稳定的,它会自发地向较低能级跃迁,经过一次或几次跃迁到达基态.所以一群氢原子处于量子数为n的激发态时,可能辐射出的光谱线条数为N=n(n-1)2=C2n。

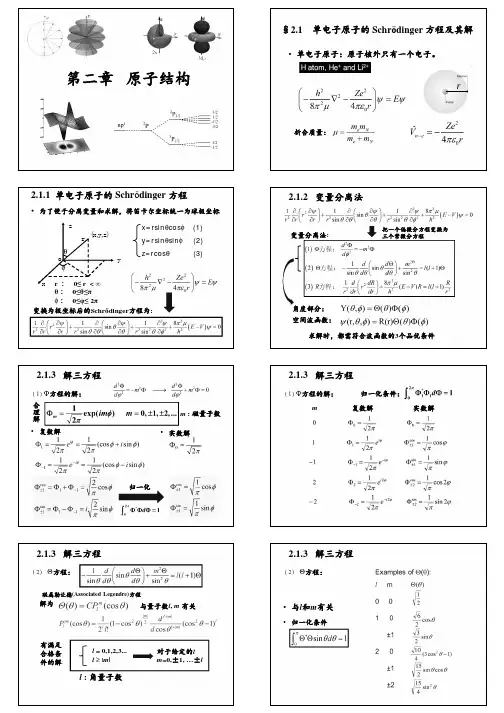
第二章 原子结构与性质§2.1.氢原子和类氢原子的薛定谔方程及其解 2.1.1.单电子原子的薛定谔方程H 原子和He +、Li 2+ 等类氢离子是单原子,它们的核电荷数为Z ,若把原子的质量中心放在坐标原点上,绕核运动的电子离核的距离为r ,电子的电荷为-e ,其静电作用势能为:r Ze V 024πε-=将势能代入薛定谔方程:得 0)(22282=ψ++ψ∇rZe h mE π或ψ=ψ-∇-E rZe mh ][22228π为了解题方便,将x 、y 、z 变量换成极坐标变量r 、θ、φ。
其关系:φθcos sin r x = φθsin sin r y =φcos r z =2222z y x r++=21)/(cos 222z y x Z ++=θx y tg /=φ})(sin )({2222sin 1sin 1212φθθθθθ∂∂∂∂∂∂∂∂∂∂++=∇r rr r 代入薛定谔方程:)()(sin )(2222222228sin 11sin 1121=ψ++++∂∂∂ψ∂∂∂∂∂∂∂rZe h mr r r rr E r πφθθθθθ2.1.2.分离变量§法:上述的方程是含三个度量的偏微分方程,要解这个方程可用度数分离法将其化为三个分别只含一个度量的常微分方程求解。
含:)()()(),,(φθθΦΘ=Φψr R r 代入方程:并乘以ΘΦR r θ22sin 移项可得:)(sin )(sin )(228sin 2sin 122222V E r r hu d d d ddr dR drdR d d ----=ΘΘΦΦθθπθθθθφ左边不含r 、θ,右边不含φ,欲左右两边相等必等于同一个常数(-m 2 )Φ-=Φ222m d d φ, 而右边可为:(除以sin θ))(sin )()(sin1sin 8212222θθθθπθd d d d m hur dr dR drdR V E r ΘΘ-=-+ 则有:K d d d d m =-ΘΘ)(sin sin1sin 22θθθθθK E r rZe hur dr dR drdR =++)()(2222821π2.1.3.方程解的结果 2.1.3.1.Φ(φ)方程的解0222=Φ+Φm d d φ这是一个常系数二阶齐次线性方程,有两个复函数的独立解。
高二原子结构与性质知识点原子结构与性质是高二化学学科的重要内容之一,它涉及到原子的组成、结构以及性质等方面的知识。
下面将从原子的组成,原子结构和原子性质三个方面进行详细的讲解。
一、原子的组成在化学中,我们常常听到原子这个名词,那么什么是原子呢?原子是物质的基本单位,在化学中具有重要的地位。
原子由质子、中子和电子三种基本粒子组成。
1. 质子:质子是原子的基本正电荷粒子,它位于原子的核心,具有单位正电荷。
2. 中子:中子是原子的基本中性粒子,它同样位于原子的核心,不带电荷。
3. 电子:电子是原子的基本负电荷粒子,它以负电荷环绕在原子核外部的电子层中。
这样,原子的基本组成就是由质子、中子和电子三种粒子构成的。
二、原子结构原子结构是指原子内部的构造布局,它涉及到电子的排布和层次结构。
根据原子结构理论,原子由核和电子层构成。
原子核由质子和中子组成,质子和中子集中在原子核的中心。
而电子以不同能级的轨道围绕在原子核外部。
1. 能级:能级是指电子在原子结构中所具有的不同能量的分层结构。
在原子结构中,能级的层数不同,能级越靠近原子核,其能量越低,能级越远离原子核,其能量越高。
2. 电子轨道:电子轨道是指电子在原子内部所具有的固定路径。
根据原子结构理论,电子轨道可以分为四种类型:s轨道、p轨道、d轨道和f轨道。
其中s轨道最接近原子核,能级最低,p轨道次之,d轨道再次,f轨道最远离原子核,能级最高。
通过以上的原子结构分析,我们可以看出,原子的电子层数与元素的周期性质、元素化合价等性质有着密切关系。
三、原子性质原子的性质是指原子所具有的特征和行为。
原子性质主要包括物理性质与化学性质两个方面:1. 物理性质:物理性质是指原子在物理过程中所表现出来的性质。
例如,原子的质量、尺寸、稳定性等都属于物理性质。
原子的物理性质是通过一系列物理实验来确定的。
2. 化学性质:化学性质是指原子在化学反应过程中所表现出来的性质。
例如,原子的化学反应性、化学价、化学键等都属于化学性质。
原子结构与性质原子是构成物质的基本单位,它的结构和性质对于理解物质的本质和化学反应的进行非常重要。
本文将从原子结构的基本概念入手,探讨原子的组成及其对物质性质的影响,旨在为读者提供一个全面的了解。
首先,我们来了解一下原子的基本概念。
原子是由一个或多个电子组成的负电荷,围绕着一个中心的正电荷核而存在。
原子核由质子和中子组成,而电子则以不同的轨道绕核运动。
质子的数量决定了原子的原子序数,也决定了元素的化学性质。
中子的数量可以不同,但对于元素的性质并没有直接的影响。
原子的性质主要取决于其原子序数,也就是质子的数量。
原子序数越大,元素的性质越活泼。
我们常见的元素周期表将元素按照原子序数的升序排列,这种排列方式体现了元素的周期性规律。
原子序数较小的元素,例如氢、锂、钠等,往往具有较强的金属性质,而原子序数较大的元素,例如氯、溴、碘等,则较容易与其他元素形成化合物。
原子的结构对于物质的性质也有显著的影响。
首先,原子的质子与电子数量相等,因此一个中性原子的质子数也相当于其电子数。
而电子的分布则取决于能级和轨道,这将决定原子的大小和稳定性。
当一个原子中的电子填满了一个能级,那么剩余的电子将被填充到下一个能级中。
当这个过程继续下去时,会形成电子能级的层次结构。
原子的轨道是指电子在原子周围的空间运动概率最大的区域。
轨道可以分为不同的类型,包括s轨道、p轨道、d轨道和f轨道。
不同轨道具有不同的能量和形状。
s轨道是球形的,而p轨道则呈现出双平行的形状。
d和f轨道则更为复杂。
这些轨道的存在使得电子能够占据不同的空间位置,从而塑造了原子的形状和结构。
除了以上的基本结构,原子还具有许多其他的性质。
一个重要的性质是原子的电子亲和能和电离能。
电子亲和能是指一个原子吸收外部电子形成负离子的能力,而电离能则是指一个原子失去电子形成正离子的能力。
这些性质对于理解化学反应和元素的性质具有重要意义。
例如,具有较低电离能的金属元素往往容易失去电子形成阳离子,而具有较高电子亲和能的非金属元素则能够吸收电子形成阴离子。
第二章原子结构与性质1. 填空题(1) He+离子的薛定谔方程为。
(2) 用分离变量法解类氢原子薛定谔方程采用的主要近似是。
(3) 已知Cu 的原子序数为29,写出核外电子排布。
(4) He+的2s电子能量比He(1s12s1)中2s电子能量。
(填高或低)(5) 钠的电子组态为1s22s22p63s1,其光谱项为,光谱支项为。
(6) 写出d2可能的总轨道角量子数。
(7) 离核越近径向函数R1s(r)其值,离核越近径向分布函数D=r2R1s2(r) 。
(8) 氢原子态函数Ψ(r,θ,φ) 可以写作R(r),Θ(θ), (φ) 三个函数的乘积,它们由量子数; ; 来规定。
(9) 如一原子的轨道磁量子数m=0, 主量子数n≤2,则可能的轨道为。
(10) 在一定电子组态下,描写多电子原子状态的量子数是。
(11) 两个氢原子,第一个的电子处于主量子数n=1的轨道,第二个处于n=4的轨道,原子势能较低的是,原子电离能较低的是。
(12) 多电子原子中的一个光谱项支项3D2,据此给出原子的总轨道角动量量子数,原子的总自旋角动量量子数,原子总角动量量子数,在磁场中分裂出个塞曼能级。
(13) 氢原子的态函数Ψ3,2,1,其轨道能量为,轨道角动量,轨道角动量在磁场方向的分量为。
(14) 氢原子3d电子轨道角动量沿磁场方向分量的可能值为。
(15) 对于氢原子及类氢离子的1s电子来说,出现在半径为r,厚度为d r的球壳内,各个方向的概率密度(填相等或不相等),对于2p x电子(填相等或不相等)。
(16) 同电子组态光谱项稳定性比较:3P1D; 3P21P02. 选择题(1) 关于四个量子数n, l, m, m s,下列叙述正确的是: ·············································· ( )A、由实验测定;B、解类氢原子薛定谔方程得到的;C、解类氢原子薛定谔方程得到的n, l, m, 由电子自旋假设引入m sD、由自旋假设引入的(2) 决定多电子原子轨道的能量是: ···································································( )A、nB、n, l, ZC、n+0.4lD、n, m(3) 用来表示核外某电子运动状态的下列各组量子数(n,l,m,m s)合理的是: ··················· ( )A、2, 1, 0, 0B、0, 0, 0, 12C、3, 1, 2,12D、2, 1, -1, -12(4) 氢原子3d状态轨道角动量沿磁场方向的分量最大值是:····································( )A、5B、4C、3D、2(5) 如下表达式为径向分布函数的是: ·······························································( )A、R2B、R2drC、r2R2D、r2R2d r(6) R n,l(r)-r图中,节点数为·············································································· ( )A、n-1个B、n-l-1个C、n-l+1个D、n-l-2个(7) 原子的电子云角度分布图应该用如下哪一个函数对参数作图······························ ( )A、|Y l,m(θ,φ)|2B、R n,l(r)C、Y l,m(θ,φ)D、|R n,l(r)Y l,m(θ,φ)|2(8) 对于单电子原子,在无外场时,能量相同的轨道数是: ······································· ( )A、n2B、2(l+1)C、n-1D、n-l-1(9) 已知Ca的第一激发态的电子组态为[Ar]3d14s1, 其光谱支项有如下四种,指出能量最低的光谱项:A、1D2B、3D3C、3D2D、3D1(10) 求解氢原子薛定谔方程,我们常采用下列哪些近似?······································( )①核固定②变数分离③以电子质量代替折合质量④球极坐标A、①③B、①②C、①④D、①②③④(11) 基态铬原子(原子序数是24)的核外电子排布为: ············································( )A、[Ar]3d44s2B、[Ar]3d54s1C、[Ar]3d64s0D、4s24p4(12) 某多电子原子中电子具有下列量子数(n,l,m,m s),其中轨道角动量最大的是: ·······( )A、2,1,-1,12B、2,0,0,-12C、3,1,1,-12D、3,2,-1,12(13)描述原子轨道3d z2的一组量子数是: ····························································· ( )A、2,1,0B、3,2,0C、3,1,0D、3,2,1(14)3d z2轨道的角动量大小为: ·········································································( )A、B、 C、0 D(15) He+中一个电子处于径向分布图中总节面为3的d态,则该电子的能量应为:·······( )A、1E1B、19E1C、14E1D、116E1(16) 氢原子中处于Ψ2pz状态,其角动量在下列哪一个轴上的投影有确定值?···············( )A、x轴B、y轴C、z轴D、x轴和y轴(17) 对于类氢原子的基态, 下列结论不正确的是: ·················································( )A、E相同B、M z相同C、简并度相同D、l相同(18) Be3+ 的一个电子所处的轨道,能量等于氢原子1s轨道能,该轨道可能是: ······( )A、1sB、2sC、4dD、3p(19) 4d 的径向分布函数图的极大值数与节面数分别是: ··········································( )A、2,1B、2, 3C、4,2D、1,3(20) 下列是关于s轨道波函数ψ的认识,正确的是:················································( )A、ψ的值随着r的增大而减小B、ψ的节面数为nC、当r趋于无穷大时,ψ趋于0D、ψ2s-r曲线在r=2a0处达到最低点(21) 对氢原子和类氢离子的量子数l,下列叙述不正确的是:·····································( )A、l的取值规定了m的取值范围B、它的取值与体系能量大小有关C、它的最大可能取值由解R方程决定D、它的取值决定了M=(22) 对于氢原子和类氢离子的径向分布D(r)-r图,下列叙述错误的是:························( )A、径向峰数与节面数都与n,l有关B、l相同,n愈大,则最高峰离核愈远C、核周围电子出现的概率为0D、最高峰所对应的r处,电子出现的概率密度最大(23) 电子在核附近有非零概率密度的原子轨道是:··············································( )A、ψ3pB、ψ4dC、ψ2pD、ψ2s(24) 电子云图是下列哪一种函数的图形?··························································( )A、D(r)B、ψ2(r,θ,φ)C、R2(r)D、ψ(r,θ,φ)(25) 已知类氢波函数ψ2px的各种图形,推测ψ3px图形,下列说法错误的是:····················( )A、角度部分的图形相同B、电子云图相同C、径向分布函数图不同D、界面图不同(26) He+离子的3d和4s的能级次序为:······························································( )A、3d >4sB、3d < 4sC、3d = 4sD、存在交叉(27) 电子组态d9s1的光谱项是: ········································································ ( )A、3F,1DB、1D,3DC、2P,3PD、1S,2P(28) Fe的电子组态为[Ar]3d64s2,其能量最低的光谱支项是:····································( )A、5D4B、3P2C、5D0D、1S0(29) Cu的基谱项为,与其基谱项不同的原子是:····································( )A、AgB、AuC、ZnD、K(30) 已知Rh的基谱项为4F9/2,则它的价电子组态是:··········································( )A、s1d8B、s0d9C、s2d8D、s0d103. 简答题(1) 请用光谱项语言叙述洪特规则。