2020届高三全国化学一轮复习专题八物质结构与性质专题8 第38讲 晶体结构与性质
- 格式:ppt
- 大小:4.37 MB
- 文档页数:65










高中化学学习材料鼎尚图文收集整理专题八物质结构和晶体结构【考查要点】物质结构与元素周期律这部分知识主要出现在选择题及填空题中。
在选择题中,主要是有关原子结构的计算、同位素、元素周期律中物质或元素性质的递变规律、元素在周期表中的位置与其性质的关系、化合物中原子的电子排布、分子的结构、晶体的结构和性质、新发现的元素等。
在非选择题中,主要考查元素的推断,物质的结构、性质、位置三者的关系。
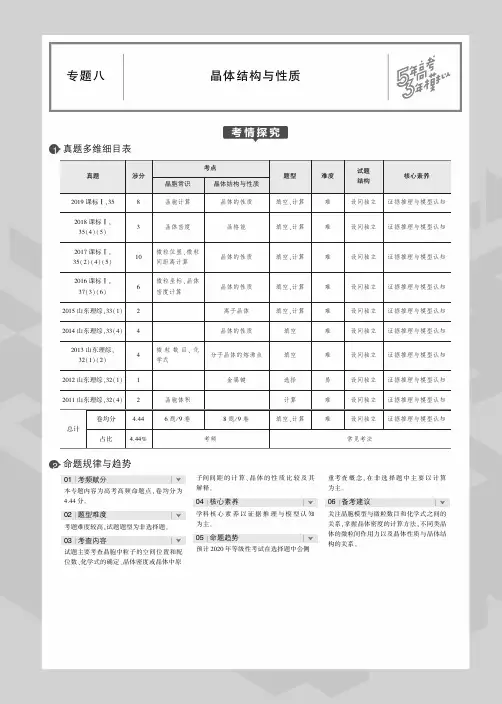
在高考卷中,本部分试题一般3个左右,分值为25分。
原子结构和同位素的考点,常以重大科技成果为题材,寓教于考;化学键类型与晶体类型的判断、成键原子最外层8电子结构的判断、离子化合物和共价化合物的电子式、各类晶体物理性质的比较、晶体的空间结构等是高考的重点内容。
本部分考试大纲的要求:1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布。
4.掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
5.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
6.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
7.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
8.了解化学键的定义。
了解离子键、共价键的形成。
今后的题型将可能向多角度、多层次、多方位的方向发展。
将元素周期率与元素周期表知识与元素化合物知识相结合,进行定性推断、归纳总结、定量计算等。
【名师解题指南】5.核外电子数相同的粒子规律(1)与He原子电子层结构相同的离子有(2电子结构):H-、Li+、Be2+(2)与Ne原子电子层结构相同的离子有(10电子结构):阴离子有F-、O2-、N3-、OH-、NH2-;阳离子有Na+、Mg2+、Al3+、NH4+、H3O+;分子有Ne、HF、H2O、NH3、CH4(3)与Ar原子电子层结构相同的离子有(18电子结构):阴离子有P3-、S2-、Cl-、HS-;阳离子有K+、Ca2+;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H46.核素与同位素(1)相对原子质量的计算:元素的相对原子质量是按各种天然同位素原子所占的原子个数百分比求出的平均值。
第38讲晶体结构与性质1. (1) BeO立方晶胞如下图所示。
①BeO晶体中,O2-的配位数为。
②若BeO晶体的密度为d g·cm-3,则晶胞参数a= (列出计算式即可)。
(2) 氟化亚铁晶胞属于四方晶系,其晶胞结构如下图所示,根据图中所示数据计算该晶体密度ρ=g·cm-3(列出计算式即可)。
(3) NaCl晶体的结构如下图所示。
已知:NaCl晶体的密度为a g·cm-3,则NaCl晶体中最近两个Na+的距离的数学表达式为cm(用含a、N A的式子表示)。
(4) 如下图所示为NiO晶体的晶胞结构示意图。
①该晶胞中占有阴、阳离子总数是。
②已知在NiO晶体中Ni2+的半径为a pm,O2-的半径为b pm,它们在晶体中是紧密接触的,则在NiO晶体中原子的空间利用率为(用含字母a、b的计算式表达)。
2. (2018·广州第一次调研)铬、钛及其化合物在工业上有重要用途,回答下列问题:(1) Cr基态原子价层电子的轨道表达式(电子排布图)为。
(2) 氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。
尿素构成元素中电负性由大到小的顺序为,中心碳原子的杂化类型为;Cr[OC(NH2)2]6Cl3含有的化学键类型有。
(3) 氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1 282 ℃)比氯化钠的高,主要原因是。
(4) 钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。
Ca处于晶胞的顶点,则Ti处于位置,O 处于位置;与Ca紧邻的O个数为,Ti与O间的最短距离为nm。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;△、●、○所代表的原子种类与图A相同)。