化学元素周期表(特性用途)
- 格式:xls
- 大小:407.00 KB
- 文档页数:2

初中化学元素周期表特点总结化学元素周期表特点总结化学元素周期表是化学家根据元素间的一些共同性质将元素按照一定顺序排列得到的表格。
通过对元素周期表的研究,我们可以看出周期表中元素的一些特点和规律。
本文将对初中化学中元素周期表的特点进行总结。
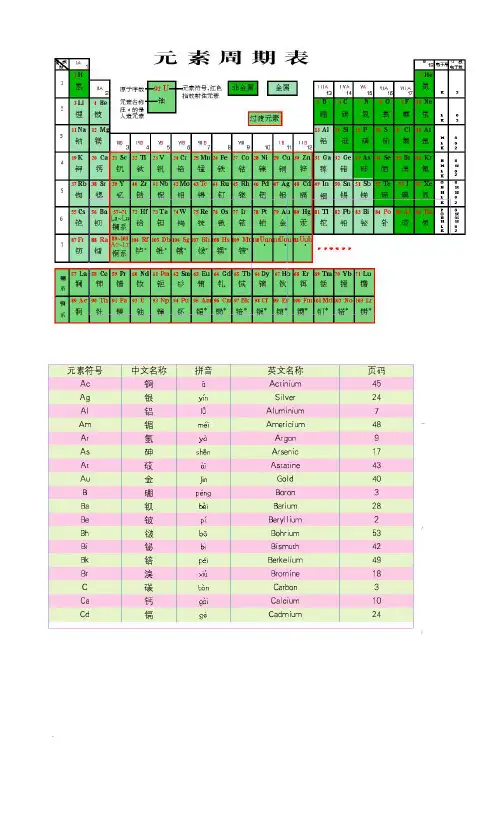
元素周期表是由横行称为周期和竖行称为族的排列方式组成。
首先我们来看周期表中的周期特点。
周期特点:1. 元素周期表横行的周期数从1到7,代表了原子核外层电子的能级数。
周期表中的第一周期只有2个元素(氢和氦),第二周期有8个元素(锂到氟),第三周期有8个元素(钠到氩),以此类推。
每个周期的元素数目递增,最多的是第四周期,有18个元素。
2. 元素周期表中的元素按照原子序数的递增顺序排列。
原子序数是元素周期表中的一个重要参数,它代表了元素原子核中的质子数。
原子序数递增的同时,元素的电子结构也会逐渐发生变化。
3. 周期表中的元素在一周期内有着相似的化学性质。
周期表中的周期特点是由电子结构引起的。
同一周期中的原子外层电子数目相同,从而使得它们的化学性质相似。
换句话说,周期表中的元素周期特点体现了相似电子结构导致的相似化学性质。
族特点:1. 元素周期表中的元素按照族的特点分为18个族。
族数代表了元素原子中的最外层电子数。
第一族到第二族是主族元素,从第三族开始是过渡金属元素。
在第六族和第七族之间是锗族和氮族,它们有一些过渡特性。
2. 同一族中的元素具有相似的化学性质。
族的特点是由最外层电子的数目和排布方式决定的。
同一族中的元素拥有相同数目的外层电子,因此它们的特征化学性质相似。
3. 元素周期表中的族特点也与元素的电子结构有关。
具有相同电子结构的元素往往具有相似的化学性质。
除了周期和族特点之外,元素周期表还有一些其他的特点:1. 元素周期表中元素的原子序数从左上到右下递增。
换句话说,原子序数越大的元素往往越重。
2. 元素周期表中的元素可以按照金属、非金属和半金属等性质进行分类。
金属元素通常具有良好的电导性、热导性和光泽,而非金属元素则通常具有较差的导电性和光泽。
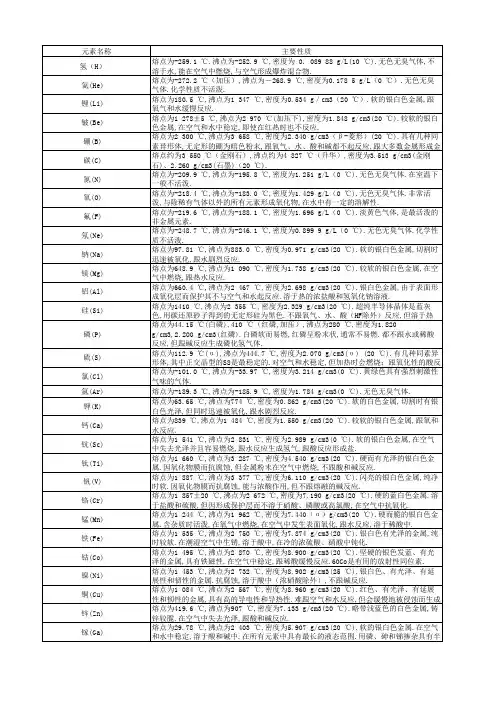
—/[ *、…氢(H)[主要性质和用途熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
发现1766年由卡文迪许()在英国判明。
氦(He);主要性质和用途熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于深海潜水、气象气球和低温研究仪器。
发现1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。
锂(Li)。
主要性质和用途熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。
软的银白色金属,跟氧气和水缓慢反应。
用于合金、润滑油、电池、玻璃、医药和核弹。
发现1817年由阿尔费德森(. Arfvedson)在瑞典发现。
铍(Be)主要性质和用途~熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。
较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。
用于与铜和镍制合金,其导电性和导热性极好。
发现1798年由沃克兰()发现硼(B)主要性质和用途*熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。
具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。
用于制硼硅酸盐玻璃、漂白和防火。
发现1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。
碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为g/cm3(金刚石)、g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
;发现在自然界中以石墨(和金刚石)存在。
古代已知有木炭和烟炱。
氮(N)主要性质和用途熔点为℃,沸点为℃,密度为g/L(0 ℃)。

初一化学元素周期表的认识与实践应用引言:化学元素周期表是化学领域最基本且重要的工具之一。
它是由元素的物理性质和化学性质排列而成的表格,能够系统地展示元素的特征和规律。
在初一化学学习中,了解和应用元素周期表对于学生深入理解化学概念和现象至关重要。
本文旨在探讨初一学生对元素周期表的认识以及它在日常生活中的实践应用。
第一部分:元素周期表的基本结构和组成元素周期表是由水平行(周期)和垂直列(族)组成的。
每一个方格代表一个元素,其中包含了元素的原子序数、元素符号和相对原子质量等信息。
以氢氦元素为起点,元素按照原子序数逐一排列,在周期表中逐渐增加。
第二部分:周期表的周期性规律元素周期表不仅仅是一张列有元素名称和符号的表格,它还显示了元素之间的周期性规律。
其中最重要的规律就是元素的周期性性质和元素的成分、结构、性质之间的关系。
以下是几个重要的周期性规律:1. 元素周期律:元素周期表中的元素按照一定的顺序排列,使得相似的元素出现在同一列(族)中。
周期表的布局有助于观察和比较元素之间的相似性和差异性。
2. 周期性趋势:元素周期表中的元素,根据元素周期表的排列顺序,原子半径、电离能和电负性等性质会出现规律的变化。
对于初一学生来说,这些性质的变化趋势和规律的理解至关重要。
3. 主族元素和过渡元素:主族元素是在周期表中的1A和2A族元素,它们的化学性质相似;而过渡元素则是周期表中的3到12族元素,它们具有相似的电子排布和反应性质。
第三部分:元素周期表的实践应用元素周期表不仅在化学理论学习中起着重要作用,还有广泛的实践应用。
1. 元素识别:元素周期表可以帮助学生识别不同的元素和其符号。
这对于实验室和科学研究中的化学分析非常重要。
2. 化学方程式:在学习化学反应方程式时,元素周期表可以帮助学生确定元素的相对原子质量和元素符号,以便正确地编写化学方程式。
3. 元素特性研究:通过研究元素周期表上元素的性质和行为,科学家们能够深入探索元素之间的相互作用和反应机制,从而推动材料科学和制药领域的进展。

碳、硅、锰、硫、磷和铬化学元素字符
碳(C)、硅(Si)、锰(Mn)、硫(S)、磷(P)和铬(Cr)是化学元素周期表中的重要元素,它们在自然界和工业生产中都扮演着重要的角色。
下面将分别介绍这些化学元素的特性和用途。
碳(C)是生命的基础,它是有机化合物的主要组成部分。
在
自然界中,碳存在于各种生物体中,包括植物、动物和微生物。
在工业生产中,碳也有着广泛的用途,例如用作燃料、制造化工产品和合金材料等。
硅(Si)是地壳中含量最丰富的化学元素之一,它在自然界中
主要以二氧化硅的形式存在。
硅是一种非金属元素,具有良好的导热性和耐高温性,因此在工业生产中被广泛应用于制造玻璃、陶瓷、光纤等材料。
锰(Mn)是一种重要的合金元素,它可以与铁、铜、铝等金
属元素形成各种合金,提高金属的硬度和耐腐蚀性。
此外,锰还可以用于制造干电池、冶金工业和化工生产等领域。
硫(S)是一种常见的非金属元素,它具有特殊的气味和易燃性。
在工业生产中,硫主要用于制造硫酸、硫化物等化工产品,同时也被广泛应用于农业、医药和橡胶工业中。
磷(P)是一种重要的营养元素,它在生物体内起着重要的生理作用。
在工业生产中,磷主要用于制造肥料、清洁剂、防腐剂等产品,同时也被用于合成有机化合物和制造火柴等产品。
铬(Cr)是一种重要的合金元素,它可以与铁、镍等金属形成不锈钢等合金材料。
此外,铬还具有良好的耐腐蚀性和抗氧化性能,在化工、冶金、建筑等领域有着广泛的应用。
总的来说,碳、硅、锰、硫、磷和铬这些化学元素在自然界和工业生产中都具有重要的地位和作用,它们为人类的生活和工业发展提供了重要的支持和保障。


化学元素周期表的介绍化学元素周期表是化学科学中极为重要的工具之一,用于组织和展示所有已知元素的信息。
它以一种有序的方式排列元素,使得相似性质的元素彼此相邻。
通过周期表,我们可以了解元素的物理性质、化学性质以及其他相关信息。
本文将介绍元素周期表的结构、排列方式以及其中蕴含的信息。
一、元素周期表的结构与排列方式元素周期表是由标准周期表和长周期表两部分组成。
标准周期表是普遍应用的周期表,共分为七个横排,称为周期,以及18个竖排,称为族。
长周期表是标准周期表的扩展,包含了较高原子序数的元素。
在标准周期表中,第一横排为1周期,其中仅包含两个元素:氢和氦。
从第二横排开始,每个周期的元素数逐渐增加。
第1族到第2族是典型金属元素,第13族到第18族包含了非金属元素以及半导体元素。
在标准周期表中,横排的序号称为元素的周期数,竖排的序号称为元素的族数。
元素周期表的横向和纵向排列都有其意义,横向反映了元素的周期性变化规律,纵向反映了元素间化学性质的相似性。
二、周期表中的信息通过元素周期表,我们可以获得许多与元素相关的重要信息:1. 元素符号和名称:周期表中每个元素都有一个独特的符号和名称,用于标识该元素。
2. 原子序数:元素周期表中的元素按照原子序数从小到大排列,原子序数代表了元素中核中的质子数量,也是元素的唯一标识。
3. 原子量:周期表中的每个元素都伴随着其相应的原子量,原子量是指元素一个原子的质量。
4. 电子排布:周期表中的每个元素都有特定的电子排布模式,描述了元素中电子的分布情况。
5. 物理性质:周期表中的元素有助于了解其物理性质,例如密度、熔点、沸点等。
6. 化学性质:元素周期表中的元素按照一定的规律排列,相邻元素在化学性质上有一定的相似性,这种相似性被称为周期性。
通过周期表,我们可以推测元素的化学性质。
7. 元素的用途:周期表中的元素有着广泛的应用,例如氢用于氢能源研究,氧用于氧气瓶制作,铁用于制造钢铁等。

初中化学元素周期表汇总化学元素周期表是化学中非常重要的工具,它是有序地排列了所有已知的化学元素,根据元素的原子序数和化学性质,使得我们能够更好地理解和研究各种化学现象。
在初中化学学习中,理解元素周期表的相关知识是非常重要的。
本文将对元素周期表的结构、元素特性以及一些重要元素进行汇总和介绍。
元素周期表的结构和排列元素周期表的结构非常有序,它由一系列的水平行和垂直列组成。
水平行被称为周期,每个周期代表了一个新的能级,从左到右,电子壳层数依次增加。
垂直列被称为族,元素周期表中的每一族都有相似的化学性质。
元素周期表可分为四个区域:主族元素区、过渡元素区、稀土元素区和超铀元素区。
化学元素的特性和分类元素周期表中的化学元素具有不同的性质,我们可以根据这些性质对元素进行分类。
1. 金属元素:位于元素周期表的左侧和中部,具有良好的导电性、导热性和延展性。
金属元素在化学反应中容易失去电子,形成阳离子。
2. 非金属元素:位于元素周期表的右侧,大多数是气体或者脆性固体。
非金属元素在化学反应中容易获得电子,形成阴离子。
3. 半金属元素:位于元素周期表的中间地带,具有金属和非金属的一些性质,也被称为“类金属”。
4. 稀有气体元素:位于元素周期表的第18族,它们是非常稳定的、较为惰性的元素,几乎不参与化学反应。
5. 过渡元素:位于元素周期表的4至7周期之间,它们通常具有较高的密度和熔点,是许多合金的重要成分。
常见元素和其性质以下是几种在初中化学中常见的元素和它们的一些性质:1. 氢(H):位于元素周期表的第1个位置,是最轻的元素。
它是宇宙中最丰富的元素之一。
氢气是一种气体,能与氧气反应生成水。
2. 氧(O):位于元素周期表的第16个位置,是空气中最常见的元素之一。
氧气对生物是必需的,支持燃烧和呼吸。
3. 碳(C):位于元素周期表的第14个位置,是生命中的主要构成元素。
碳可以形成长链,构成有机物。
4. 铁(Fe):位于元素周期表的第26个位置,是一种常见的金属元素。

化学元素周期表知识点化学元素周期表是指将化学元素按一定规律排列的表格。
它是化学研究的基础,对于理解化学元素的性质和规律非常重要。
本文将介绍化学元素周期表的基本结构、元素的周期性规律以及一些常用的元素的特性。
一、化学元素周期表的基本结构化学元素周期表通常按照元素的原子序数(或称为核电荷数)进行排序。
原子序数是指元素原子核中质子的数目,也等于元素的电子数目。
通常的周期表由18个纵列(也称为族)和7个横行(也称为周期)组成。
每一个元素的位置由其原子序数和周期数决定。
化学元素周期表的主要结构如下图所示:(图片仅作参考)在周期表中,元素按照升序排列。
纵列(族)由元素的性质相近而组成,每一周期表示一个能量层次。
周期表中最左侧的第一周期称为1A族或称碱金属,而最右侧的第十八周期称为18A族或称稀有气体。
二、元素的周期性规律元素周期表的排列不仅仅是有序的,还存在一定的规律。
这些规律被称为元素的周期性规律,主要包括原子半径、电离能、电负性和金属活性等方面。
1. 原子半径:随着周期数的增加,元素的原子半径逐渐减小;在同一周期中,元素的原子半径从左到右逐渐减小。
2. 电离能:随着周期数的增加,元素的第一电离能增加;在同一周期中,元素的第一电离能从左到右逐渐增加。
3. 电负性:随着周期数的增加,元素的电负性逐渐增加;在同一周期中,元素的电负性从左到右逐渐增加。
4. 金属活性:随着周期数的增加,元素的金属活性逐渐减弱;在同一周期中,元素的金属活性从左到右逐渐减弱。
以上规律的发现对于预测元素的化学性质和化合物的性质非常重要,有助于深入理解元素和化合物间的相互作用。
三、常用元素的特性除了周期性规律外,一些常见的元素拥有独特的性质和应用。
1. 氢(H):是宇宙中最常见的元素之一,是化学反应和能源制备过程中的重要原料。
2. 氧(O):是呼吸和燃烧过程中必须的元素,也是水(H2O)和许多其他化合物的组成部分。
3. 碳(C):是有机化合物的基础,构成了生物体中的许多重要化合物,如蛋白质、脂肪和碳水化合物等。


元素周期表中的各族元素特性一、元素周期表的构成•元素周期表是化学中用来分类元素的一种表格,按照原子序数递增的顺序排列。
•周期表中包含有7个周期和18个族。
•周期代表元素的电子层数,族代表元素的化学性质。
二、各族元素的特性1.碱金属族(1A)•具有一个最外层电子。
•具有较低的电负性和较高的还原性。
•容易与氧气、水反应,产生碱性溶液。
•熔点低,导电性好。
2.碱土金属族(2A)•具有两个最外层电子。
•具有较低的电负性和较高的还原性。
•较不活泼,与氧气、水反应较慢。
•熔点较高,导电性较好。
3.过渡金属族(3B-12B)•具有多个最外层电子,且分布在d轨道和s轨道中。
•具有较高的电负性和较低的还原性。
•具有较强的金属性和非金属性。
•熔点较高,导电性较好。
4.卤素族(17A)•具有七个最外层电子。
•具有较高的电负性和较低的还原性。
•具有较强的氧化性,容易接受电子。
•沸点较高,熔点较低,非金属性较强。
5.稀有气体族(18A)•具有八个最外层电子(氦为两个)。
•具有较低的电负性和较高的还原性。
•化学性质非常稳定,不容易与其他元素反应。
•沸点最低,熔点也较低。
6.镧系元素(15B)•具有5个最外层电子。
•具有较高的电负性和较低的还原性。
•具有较强的金属性。
•熔点较高,导电性较好。
7.锕系元素(16B)•具有6个最外层电子。
•具有较高的电负性和较低的还原性。
•具有较强的金属性。
•熔点较高,导电性较好。
三、周期表的应用•周期表可以帮助我们了解元素的电子排布、原子半径、离子半径、电负性等性质。
•周期表还可以预测元素化合物的结构和性质。
•周期表是化学学习和研究的重要工具,有助于科学家发现新的元素和化合物。
以上是关于元素周期表中各族元素特性的简要介绍,希望对您有所帮助。
习题及方法:1.习题:碱金属族中最轻的元素是什么?方法:根据知识点,碱金属族(1A)具有一个最外层电子,熔点低,导电性好。
在周期表中,碱金属族的第一种元素是锂(Li)。
化学元素周期表详解导言化学元素周期表是化学学科中一个重要的工具,用于系统地组织和呈现元素的特性和规律。
它以一种简洁、清晰的方式展示了元素的物理、化学特性以及它们之间的关联。
本文将详细解析化学元素周期表的组成、结构和意义,以及元素周期表中重要的一些特性和规律。
1. 元素周期表的组成元素周期表是由化学元素按照一定规律排列而成的表格。
每个元素在周期表中都由一个方框代表,包含了元素的符号、原子序数、相对原子质量等信息。
元素周期表通常由横行(称为周期)和纵列(称为族)组成。
周期表的主体部分分为7个周期,周期的序号从1到7,代表了元素的壳层电子分布情况。
每一个周期中,元素的壳层电子数逐渐增加,从而形成了周期性的规律。
周期表中的元素按照原子序数从小到大排列。
除了周期之外,元素周期表还包含了18个族(包括了主族和过渡族以及稀土和锕系元素),每个族都由具有相似性质的元素组成。
例如,第1族是碱金属,它们都是非常活泼的金属,容易失去电子形成离子。
2. 元素周期表的结构和排列规律元素周期表的结构和排列规律是基于元素的物理和化学性质的。
从左上到右下,周期表中的元素可以分为四大区块:s区、p区、d区和f区。
s区包括了第1和第2周期的元素,这些元素的最外层电子都位于s壳层中。
例如,氢(H)和氦(He)都属于s区。
p区包括了第3至第8周期的元素,这些元素的最外层电子位于p壳层中。
例如,氧(O)和氟(F)属于p区。
d区包括了第3至第7周期的元素,这些元素的最外层电子位于d壳层中。
例如,铁(Fe)和铜(Cu)属于d区。
f区包括了稀土元素和锕系元素,这些元素的最外层电子位于f壳层中。
3. 元素周期表中的特性和规律元素周期表不仅仅是一张整齐排列元素的表格,它也揭示了许多元素之间的特性和规律。
3.1 周期性规律元素周期表展示了元素物理和化学特性的周期性规律。
每个周期中,元素的物理和化学特性都会因为电子层的变化而发生变化。
例如,第1周期中的元素(氢和氦)是非金属,而第2周期开始的元素(锂、铍、硼等)则是金属。
元素的用途元素是构成物质的基本单位,是化学元素周期表中列出的不可分割的物质。
元素的用途多种多样,下面将对元素的用途进行详细介绍:1. 氢(H):氢气可以用作燃料和能源,如氢燃料电池。
氢气也可用于工业制备氨和甲醇等化合物,还可以用于氢气淬火、氢气溶解、氢气保护和氢气测试等工艺过程。
2. 氦(He):氦气常用于显影、气球充气和气味检测等方面。
由于其极低的沸点和惰性化学性质,氦气也在核磁共振成像(MRI)和液体冷却等领域得到广泛应用。
3. 锂(Li):锂被广泛用于锂离子电池,如移动电话、电动汽车和电子设备等。
锂离子电池具有高能量密度、长寿命和轻量化等特点,在现代社会中发挥重要作用。
4. 铍(Be):由于其高强度、高硬度和良好的导热性,铍被用于制造航天器、导弹、火箭和核能装置等高级科技产品。
它还可以制作合金,如铜-铍合金用于制造电气触点。
5. 硼(B):硼化合物广泛应用于农业、化工和材料科学等领域。
硼酸可以用于玻璃制造和制备化学试剂,硼酸和硼酸盐还可以用作防腐剂、火焰抑制剂和杀菌剂。
6. 碳(C):碳是生命存在的基础,广泛存在于有机化合物中。
碳的同素异形体石墨和金刚石被用作结构材料和磨料,碳纳米管和石墨烯等碳材料被用于电子器件和纳米技术等领域。
7. 氮(N):氮在肥料制造中被广泛应用,提供植物所需的营养物质。
氮气也用作控制氧气浓度和防止氧化等方面的惰性气体。
8. 氧(O):氧气是呼吸过程中必需的,广泛应用于医学、生产和焊接等领域。
氧气还可以用于燃烧过程中,如燃烧火焰和火箭推进剂等。
9. 氟(F):氟化物广泛用于制备氟利昂等制冷剂、氟化钠用于饮水设备和氟化氢用于制备高性能材料。
氟化物还广泛应用于牙膏中的氟化物,用于牙齿保护和预防龋齿。
10. 氖(Ne):氖气广泛用于照明和显示领域,如闪光灯、霓虹灯和氖灯等。
由于其发光强度高、稳定性好和长寿命等特点,氖灯在广告牌和显示器上得到广泛应用。
11. 钠(Na):钠广泛用于食盐的制备,是人体所需的必要元素之一。
元素周期表的相关特点与应用一、元素周期表的起源和发展•1869年,门捷列夫发现了元素周期律,并编制出世界上第一张元素周期表。
•随着化学元素的不断发现和科学技术的进步,元素周期表逐渐完善和发展。
二、元素周期表的结构•元素周期表是按照元素的原子序数递增的顺序排列的。
•表格形式,横向称为周期,纵向称为族。
•周期表中包含7个周期、18个族。
三、周期表中的元素分类•金属元素:具有光泽、导电、导热等性质。
•非金属元素:一般不导电、不导热,可分为卤族、氧族、氮族等。
•半金属元素:导电、导热性能介于金属和非金属之间。
•稀有气体元素:又称惰性气体元素,不易与其他元素反应。
四、元素周期表的规律•周期律:同一周期内,原子序数越大,元素的原子半径越小,金属性越弱,非金属性越强。
•族规律:同一族元素,原子序数越大,元素的原子半径越大,金属性越强,非金属性越弱。
•对角线规则:周期表中,位于对角线上的元素具有相似的化学性质。
五、元素周期表的应用•指导化学研究和学习:通过周期表,可以了解元素的分布、性质和用途。
•预测元素性质:根据元素在周期表中的位置,可以预测其可能的化学性质。
•指导材料科学:周期表有助于发现新的材料,如超导材料、催化剂等。
•指导药物设计:周期表有助于分析药物分子与生物分子之间的相互作用。
元素周期表是化学学科中的重要工具,它揭示了元素的内在联系和规律,为化学研究和应用提供了有力的支持。
掌握元素周期表的结构、元素分类和规律,对中学生化学学习具有重要意义。
习题及方法:1.习题:元素周期表中,哪一个元素的原子序数最大?方法:查看元素周期表,找到原子序数最大的元素。
答案:原子序数最大的元素是鿬(Uup),其原子序数为118。
2.习题:请问第三周期中的钠(Na)和氯(Cl)元素,哪一个的原子半径更大?方法:根据周期律,第三周期中,原子序数越大,原子半径越小。
因此,钠的原子半径更大。
答案:钠(Na)的原子半径更大。
3.习题:根据元素周期表,判断下列说法是否正确:①氢(H)的原子序数为1,位于第一周期第一族;②氦(He)的原子序数为2,位于第二周期第一族。
(完整版)部编版化学八年级上册元素周期表解释部编版化学八年级上册元素周期表解释元素周期表是一个用于组织和分类化学元素的表格。
它是化学学科的重要工具,帮助我们了解元素的性质、结构和相互关系。
元素周期表的基本结构元素周期表以一系列横行和纵列组成。
横行被称为周期,纵列被称为族。
每个周期表示元素外层电子壳层的数量,而每个族则表示元素的某些共同性质。
周期表中的每个方格表示一个元素。
方格中通常包含元素的标志符号、原子序数和相对原子质量等信息。
原子序数代表元素原子核内的质子数量,而相对原子质量则是元素质量与碳-12同位素质量的比值。
元素周期表的分类规则元素周期表的分类规则主要基于元素的原子性质,如原子序数、原子半径、电离能等。
1. 元素周期表从左到右按原子序数递增排列。
原子序数越大,元素的原子核内质子数量越多,且原子结构更复杂。
2. 元素周期表按周期划分,每个周期表示元素外层电子壳层的数量。
第一周期只有2个元素,第二周期有8个元素,以此类推。
3. 元素周期表按族划分,每个族表示具有相似性质的元素。
例如,第一族是碱金属,都是具有低密度和低熔点的金属元素。
4. 元素周期表中每个周期的最后一个元素是气体元素,称为稀有气体,它们非常稳定且很少与其他元素反应。
元素周期表的应用元素周期表的重要性体现在以下几个方面:1. 预测元素性质:通过周期表的布局,我们可以推测元素的一些性质,如反应活性、酸碱性、电导率等。
2. 分析化学:元素周期表为化学分析提供了基础。
分析化学中的很多实验方法都是基于元素周期表和元素特性的。
3. 化学反应:了解元素周期表可以帮助我们预测化学反应的结果和条件。
根据周期表中元素的位置,我们可以预测元素之间的反应性。
4. 材料科学:元素周期表对材料科学的研究非常重要。
通过分析元素在周期表中的位置,科学家可以设计新的材料,改变其性质并满足特定应用需求。
总结:元素周期表是一种组织和分类化学元素的工具,它提供了元素性质和相互关系的核心信息。