高考化学无机推断题大汇总(1)
- 格式:doc
- 大小:872.00 KB
- 文档页数:13


高三化学(无机推断题)精选汇编
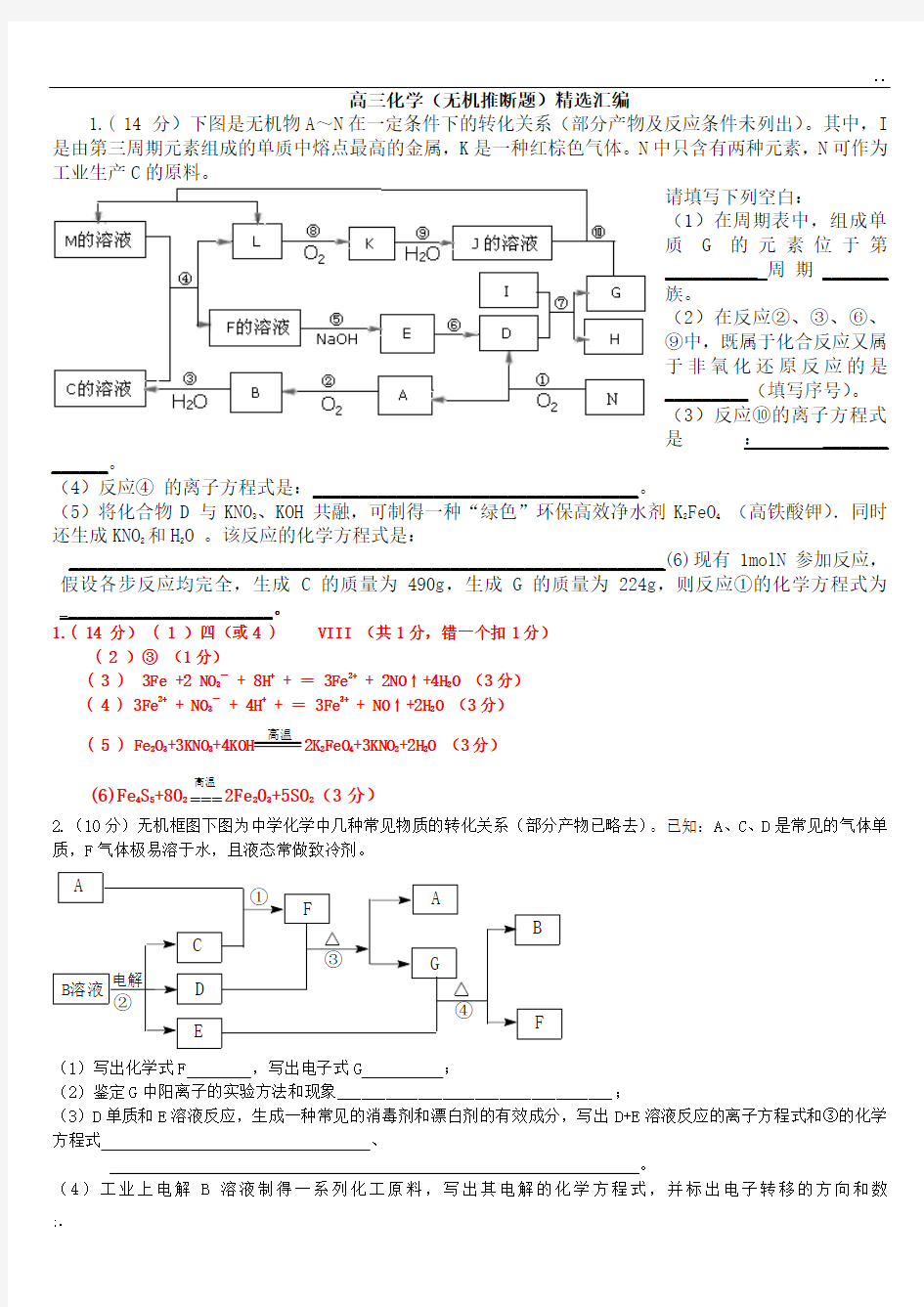
1.( 14 分)下图是无机物A ~N 在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I 是由第三周期元素组成的单质中熔点最高的金属,K 是一种红棕色气体。N 中只含有两种元素,N 可作为工业生产C 的原料。
请填写下列空白:
(1)在周期表中,组成单质G 的元素位于第__________周期_______族。
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。 (3)反应⑩的离子方程式是:_______
______。
(4)反应④ 的离子方程式是:___________________________________。
(5)将化合物D 与KNO 3、KOH 共融,可制得一种“绿色”环保高效净水剂K 2FeO 4 (高铁酸钾).同时还生成KNO 2和H 2O 。该反应的化学方程式是:
________________________________________________________________(6)现有1molN 参加反应,假设各步反应均完全,生成C 的质量为490g ,生成G 的质量为224g ,则反应①的化学方程式为_______________________。
1.( 14 分) ( l )四(或4 ) VIII (共1分,错一个扣1分)
( 2 )③ (1分)
( 3 ) 3Fe +2 NO 3- + 8H + + = 3Fe 2+
+ 2NO ↑+4H 2O (3分)
( 4 ) 3Fe 2+ + NO 3- + 4H + + = 3Fe 3+
+ NO ↑+2H 2O (3分)
( 5 ) Fe 2O 3+3KNO 3+4KOH
高温
2K 2FeO 4+3KNO 2+2H 2O (3分)
(6)Fe 4S 5+8O 2高温
2Fe 2O 3+5SO 2(3分)
2.(10分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A 、C 、D 是常见的气体单质,F 气体极易溶于水,且液态常做致冷剂。
电解
C
D E
F ①
③
F
B
②
④
A
G A
B 溶液
(1
)写出化学式F ,写出电子式G ;
(2)鉴定G 中阳离子的实验方法和现象__________________________________;
(3)D 单质和E 溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E 溶液反应的离子方程式和③的化学方程式 、
。
(4)工业上电解B 溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数
目 。
2.答案:(10分)(1)NH 3、; (共2分)
(2)取少量G 的溶液加人试管中,用胶头滴管加入少量NaOH 浓溶液,加热 用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色(2分)
(3)2OH -
+Cl 2=ClO -
+Cl -
+H 2O (2分) 8NH 3+3Cl 2
△
N 2+6NH 4Cl (2分)
(4) (2分)
3.(本题10分)A -H 及X 均为中学化学常见物质, X 是一种金属单质,A 、B 是非金属单质且A 在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
试回答下列问题:
(1)写出C 物质的化学式 ;
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是 (填编号); (3)指出元素X 在元素周期表中的位置:第 周期,第 族;
(4)请写出反应④和⑤的离子方程式: ④ ,
⑤ ; (5)用离子方程式表示在D 溶液中加入NaClO 溶液产生红褐色沉淀的原因:
。 3.(10分)(1)FeCl 3 (2分) (2)④ (2分)(3)4、Ⅷ (2分)
(4)FeS +2H +=Fe 2++H 2S ↑ (2分) H 2S +Cl 2=S ↓+2H ++2Cl -
(2分)
(5)2Fe 2++ClO -+4OH -+H 2O =2Fe(OH)3↓+Cl -
(2分)
(或6Fe 2++3ClO -+3H 2O =2Fe(OH)3↓+4Fe 3++3Cl -
)
4.(15分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A 为化合物,甲可由两种单质直接化合
得到,乙为金属单质,G 为酸,乙在G 的浓溶液中发生钝化。
(1)若A 为硫酸工业的重要原料,C 能使品红试液褪色,D 的水溶液中加入HNO 3酸化的AgNO 3溶液有白色沉淀生成。
则
A
X
B
C
D
H (红褐色沉淀)+……
E
G
B
F F A NaClO 溶液
①
②
③
④
⑤
X
①(4分)工业上反应II在中进行(填设备名称),工业上反应III用于吸收E的试剂
是。
②(2分)D的水溶液呈性(填“酸”、“碱”或“中”)
③(2分)反应I的化学方程式是。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液,并使它们接近,有大量白烟生成。则
①(2分)甲的电子式是。
②(2分)写出B和甲反应的化学方程式是。
③(3分)若17gA与O2反应生成气态的B和C时放出226.7kJ热量,写出该反应的热化学方程
式:。
4.(15分)
(1)①接触室:98.3%的硫酸(或浓硫酸)②酸
③4FeS2+11O2 ==== 2Fe2O3+8SO2
(2)①②2Na2O2+2H2O = 4NaOH+O2↑
③4NH3(g)+5O2(g) = 4NO(g) +6H2O(g);△H=-906.8kJ·mol-1(其它合理答案均给分)
5.(8分)如下图的转化关系中,已知A是由短周期元素组成的盐,H与Na
2O
2
可发生化合反应,生成的盐
与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题;
(1)写出D(少量)、H、X反应生成A的化学方程式:________________________;
(2)写出D与K反应生成的正盐溶液中的离子浓度大小关系:________________;
(3)一定温度下,有可逆反应:aD(g)+bY(g)cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol
Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
1
18
。则
前2min内用E表示的平均反应速率为________mol·L1-·min1-,平衡时D的浓度为_________mol·L1-。
(4)已知:2H(g)+Y(g)2I(g);△H=-196.6kJ·mol1-。当加入4mol H和2mol Y后,放出345 kJ
的热时,H的转化率最接近于_______(填字母)。
A、40%
B、50%
C、80%
D、90%
5.、(8分)(1)NH
3+SO
2
+H
2
O == NH
4
HSO
3
(2分)
高温