初中化学中考常见离子的鉴别专题辅导
- 格式:doc
- 大小:142.00 KB
- 文档页数:2


初中化学离子大鉴别教案学科:化学年级:初中教学目标:1.了解化学离子的基本概念和分类;2.学习化学离子的鉴别方法;3.掌握化学离子大鉴别的操作流程和注意事项。
教学内容:1.化学离子的概念和分类;2.化学离子大鉴别的方法和步骤;3.实验鉴别不同化学离子的操作方法。
教学重点:1.化学离子的分类和性质;2.化学离子大鉴别的方法和实验操作。
教学难点:1.化学离子大鉴别的实验操作流程;2.化学离子的鉴别方法和注意事项。
教学准备:1.实验器材和化学试剂:硝酸、氯化银、氢氧化钠、氢氯酸、氢氧化铝等;2.实验操作指导书;3.化学离子鉴别实验记录表。
教学过程:一、导入(5分钟)老师介绍化学离子的概念和分类,引导学生了解化学离子在化学反应中的重要性和作用。
二、理论讲解(10分钟)1.讲解化学离子的分类和性质;2.介绍化学离子大鉴别的方法和步骤。
三、实验操作(30分钟)1.学生根据实验操作指导书,进行化学离子的鉴别实验;2.学生记录实验结果,填写化学离子鉴别实验记录表。
四、结果分析(10分钟)1.学生将实验结果进行分析,根据化学离子的性质进行鉴别;2.讨论实验中可能出现的误差和改进方法。
五、总结(5分钟)1.学生总结化学离子大鉴别的方法和注意事项;2.老师对本节课进行总结和反馈。
六、作业布置(5分钟)布置作业:完成化学离子鉴别实验报告,并探究不同化学离子的特性和用途。
教学延伸:学生可以通过更多的实验和研究,进一步了解化学离子的鉴别方法和应用,提高实验操作能力和科学素养。

九年级化学总复习物质或离子的鉴别专题复习word格式整理一、知识要点:(一)物质的鉴别:已知多种物质,将它们逐个区分开来。
原理:利用该物质与被鉴别的其它物质的性质不同点1.初中化学中几种常见气体的识别(能写出所涉及的化学式和化学式)①氢气:通过灼热的氧化铜和无水硫酸铜。
现象:黑色的氧化铜变红色,无水硫酸铜变蓝色。
②氧气:将带火星的木条插入被鉴气体中,现象:带火星的木条复燃。
③ 一氧化碳:通过热的氧化铜和澄清的石灰水。
现象:黑色氧化铜变红,清澈的石灰水变浑浊。
④ 甲烷:点燃,将干燥烧杯盖在火焰上,然后向烧杯中注入清水;烧杯内壁有水滴,澄清的石灰水变浑浊。
⑤ 二氧化碳:通过澄清的石灰水。
现象:澄清的石灰水变得浑浊;⑥ 氮气:将燃烧的木条插入测试气体中。
现象:燃烧的木棍熄灭;⑦空气:将燃着的木条插入被鉴气体中。
现象:燃着的木条在空气中能继续如常燃烧。
⑧氨气:用湿润的红色石蕊试纸放在容器口。
现象:试纸变蓝。
⑨水蒸汽:通过无水硫酸铜。
现象:白色粉末变蓝色。
鉴别常见的七种气体的步骤:第一步:首先使用燃烧的木条:它是氧气,使燃烧的木条燃烧得更猛烈;正是二氧化碳和氮气使燃烧的木头熄灭;空气对木材火焰没有明显的影响;可燃气体包括氢气、甲烷和一氧化碳。
第二步:向能使燃着的木条熄灭的气体中加入澄清石灰水,石灰水变浑浊的是二氧化碳,石灰水无变化的是氮气。
第三步:测试燃烧后的可燃气体氢气、甲烷和一氧化碳的产物:用干燥的烧杯盖住火焰。
氢和甲烷由水产生,一氧化碳由无水水产生;燃烧后产生的气体被引入澄清的石灰水中,石灰水会被甲烷和一氧化碳混浊。
2.离子(即酸、碱、盐溶液)的鉴别+①酸(鉴定h)方法一:加紫色石蕊试液变红色的是酸溶液;方法二、加活泼金属mg、fe、zn等氢被释放;方法3:加入碳酸盐,如碳酸钙和其他固体,这将溶解并释放二氧化碳。
方法4:加入氢氧化铁等不溶性碱,固体溶解,溶液变黄。
-② 碱溶液(鉴别oh)方法1:加紫色石蕊试液变蓝,加无色酚酞试液变红,为碱性。

初中化学中考常见离子的鉴别一、+H1. 鉴别原理:+H 能使紫色石蕊试液变红。
鉴别方法:向待鉴别溶液样品中滴加紫色石蕊试液,若溶液变红,说明溶液中含有+H 。
2. 鉴别原理:+H 能与活泼金属反应生成氢气(仅限于鉴别稀HCl 、稀42SO H )。
鉴别方法:向待鉴别溶液样品中加入少量锌粒,若溶液中有气泡冒出,说明溶液中含有+H 。
3. 鉴别原理:金属氧化物能与+H 反应,使溶液变色。
鉴别方法:向待鉴别溶液样品中加入少量氧化铜粉末,若溶液变蓝,说明溶液中含有+H 。
注意事项:以上方法中,第一种方法为常规鉴别方法,后两种方法可用于特殊鉴别题中。
二、-OH1. 鉴别原理:-OH 能使无色酚酞试液变红。
鉴别方法:向待鉴别溶液样品中滴加无色酚酞试液,若溶液变红,说明溶液中含有-OH 。
2. 鉴别原理:-OH 能与+4NH 反应,生成具有刺激性气味的氨气。
鉴别方法:向待鉴别溶液样品中滴加氯化铵溶液,若产生具有刺激性气味的气体,说明溶液中含有-OH 。
注意事项:以上方法中,第一种方法 常规鉴别方法,第二种方法可用于特殊的鉴别题中。
三、-Cl鉴别原理:-Cl 能与+Ag 反应生成不溶于酸的白色沉淀AgCl 。
鉴别方法:向待鉴别溶液样品中滴加3AgNO 溶液,若产生白色沉淀,再向溶液中滴加稀3HNO ,沉淀不溶解,说明溶液中含有-Cl 。
注意事项:能与+Ag 反应生成白色沉淀的还有--2324CO SO 、等离子,但只有AgCl 沉淀不溶于稀3HNO ,因此,滴加稀3HNO 这一步不能省略。
四、-24SO鉴别原理:-24SO 能与+2Ba 反应生成不溶于酸的白色沉淀4BaSO 。
鉴别方法:向待鉴别溶液样品中滴加23)NO (Ba 溶液,若产生白色沉淀,再向溶液中滴加稀3HNO ,若沉淀不溶解,说明溶液中含有-24SO 。
注意事项: (1)能与+2Ba 反应生成白色沉淀的还有-23CO 等离子,但只有4BaSO 沉淀不溶于稀3HNO ,因此,滴加稀3HNO 这一步不能省略。
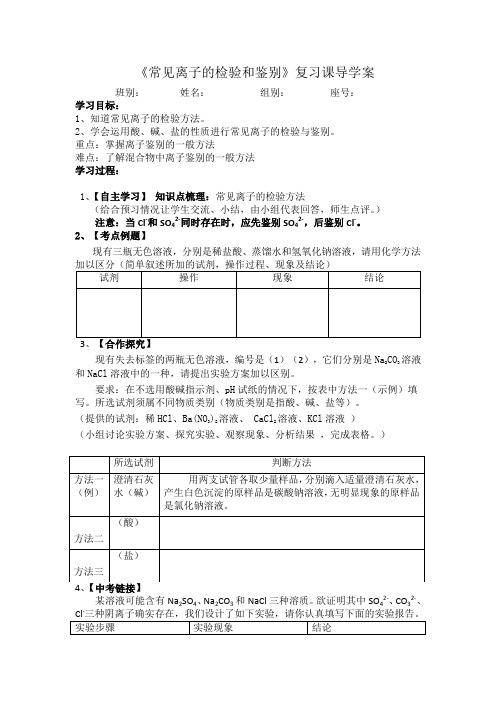
《常见离子的检验和鉴别》复习课导学案
班别: 姓名: 组别: 座号: 学习目标:
1、知道常见离子的检验方法。
2、学会运用酸、碱、盐的性质进行常见离子的检验与鉴别。
重点:掌握离子鉴别的一般方法
难点:了解混合物中离子鉴别的一般方法 学习过程: 1、【自主学习】 知识点梳理:常见离子的检验方法
(给合预习情况让学生交流、小结,由小组代表回答,师生点评。
) 注意:当Cl -和SO 42-同时存在时,应先鉴别SO 42-,后鉴别Cl -。
2、【考点例题】
现有三瓶无色溶液,分别是稀盐酸、蒸馏水和氢氧化钠溶液,请用化学方法
现有失去标签的两瓶无色溶液,编号是(1)(2),它们分别是Na 2CO 3溶液和NaCl 溶液中的一种,请提出实验方案加以区别。
要求:在不选用酸碱指示剂、pH 试纸的情况下,按表中方法一(示例)填写。
所选试剂须属不同物质类别(物质类别是指酸、碱、盐等)。
(提供的试剂:稀HCl 、Ba(NO 3)2溶液、 CaCl 2溶液、KCl 溶液 ) (小组讨论实验方案、探究实验、观察现象、分析结果 ,完成表格。
)
某溶液可能含有Na 2SO 4、Na 2CO 3和NaCl 三种溶质。
欲证明其中SO 42-、CO 32-、-
仓库中有一包氮肥的包装标签模糊不清,有同学进行了以下探究:
(1)操作③用玻棒搅拌的目的是 。
(2)请完成下表(已知AgCl 和BaSO 4是难溶于水和酸的白色固体): 若现象Ⅲ、Ⅳ都无现象,则该氮肥可能是_________(写化学式);若操作②现象为无气味、现象Ⅲ、Ⅳ无现象,则该氮肥可能是 (只写一种)。
知识要点:1. 除杂题:解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
2. 混合物的分离:(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。
即冷却热饱和溶液的方法加以分离。
如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。
如BaCl2和NaCl的混合物。
可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。
将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。
BaCO3+2HCl =BaCl2+H2O+CO2↑。
最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和] BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留。
3. 物质的鉴别:鉴别是通过化学实验将几种不同特性的物质区别开来。
如鉴别两瓶无色溶液哪瓶是NaCl或KNO3。
初中化学常见离子检验教案学校:XX初中年级:九年级科目:化学单元:常见离子检验教案编写人:XXX教学目标:1. 了解常见离子的化学性质;2. 掌握离子的检验方法及操作步骤;3. 培养学生的实验操作能力和实验技巧。
教学重点:1. 常见离子的检验方法;2. 了解离子的化学性质。
教学难点:1. 掌握离子检验方法的实验操作步骤;2. 学生在实验中的操作技巧。
教学准备:1. 实验室用品:试管、试管架、试管夹、玻璃棒、滴管等;2. 实验物质:氯化钠溶液、硫酸钠溶液、氢氧化钠溶液、硫酸铜溶液等;3. 实验操作步骤及实验记录表。
教学过程:1. 实验前的准备工作:(1) 加热试管,用玻璃棒将试管内的溶液搅拌均匀;(2) 准备好离子溶液及所需的试剂。
2. 实验步骤:(1) 氯离子的检验:用硫酸铜溶液检验氯离子,当加入硫酸铜溶液后出现白色沉淀即为氯离子的存在。
(2) 硫酸根离子的检验:用钡离子溶液检验硫酸根离子,当加入钡离子溶液后出现白色沉淀即为硫酸根离子的存在。
(3) 钠离子的检验:用氯化银溶液检验钠离子,当加入氯化银溶液后出现黄色沉淀即为钠离子的存在。
(4) 铁离子的检验:用氢氧化钠溶液检验铁离子,当加入氢氧化钠溶液后出现深绿色沉淀即为铁离子的存在。
3. 完成实验记录表。
教学反思:通过本次实验,学生们对常见离子的检验方法有了更深入的了解,掌握了离子检验的操作步骤和技巧。
同时,也培养了学生的实验操作能力和实验技巧,提高了他们的实验思维和实验能力。
希望学生们在今后的学习中能够更加积极地参与实验,提高自己的实验技能和实验水平。
初中化学中考常见离子的鉴别
一、+H
1. 鉴别原理:+H 能使紫色石蕊试液变红。
鉴别方法:向待鉴别溶液样品中滴加紫色石蕊试液,若溶液变红,说明溶液中含有+H 。
2. 鉴别原理:+H 能与活泼金属反应生成氢气(仅限于鉴别稀HCl 、稀42SO H )。
鉴别方法:向待鉴别溶液样品中加入少量锌粒,若溶液中有气泡冒出,说明溶液中含有+H 。
3. 鉴别原理:金属氧化物能与+H 反应,使溶液变色。
鉴别方法:向待鉴别溶液样品中加入少量氧化铜粉末,若溶液变蓝,说明溶液中含有+H 。
注意事项:以上方法中,第一种方法为常规鉴别方法,后两种方法可用于特殊鉴别题中。
二、-OH
1. 鉴别原理:-OH 能使无色酚酞试液变红。
鉴别方法:向待鉴别溶液样品中滴加无色酚酞试液,若溶液变红,说明溶液中含有-OH 。
2. 鉴别原理:-OH 能与+4NH 反应,生成具有刺激性气味的氨气。
鉴别方法:向待鉴别溶液样品中滴加氯化铵溶液,若产生具有刺激性气味的气体,说明溶液中含有-OH 。
注意事项:以上方法中,第一种方法 常规鉴别方法,第二种方法可用于特殊的鉴别题中。
三、-Cl
鉴别原理:-Cl 能与+Ag 反应生成不溶于酸的白色沉淀AgCl 。
鉴别方法:向待鉴别溶液样品中滴加3AgNO 溶液,若产生白色沉淀,再向溶液中滴加稀3HNO ,沉淀不溶解,说明溶液中含有-Cl 。
注意事项:能与+Ag 反应生成白色沉淀的还有--2324CO SO 、等离子,但只有AgCl 沉淀不溶于稀3HNO ,因此,滴加稀3HNO 这一步不能省略。
四、-2
4SO
鉴别原理:-24SO 能与+2Ba 反应生成不溶于酸的白色沉淀4BaSO 。
鉴别方法:向待鉴别溶液样品中滴加23)NO (Ba 溶液,若产生白色沉淀,再向溶液中滴加稀3HNO ,若沉淀不溶解,说明溶液中含有-24SO 。
注意事项: (1)能与+2Ba 反应生成白色沉淀的还有-23CO 等离子,但只有4BaSO 沉淀不溶于稀
3HNO ,因此,滴加稀3HNO 这一步不能省略。
(2)不能用2BaCl 溶液鉴别-2
4SO ,因为2BaCl 溶液中含有-Cl ,若待鉴别溶液中不含-2
4SO 而含有+Ag ,由于-Cl 可与+Ag 反应生成不溶于酸的白色沉淀AgCl ,同样会产生上述现象。
五、-23CO 和-3HCO
鉴别原理:-23CO 和-3HCO 都能与+H 反应生成O H 2和2CO ,但不同的是,-23CO 显
弱碱性,-3HCO 显弱酸性。
鉴别方法:向待鉴别溶液中滴加稀HCl ,若生成气体,将生成的气体通入澄清石灰水,
澄清石灰水变浑浊,说明溶液中含有-23CO 或-3HCO 。
再向原待鉴别溶液中滴加紫色石蕊试
液,若溶液变红,说明溶液中含有-3HCO ,若溶液变蓝,说明溶液中含有-23CO 。
注意事项:鉴别时,所加稀HCl 的溶质质量分数不可太大。
若溶质质量分数过大,生成的2CO 气体中将混有挥发出的HCl 气体。
将生成的气体通入澄清石灰水,不会出现澄清
石灰水变浑浊的现象,从而影响对-23CO 或-3HCO 的鉴别。
六、+
4NH
鉴别原理:+4NH 能与-OH 反应生成具有刺激性气味的氨气。
鉴别方法:向待鉴别溶液样品中滴加氢氧化钠溶液,若产生具有刺激性气味的气体,说明溶液中含有+
4NH 。
七、-
+++4322MnO Fe Fe Cu 、、、
鉴别原理:这些离子的溶液都有颜色,因此只需观察溶液的颜色即可判断溶液中是否含有这些离子。
(注:在溶液中+2Cu 显蓝色、+2Fe 显浅绿色、+3Fe 显黄色、-4MnO 显紫色)
[巩固练习]
1. 下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别出来的是( )
A. KCl CuSO NaOH )NO (Fe 433、、、
B. 33HNO HCl AgNO KCl 、、、
C. 234BaCl KNO NaCl CuSO 、、、
D. HCl CO Na SO Na BaCl 32422、、、
2. 有三瓶无标签的无色溶液,只知道它们分别是稀盐酸、2BaCl 溶液和3KNO 溶液中的一种。
下列四种溶液中,能将这三种无色溶液一次鉴别出来的是( )。
A. NaCl 溶液
B. 稀硫酸
C. 32CO K 溶液
D. 3AgNO 溶液
参考答案:1. AD
2. C。