有关格式试剂的总结
- 格式:doc
- 大小:24.00 KB
- 文档页数:5

格式试剂的matteson反应1. 简介格式试剂的matteson反应是一种重要的有机合成方法,通过matteson反应可以将烷基、烷基卤化物或烷基磺酰氟与铝锂合金反应,生成对映选择性较高的烷基锂,从而实现对手性有机化合物的合成。
该反应被广泛应用于医药、农药和化工领域,具有重要的应用价值。
2. matteson反应的机理matteson反应的机理主要包括三个步骤:第一步是烷基卤化物与铝锂合金反应,生成烷基锂中间体;第二步是烷基锂中间体与叔丁基磺酰氟反应,生成亚硫醚化合物;第三步是亚硫醚化合物与溴化碘反应,生成对映选择性较高的烷基碘化物。
3. matteson反应的优势(1)对手性选择性高:matteson反应能够生成对映选择性较高的烷基碘化物,具有较好的对映选择性;(2)多样性:该方法可以应用于多种烷基卤化物和磺酰氟试剂,具有较高的适用范围;(3)高产率:matteson反应在适当的条件下能够得到较高的产率,具有较好的合成效率。
4. matteson反应的应用matteson反应已被广泛应用于有机化合物的合成领域,尤其在药物合成中发挥着重要作用。
matteson反应被用于合成多种对手性药物和生物活性化合物,为医药研发提供了重要的合成手段。
matteson反应也在农药和化工领域有着重要的应用,为产业发展做出了贡献。
5. 总结matteson反应作为一种重要的有机合成方法,具有较好的对手性选择性、多样性和高产率,已被广泛应用于医药、农药和化工等领域。
随着有机合成技术的不断发展,matteson反应将在更多领域展现其重要作用,为有机化合物的合成提供更多可能性。
6. matteson反应在医药领域的应用matteson反应在医药领域具有广泛的应用。
通过matteson反应可以合成各种对映选择性较高的有机分子,这对于药物的研发和生产具有重要意义。
一些手性药物分子往往具有特定的生物活性,而matteson 反应可以提供高效的手性合成路径,从而合成出具有理想活性的化合物。

格式试剂的名词解释在化学领域中,格式试剂是一种常用的实验室试剂,其主要功能是用于对化合物进行分析和检测。
它们具有特定的组成和特性,可以在实验过程中发挥重要作用。
一、格式试剂的定义和分类格式试剂是指具有一定纯度和特殊用途的化学试剂,用于在实验中确定物质的性质、测定物质的含量或进行化学反应。
根据其用途和特性,格式试剂可以分为不同的类别。
1. 无机格式试剂:无机格式试剂主要由金属盐和无机酸、碱等组成。
例如,硫酸、盐酸、氢氧化钠等常见的无机格式试剂,它们常用于酸碱中和反应、无机盐的合成和浓度测定等实验。
2. 有机格式试剂:有机格式试剂主要由有机化合物组成,例如,乙醇、甲苯、醚类化合物等。
它们常用于有机合成反应、有机物性质的测定、鉴定和分离等实验。
3. 分析格式试剂:分析格式试剂主要用于分析化学实验中,用于检测和分析物质的成分和性质。
例如,石墨烯、硫酸铜、硫酸铁等分析格式试剂,在化学分析中常用于定性分析、定量分析和质量分析等实验。
二、常见格式试剂及其应用1. 酸碱类格式试剂:酸碱类格式试剂是进行酸碱反应和中和反应时常用的试剂。
例如,盐酸、硫酸、氢氧化钠等常用的酸碱类格式试剂,在中学化学实验中常用于气体制备、酸碱溶液的中和及滴定实验等。
2. 氧化还原类格式试剂:氧化还原反应是化学实验中常见的一类反应。
而氧化还原类格式试剂则用于促使这一类反应的进行。
例如,硫酸铜、硫酸亚铁等常用的氧化还原类格式试剂,在实验中常用于酸化还原滴定、氧化反应的观察和分析等。
3. 水质检测类格式试剂:水质检测是环境科学和水文学中的重要内容。
而水质检测类格式试剂常用于对水中各种化学指标的检测和分析。
例如,溴酸盐试剂、氨氮试剂等常用的水质检测类格式试剂,用于对水中物质的浓度和成分进行测定。
4. 有机合成类格式试剂:有机合成是有机化学中的重要领域。
而有机合成类格式试剂用于有机合成反应的进行和有机物质的分离和纯化。
例如,溴化钠、氢氧化钾等常用的有机合成类格式试剂,在实验室中常用于有机合成反应的催化剂和试剂。

有关格式试剂(Grignard_reagent)的总结由有机卤素化合物(卤代烷、活泼卤代芳烃)与金属镁在绝对无水乙醚中反应形成有机镁试剂,称为“格林尼亚试剂”,简称“格氏试剂”。
后法国化学家诺尔芒于1953年以四氢化呋喃(THF)作为溶剂得到了格氏试剂。
该项改进称为“格林尼亚-诺尔芒反应”。
现常用卤代烃与镁粉在无水乙醚或四氢呋喃(THF)中反应制得,制备过程必须在绝对无水无二氧化碳无乙醇等具有活泼氢的物质(如:水、醇、氨NH3、卤化氢、末端炔等)条件下进行。
通常以通式RMgX表示。
格式试剂是一种活泼的有机合成试剂,能进行多种反应,主要包括:烷基化反应,羰基加成,共轭加成,及卤代烃还原等。
格式试剂一般有两种,1:氯苯类(氯化苄)在乙醚(四氢呋喃)下和镁反应,2:溴代环戊烷在乙醚(四氢呋喃)下和镁(锌)反应。
1 格式试剂的溴代苯,格式的操作分为几类:第一类:高温引发,回流滴加,保持回流1h以使反应完全,这适合活性中等的溴代苯,如对甲基溴苯;第二类:高温不好引发,需加引发剂,如碘、1,2-二溴乙烷、其他的溴代烃或DIBALH 等,引发后,回流滴加,保持回流1h以使反应完全,这适合活性比较低的溴代烃,如对甲氧基溴苯;第三类:常温即可引发,常温滴加,保持常温12h以上以使反应完全,这适合活性比较高的溴代烃,如多氟代溴苯(氟非邻位);2 做格式时溴苯的活性:1,有供电子基则活性低比较难以引发,有吸电子基则活性高比较好引发;2,有供电子基则形成的格式试剂稳定,偶联等副反应较少,有吸电子基则形成的格式试剂比较不稳定,偶联等副反应较多;3,溴的邻位有其他卤素时形成的格式试剂最不稳定,易发生消除生成经由苯炔中间体的其他副产物;4,苄位和烯丙位的格式也比较不稳定,自身偶联较多;3 关于做苄基和烯丙基格式试剂:溶剂最好用甲基四氢呋喃,副产物少,用THF做溶剂通常得到的是副产物联苄,也有提出用甲叔醚代替THF以减少偶联副反应。

羰基化合物与格氏试剂的反应一、引言羰基化合物是含有碳氧双键(C=O)的有机化合物,是有机化学中非常重要的一类化合物。
羰基化合物与格氏试剂(Gilman reagents)之间的反应是有机合成中常用的重要反应之一。
格氏试剂由有机锂或有机镁卤化物与铜(I)盐反应制得,通常具有R2CuLi或R2CuMgX的结构。
羰基化合物与格氏试剂发生反应,常见的反应类型包括亲核加成、取代、还原等。
这些反应可以在不同位置上改变羰基化合物的结构,并且能够构建新的碳-碳键和碳-异原子键。
本文将详细介绍羰基化合物与格氏试剂之间常见的几种反应类型及其具体机理。
二、亲核加成反应亲核加成是羰基化合物与格氏试剂最常见的反应类型之一。
在这种反应中,格氏试剂中的亲核性金属(如Cu)攻击羰基碳上的电子缺陷,形成一个新的C-C键。
1. 酮的亲核加成反应酮的亲核加成反应通常使用R2CuLi作为格氏试剂。
在反应中,格氏试剂中的亲核Cu离子攻击酮分子的羰基碳,生成一个中间体。
随后,中间体与水分子发生质子转移,得到醇产物。
反应机理如下:1. R2CuLi + RC(=O)R' -> R2C(CuLi)OR'2. R2C(CuLi)OR' + H2O -> R2COH + R'OH2. 醛的亲核加成反应醛的亲核加成反应与酮的亲核加成反应类似,也是使用R2CuLi作为格氏试剂。
不同之处在于,在水分子质子转移生成醇产物之前,还需要进行脱水反应。
反应机理如下:1. R2CuLi + RC(=O)H -> R2C(CuLi)OH2. R2C(CuLi)OH -> RCH=CRR' + LiOH3. RCH=CRR' + H2O -> RCH(OH)CRR'三、取代反应除了亲核加成反应外,羰基化合物与格氏试剂还可以发生取代反应。
在这种反应中,格氏试剂中的亲核性金属攻击羰基碳上的电子缺陷,形成一个中间体。

格式试剂与烯烃的反应格式试剂与烯烃的反应是有机化学中一个非常重要的反应类型。
它广泛应用于有机合成、医学、材料科学等领域。
在这篇文章中,我们将会介绍关于格式试剂与烯烃反应的一些基本知识。
一、格式试剂的定义格式试剂是一种常见的有机物化学试剂,通常指甲醛或者乙二醇二甲醚磺酸二盐酸盐等物质。
它们都可以被用作烷基化反应的反应物或还原剂。
二、烯烃的定义烯烃是一种化学结构式具有C=C双键的碳氢化合物,它的化学性质非常活泼,可以发生各种反应。
三、格式试剂与烯烃的反应机理在格式试剂与烯烃的反应中,格式试剂作为亲电试剂,攻击烯烃上的碳碳双键形成一个碳-甲酰基中间体,同时将氢移动到另一个碳原子上去。
然后,烯烃中的自由电子对被攻击的碳原子进行亲核攻击,将其从甲酰基中解放出来,形成连续的烷基链,并生成一个新的C=O 键。
四、格式试剂与烯烃的主要反应类型在格式试剂和烯烃的反应中,主要有两种反应类型:1. 包含烯烃的双加成反应(例如:1,4-加成和1,2-加成)该反应在一系列的有机合成中大量应用,生成了各种不同的化合物。
例如1,4-加成反应产生的化合物包括两个醛基,可以通过环己酮氧化制成环己烷-1,4-二酮。
1,2-加成反应可以生成α-烯醇,可以作为重要的中间体参与其它反应。
2. 礼扎尔型反应礼扎尔型反应是指甲醛与非共轭烯烃反应形成五元环的反应。
这种反应有两种机制,其中一种涉及两个中间体和三个不同的反应步骤。
五、总结总体来说,格式试剂与烯烃的反应机理相对简单,但是化合物的结构种类非常多。
这种反应在有机化学中应用广泛,包括医药化学、材料科学及有机合成等领域。
因此,了解该反应机理和具体反应类型是很有意义的,也能在有机化学研究上取得很大的进展。

2024年高考化学实验常用试剂性质总结试剂是化学实验中常用的物质,根据其性质的不同,可以起到不同的作用。
以下是2024年高考化学实验中常用的一些试剂及其性质总结。
1. 硫酸(H2SO4):性质:硫酸呈无色、无臭的油状液体,具有强酸性。
在常温下能与水剧烈反应,产生大量热量。
浓硫酸对有机物具有脱水、温和氧化和酸催化裂解作用。
但浓硫酸具有强腐蚀性,操作时要注意安全。
常用实验:(1)浓硫酸脱水实验:浓硫酸能脱去物质中的水分,常用于脱水试验。
(2)硫酸氧化实验:浓硫酸可以作为强氧化剂,对某些有机物具有氧化作用。
(3)与金属反应实验:浓硫酸与大部分金属反应,生成相应的盐和氢气。
2. 盐酸(HCl):性质:盐酸是一种清澈的无色液体,具有强酸性。
它能与碳酸钙等一些碱性物质反应,产生气体。
盐酸也具有刺激性气味,操作时需注意防护。
常用实验:(1)酸碱中和实验:盐酸可以和碱反应,生成盐和水。
(2)酸放气实验:盐酸可以和碳酸钙反应,产生二氧化碳气体。
3. 硝酸(HNO3):性质:硝酸呈无色、无臭的液体,具有强酸性。
它能与多种物质反应,如金属、非金属、有机物等。
浓硝酸具有强氧化性,能够与某些物质发生氧化反应。
常用实验:(1)金属与酸反应实验:浓硝酸与金属反应,生成相应的盐和气体。
(2)硝酸氧化实验:浓硝酸可以作为强氧化剂,对某些有机物具有氧化作用。
4. 氢氧化钠(NaOH):性质:氢氧化钠呈固体或溶液的形式存在,具有强碱性。
它能与酸反应,产生盐和水。
氢氧化钠腐蚀性较强,操作时需注意安全。
常用实验:(1)酸碱中和实验:氢氧化钠可以和酸反应,生成盐和水。
(2)氢氧化钠与金属反应实验:氢氧化钠能够与某些金属反应,产生相应的盐和氢气。
5. 碳酸氢钠(NaHCO3):性质:碳酸氢钠呈白色固体,能溶于水。
它能与酸反应,产生盐和二氧化碳气体。
碳酸氢钠是一种温和的碱,操作时相对较安全。
常用实验:(1)酸放气实验:碳酸氢钠与酸反应,产生二氧化碳气体。

格氏试剂的反应总结格氏试剂是一种常用的化学试剂,它可以用于多种化学反应。
本文将对格氏试剂的反应进行总结。
一、格氏试剂的定义和特点格氏试剂是由二氧化硫和硫酸混合而成的化学试剂。
它具有较强的氧化性和还原性,可用于许多化学反应中。
格氏试剂常以无色或淡黄色液体形式存在,具有刺激性气味,并能与水反应生成硫酸和二氧化硫。
二、格氏试剂的反应类型1. 氧化反应格氏试剂可以将许多物质氧化,例如可以将亚硫酸盐氧化为硫酸盐。
此外,格氏试剂还可以将醛氧化为酸,还原剂氧化为氧化剂。
2. 还原反应格氏试剂可以将某些氧化剂还原为还原剂。
例如,格氏试剂可以将高锰酸钾还原为二氧化锰。
3. 羟基化反应格氏试剂可以与某些化合物发生羟基化反应,生成羟基化产物。
例如,格氏试剂可以与醛或酮反应,生成相应的羟基化产物。
4. 缩合反应格氏试剂可以与某些化合物发生缩合反应,生成缩合产物。
例如,格氏试剂可以与胺反应,生成相应的亚硫酸酯。
5. 氨基化反应格氏试剂可以与某些化合物发生氨基化反应,生成氨基化产物。
例如,格氏试剂可以与醛或酮反应,生成相应的氨基化产物。
6. 脱氧反应格氏试剂可以将某些化合物中的氧原子脱除,生成脱氧产物。
例如,格氏试剂可以将酮脱氧为烯醇。
7. 脱羧反应格氏试剂可以将某些羧酸脱羧,生成脱羧产物。
例如,格氏试剂可以将羧酸脱羧为醛。
8. 加成反应格氏试剂可以与某些烯烃发生加成反应,生成加成产物。
例如,格氏试剂可以与烯烃发生加成反应,生成相应的硫醇。
三、格氏试剂的应用领域由于格氏试剂具有多种反应类型,它在化学领域有广泛的应用。
1. 有机合成格氏试剂可以用于有机合成中,例如用于合成醛、酮、烯醇等有机化合物。
格氏试剂的氧化性和还原性使其在有机合成反应中起到重要的作用。
2. 分析化学格氏试剂可以用于分析化学中,例如用于测定亚硫酸盐、羧酸、醛、酮等物质的含量。
格氏试剂的氧化性和还原性可以与许多物质发生反应,从而实现对这些物质的定量或定性分析。

溴甲烷格式试剂-概述说明以及解释1.引言1.1 概述概述溴甲烷,也被称为甲基溴,是一种常见的有机化合物。
它由一个碳原子和三个氢原子组成,其中一个氢原子被溴原子取代。
溴甲烷是一种重要的试剂,在有机合成以及化学实验中具有广泛的应用。
溴甲烷作为一种格式试剂,其化学性质相对稳定。
它是一种无色、具有刺激性气味的液体,在室温下易挥发。
由于其相对较低的沸点和挥发性,溴甲烷在实验室中常用于溶剂、提取剂、催化剂以及有机合成的重要原料。
在本文中,我们将详细介绍溴甲烷的化学性质、制备方法以及其作为格式试剂的应用。
希望通过对溴甲烷的系统研究,提高读者对溴甲烷的了解,并且展示其在化学领域中的重要性和多样化的应用。
1.2 文章结构文章结构部分的内容如下:文章结构:本文主要分为引言、正文和结论三个部分。
1. 引言引言部分概述了本文的研究对象——溴甲烷格式试剂,并介绍了本文的目的。
本文旨在对溴甲烷格式试剂进行详细的探讨,包括其化学性质和制备方法,并探讨其在化学领域中的应用。
2. 正文2.1 溴甲烷的化学性质:在正文的第一个部分,将对溴甲烷的化学性质进行详细的介绍。
包括其结构、物理性质和化学性质等方面的内容。
溴甲烷作为一种有机化合物,具有一系列的特性,这些特性在实验和工业中的应用非常广泛。
2.2 溴甲烷的制备方法:在正文的第二个部分,将探讨溴甲烷的制备方法。
主要包括传统的合成方法和现代的新型合成方法。
这些方法包括从天然气中提取和合成、从甲烷类化合物合成、催化剂的应用等方面,将对不同的制备方法进行详细的介绍和分析,评估它们的优缺点和适用范围。
3. 结论在结论部分,将总结本文的主要内容,并探讨溴甲烷格式试剂的应用。
分析溴甲烷格式试剂在化学实验、工业生产和科学研究等领域的应用价值,并对其未来的发展和研究方向进行展望。
通过这样一个清晰的结构,读者可以对溴甲烷格式试剂有一个全面的了解,并对其在化学领域的应用有更深入的了解和认识。
1.3 目的本文的目的是介绍溴甲烷格式试剂的特性和应用。

第1篇一、前言时光荏苒,转眼间,我在化工试剂岗位上已度过了一年的时间。
在这段时间里,我经历了从陌生到熟悉,从新手到有一定经验的转变。
现将我一年来的工作情况进行总结,以便更好地提高自身素质,为我国化工试剂事业贡献力量。
二、工作内容概述1. 试剂采购与储存在试剂采购方面,我认真了解各类试剂的性能、用途、规格等信息,确保采购的试剂符合实验室需求。
同时,我严格按照试剂储存规范,对试剂进行分类、编号、登记,确保试剂安全、有效。
2. 试剂配制与使用在试剂配制方面,我熟练掌握各类试剂的配制方法,严格按照配制比例进行操作,确保试剂质量。
在使用过程中,我严格遵守操作规程,对试剂进行检验、测试,确保试剂符合实验要求。
3. 试剂管理与维护在试剂管理方面,我定期对试剂进行盘点、清查,确保试剂账实相符。
同时,我对过期、失效的试剂进行妥善处理,避免浪费。
在维护方面,我定期检查试剂设备,确保其正常运行。
4. 试剂信息管理与更新我负责建立和完善实验室试剂信息管理系统,确保试剂信息准确、及时。
同时,我定期对试剂信息进行更新,提高信息系统的实用性。
三、工作成绩与不足1. 成绩(1)提高了试剂采购效率,确保实验室试剂供应充足。
(2)规范了试剂配制与使用流程,提高了实验质量。
(3)加强试剂管理,降低了试剂浪费。
(4)完善了试剂信息管理系统,提高了工作效率。
2. 不足(1)在试剂采购过程中,对某些试剂的性能了解不够深入,导致采购过程中出现偏差。
(2)在试剂配制过程中,对部分试剂的配制方法掌握不够熟练,影响了配制速度。
(3)在试剂信息管理方面,对部分试剂信息更新不及时,影响了信息系统的实用性。
四、合理化建议与努力方向1. 深入了解各类试剂的性能、用途、规格等信息,提高试剂采购准确性。
2. 加强自身业务学习,提高试剂配制与使用技能。
3. 优化试剂信息管理系统,确保试剂信息准确、及时。
4. 增强团队协作意识,与同事共同提高工作效率。
5. 积极参加培训,拓宽知识面,提高自身综合素质。

(一)反应题的重要考点:(1)烷烃的卤代反应,反应活性:①氟氯溴碘(F2>Cl2>Br2>I2);②活泼H原子的类型3〫>2〫>1°>CH3。
注意:药大考研常考察碳正离子稳定性,也会考察环烷烃的卤代开环(2)单烯烃的主要反应:①加成反应:催化加氢(注意:顺式加成)、亲电加成(X2、HX、H2SO4、H2O、BH3)、自由基加成(药大考研常考:HBr/ROOR(唯一));②氧化烯烃的反应(常用氧化剂总结:KMnO4/OH-(OsO4,药大考研官网推荐王积套课本有此氧化剂)、KMnO4/H+、O3、过氧酸、O2/Ag);③ɑ-H卤代(自由基取代反应);④聚合反应。
中国药科大学考研辅导南药人研路提示:马氏比较常考,但是反马加成也常涉及。
(3)炔烃和二烯烃的主要反应:①加成反应(林德拉、NaNH2/NH3(l)、亲电加成、自由基加成、亲核加成,这些加成反应类似烯烃的加成);②氧化反应;③炔氢的反应(注意);④聚合(一般不会考察);⑤D-A反应(多年考研真题中出现,重点掌握);⑥周环反应(开环和关环相应的条件下的顺旋和对旋)。
中国药科大学考研辅导南药人研路提示:2019年710真题第一次出现此知识点考查,注意掌握(常考炔烃部分加氢、与H2O加成生成醛酮;D-A反应等)(4)芳烃的主要反应:①亲电取代(注意:卤代、磺化、硝化、傅克反应、氯甲基化反应);②氧化反应;③α-H卤代(自由基);④加成反应。
中国药科大学考研辅导南药人研路提示:芳环上亲电取代的定位效应在药大考研中常考察,这个主要根据环上的电子云密度来判断;还有α-H的卤代。
(5)卤代烃的主要反应:①亲核取代、AgNO3(SN1);SN2的瓦尔登转化是药大历年重点!);②消除反应(HX(扎伊采夫规则,E2反式消除【特变注意】)、X2);③与金属反应(烷基铜锂,注意位阻,是1,2加成还是1,4加成,非常重要!);④还原产物为烃,常用还原剂:LiAlH4、NaBH4、Zn+HCL,醋酸等。
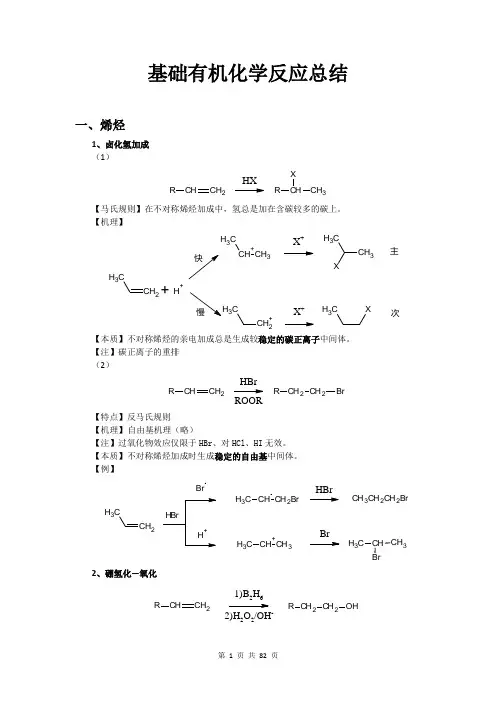
基础有机化学反应总结一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH 2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2B OCH 2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2BOC H 2CH 2CH 3CH 2CH 2CH 3H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH -CH 3HH OH3、X 2加成C CBr /CCl CC Br【机理】CC CC Br BrC Br +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
试剂销售个人工作总结在过去的一年里,我作为一名试剂销售个人,取得了一些非常可喜的成绩,同时也面临了一些挑战。
以下是我的工作总结:成绩:1. 实现了销售目标:我成功地达到了公司为我设定的销售目标,甚至超出了一些季度的预期。
通过与客户建立良好的关系,我能够更好地了解他们的需求,并为他们提供最合适的产品。
2. 扩大了客户群体:通过积极地开发新客户和保持老客户的忠诚度,我成功地扩大了客户群体,为公司带来了更多的业务机会。
3. 提高了跟单率:我通过不断学习和提高个人销售技巧,成功地提高了跟单率,让更多客户选择购买我推荐的产品。
挑战:1. 行业知识不足:由于公司的产品种类繁多,我在一开始对于一些特殊的试剂了解不够深入,导致在与客户沟通时有时无法满足他们的需求。
但我通过加强学习和了解产品知识,成功地克服了这一挑战。
2. 竞争激烈:试剂销售行业处于激烈的竞争环境中,每个客户都有多个供应商可以选择。
因此,我需要不断提高自己的销售技巧和服务质量,才能在竞争中脱颖而出。
总结:通过一年的努力和不断的学习,我在试剂销售领域取得了一些良好的成绩。
在未来的工作中,我将继续保持对客户的敏锐度,不断提高自己的销售技巧,为客户提供更好的服务,努力在激烈的竞争中取得更好的业绩。
同时,我也会注重行业知识的学习和积累,以应对更多的客户需求。
希望在未来的工作中能够取得更好的表现,为公司创造更大的价值。
自从我加入试剂销售团队以来,我始终保持着对工作的热情和奉献精神,始终坚信只有不断学习和努力提高自己的能力,才能在激烈的市场竞争中立于不败。
在过去的一年里,我不仅取得了一些令人欣喜的成绩,也面临了一些挑战,这些挑战成为我成长的契机。
在与客户沟通方面,我通过不断的努力和学习,提高了自己的沟通技巧。
在客户需求方面,我学会了倾听客户的需求,提供专业、针对性的解决方案。
在销售过程中,我更注重于与客户建立长期的合作伙伴关系,而非仅仅是一次性的交易。
这不仅使客户更加信任并选择我作为他们的供应商,也让我在销售活动中更加有成就感。
耗材试剂工作总结
在科研和实验室工作中,耗材试剂是必不可少的工具和材料。
它们对于实验的
成功与否起着至关重要的作用。
在过去的一段时间里,我有幸参与了耗材试剂的采购、使用和管理工作,积累了一些经验和体会,现在我将进行总结和分享。
首先,耗材试剂的采购是工作的重要一环。
在采购过程中,我们需要根据实验
的需求和预算情况,选择合适的试剂和耗材。
同时,我们也要关注产品的质量和供应商的信誉,确保所采购的产品能够满足实验的要求,并且能够及时供应。
在采购过程中,及时了解市场行情和相关政策也是非常重要的。
其次,耗材试剂的使用也是至关重要的。
在使用过程中,我们需要严格按照操
作规程进行,确保实验的准确性和可重复性。
同时,我们也要注意试剂的保存和处理,避免因为不当的操作而造成试剂的浪费和损坏。
另外,对于一些易燃易爆的试剂,我们也要严格遵守安全操作规程,确保实验过程中的安全。
最后,耗材试剂的管理也是我们工作中需要重视的一环。
在管理过程中,我们
需要建立起完善的试剂台账和库存管理系统,及时更新试剂的使用情况和库存情况。
同时,我们也要注意试剂的过期处理和废弃物的处理,确保实验室的环境卫生和安全。
另外,我们也要与供应商保持良好的沟通和合作关系,确保试剂的供应和售后服务。
总的来说,耗材试剂的工作是一项细致而重要的工作。
只有在采购、使用和管
理过程中严格把关,才能够保证实验的顺利进行和数据的准确性。
希望通过我们的努力,能够为科研工作的顺利进行和实验室的安全管理做出贡献。
试剂保存知识点总结一、常见试剂的保存知识1. 酸碱试剂酸碱试剂一般采用塑料瓶或玻璃瓶保存,保存时应尽量避免潮湿环境,以免试剂自身与水反应。
另外,酸碱试剂在保存过程中要尽量避免长时间背光照射,以免试剂受到光照而发生化学变化。
此外,酸碱试剂在保存时需密封,以免挥发。
2. 有机试剂有机试剂在保存时要注意避免阳光直射,以免试剂产生光化学反应而发生变化。
另外,有机试剂在储存过程中应远离高温、火种以及氧化剂,以免发生意外。
有机试剂在保存时一般采用密封瓶或密封袋,以防挥发或吸湿。
另外,一些易燃的有机试剂还需要采取专门的防火措施进行存储。
3. 金属试剂金属试剂在保存时要远离酸碱试剂和氧化剂,以免发生剧烈反应,产生危险。
另外,金属试剂在保存过程中要避免受潮或受到湿气,以免发生氧化腐蚀。
金属试剂在使用过程中还需要谨慎操作,以免发生意外。
4. 离子试剂离子试剂在保存时一般需要密封,以免受潮。
另外,离子试剂的保存温度一般要求在常温下,避免高温或低温环境。
在使用过程中要注意防止混淆、错用,以免影响实验结果。
5. 生化试剂生化试剂在保存过程中需要注意保持低温,以延长试剂的使用寿命。
另外,生化试剂在保存时要密封,以防止受潮或被污染。
在使用过程中需要注意防止交叉污染,以免影响实验结果。
二、试剂保存的常见问题及应对方法1. 潮湿潮湿是试剂保存过程中常见的问题,容易导致试剂的性质发生变化。
为了避免试剂受潮,可以采取密封保存的方法,选择干燥的环境储存,或者使用干燥剂进行吸湿。
2. 氧化一些试剂容易发生氧化反应,导致试剂失效。
为了避免试剂氧化,可以采取密封保存,避免与氧化剂接触,以及选择适当的储存温度等措施。
3. 挥发一些试剂具有较强的挥发性,容易在保存过程中挥发失效。
为了避免试剂的挥发,可以选择密封容器保存,避免高温环境以及选择适当的储存温度。
4. 温度问题试剂的保存温度对其性质和使用寿命有重要影响。
一般来说,低温可以延长试剂的使用寿命,但并非所有试剂都适宜存放在低温环境中。
由有机卤素化合物(卤代烷、活泼卤代芳烃)与金属镁在绝对无水乙醚中反应形成有机镁试剂,称为“格林尼亚试剂”,简称“格氏试剂”。
后法国化学家诺尔芒于1953年以四氢化呋喃(THF)作为溶剂得到了格氏试剂。
该项改进称为“格林尼亚-诺尔芒反应”。
现常用卤代烃与镁粉在无水乙醚或四氢呋喃(THF)中反应制得,制备过程必须在绝对无水无二氧化碳无乙醇等具有活泼氢的物质(如:水、醇、氨NH3、卤化氢、末端炔等)条件下进行。
通常以通式RMgX表示。
格式试剂是一种活泼的有机合成试剂,能进行多种反应,主要包括:烷基化反应,羰基加成,共轭加成,及卤代烃还原等。
格式试剂一般有两种,1:氯苯类(氯化苄)在乙醚(四氢呋喃)下和镁反应,2:溴代环戊烷在乙醚(四氢呋喃)下和镁(锌)反应。
1 格式试剂的溴代苯,格式的操作分为几类:第一类:高温引发,回流滴加,保持回流1h以使反应完全,这适合活性中等的溴代苯,如对甲基溴苯;第二类:高温不好引发,需加引发剂,如碘、1,2-二溴乙烷、其他的溴代烃或DIBALH 等,引发后,回流滴加,保持回流1h以使反应完全,这适合活性比较低的溴代烃,如对甲氧基溴苯;第三类:常温即可引发,常温滴加,保持常温12h以上以使反应完全,这适合活性比较高的溴代烃,如多氟代溴苯(氟非邻位);2 做格式时溴苯的活性:1,有供电子基则活性低比较难以引发,有吸电子基则活性高比较好引发;2,有供电子基则形成的格式试剂稳定,偶联等副反应较少,有吸电子基则形成的格式试剂比较不稳定,偶联等副反应较多;3,溴的邻位有其他卤素时形成的格式试剂最不稳定,易发生消除生成经由苯炔中间体的其他副产物;4,苄位和烯丙位的格式也比较不稳定,自身偶联较多;3 关于做苄基和烯丙基格式试剂:溶剂最好用甲基四氢呋喃,副产物少,用THF做溶剂通常得到的是副产物联苄,也有提出用甲叔醚代替THF以减少偶联副反应。
THF一般好引发,换用其他溶剂不见得好引发,可以考虑先用THF引发后再补加主要溶剂如MeTHF。
对氟苯基溴化镁格式试剂-概述说明以及解释1.引言1.1 概述氟苯基溴化镁格式试剂是一种常用的有机合成试剂,广泛应用于有机合成领域。
它以氟苯基溴化镁为主要原料,并通过特定的合成方法制备而成。
氟苯基溴化镁具有较高的反应活性和化学稳定性,可以作为有机合成中的重要中间体或试剂参与多种有机反应。
因其特殊的化学性质,氟苯基溴化镁格式试剂在药物合成、功能材料合成以及天然产物全合成等领域具有重要的应用价值。
本文的主要目的是对氟苯基溴化镁格式试剂进行全面而深入的探讨。
首先,本文将介绍氟苯基溴化镁格式试剂的定义与原理,包括其组成结构和反应机理等方面的内容。
其次,本文将详细阐述氟苯基溴化镁格式试剂的制备方法,包括反应条件、催化剂选择和工艺优化等方面的内容。
最后,本文还将探讨氟苯基溴化镁格式试剂在药物合成、功能材料合成以及天然产物全合成等领域的应用,展示其在不同领域中的潜力和前景。
通过本文的撰写,旨在全面而系统地介绍氟苯基溴化镁格式试剂的相关知识,为读者提供一个深入了解该试剂的机会。
同时,本文还将对该试剂的研究现状进行总结,并展望未来在该领域的发展方向。
最后,本文将给出对氟苯基溴化镁格式试剂的总结和结论,为读者提供一个全面而系统的认识。
1.2文章结构1.2 文章结构本文将围绕氟苯基溴化镁格试剂展开详细的讨论和探索。
具体的文章结构如下:第2节将介绍氟苯基溴化镁格式试剂的定义与原理。
我们将详细解释什么是氟苯基溴化镁格试剂,以及它的原理和工作原理。
通过了解其定义和原理,读者能够更好地理解该试剂的特性和功能。
第3节将介绍氟苯基溴化镁格试剂的制备方法。
我们将列举不同的制备方法,包括传统的合成方法和最新的研究进展。
读者可以从中了解到制备氟苯基溴化镁格试剂的不同技术和步骤,以及每种方法的优缺点。
第4节将探讨氟苯基溴化镁格试剂的应用领域。
我们将详细介绍该试剂在有机合成、药物研究、材料科学等领域的广泛应用。
通过了解其应用领域,读者能够了解到氟苯基溴化镁格试剂在不同领域的作用和意义。
格氏反应卤代烃在无水乙醚或四氢呋喃中和金属镁作用生成烷基卤化镁RMgX,这种有机镁化合物被称作格氏试剂(Grignard Reagent)。
格氏试剂可以与醛、酮等化合物发生加成反应,经水解后生成醇,这类反应被称作格氏反应(Grignard Reaction)。
格氏试剂是有机合成中应用最为广泛的试剂之一,它是由法国化学家格林尼亚(V.Grignard)发明的。
1871年,格林尼亚生于法国塞堡(Cherbourg Frace)。
当他在里昂(Lyons)大学学习时,曾师从巴比亚(P.A.Barbier)教授。
当时,巴比亚主要从事有机锌化合物的研究,他以锌和碘甲烷反应得到二甲基锌,这种有机锌化合物被用作甲基化试剂。
后来,巴比亚又以金属镁替代锌来进行尝试,也获得相似的金属有机化合物,不过反应条件比较苛刻。
于是。
巴比亚便让格林那继续对有机镁化合物的制备作深入研究。
研究发现,用碘甲烷和金属镁在乙醚介质中反应可以方便地得到新的化合物,不经分离而直接加入醛或酮就会发生进一步反应,反应产物经水解后可以得到相应的醇。
其反应过程可表示为:后来的研究表明,烷基卤化镁(即格氏试剂)可以用于许多反应,应用范围极广,因而很快成为有机合成中最常用的试剂之一。
格氏试剂的发明极大地促进了有机合成的发展,格林尼亚因此而获得1912年诺贝尔化学奖。
通常,各种卤代烃和镁反应都可以生成格氏试剂。
不过,不同的卤代烃与镁反应活性有差异。
一般来讲,当烷基相同时,碘代烷最易反应,氟代烃活性最差(实际上还没有人用氟代烃制RI>RBr>RCI>>RF当卤素原子不变时,苄基卤代烃和烯丙基卤代烃活性最高,乙烯基卤代烃活性最低:ArCH2X、CH2=CHCH2X>30RX>20RX>10RX>CH2=CHX格氏试剂对水十分敏感。
事实上,凡是具有活泼氢的化合物都可以和格氏试剂反应,例如醇、末端炔烃、伯胺及羧酸等。
因此,在制备格氏试剂时,应该使用无水试剂和干燥的仪器。
由有机卤素化合物(卤代烷、活泼卤代芳烃)与金属镁在绝对无水乙醚中反应形成有机镁试剂,称为“格林尼亚试剂”,简称“格氏试剂”。
后法国化学家诺尔芒于1953年以四氢化呋喃(THF)作为溶剂得到了格氏试剂。
该项改进称为“格林尼亚-诺尔芒反应”。
现常用卤代烃与镁粉在无水乙醚或四氢呋喃(THF)中反应制得,制备过程必须在绝对无水无二氧化碳无乙醇等具有活泼氢的物质(如:水、醇、氨NH3、卤化氢、末端炔等)条件下进行。
通常以通式RMgX表示。
格式试剂是一种活泼的有机合成试剂,能进行多种反应,主要包括:烷基化反应,羰基加成,共轭加成,及卤代烃还原等。
格式试剂一般有两种,1:氯苯类(氯化苄)在乙醚(四氢呋喃)下和镁反应,2:溴代环戊烷在乙醚(四氢呋喃)下和镁(锌)反应。
1 格式试剂的溴代苯,格式的操作分为几类:
第一类:高温引发,回流滴加,保持回流1h以使反应完全,这适合活性中等的溴代苯,如对甲基溴苯;
第二类:高温不好引发,需加引发剂,如碘、1,2-二溴乙烷、其他的溴代烃或DIBALH 等,引发后,回流滴加,保持回流1h以使反应完全,这适合活性比较低的溴代烃,如对甲氧基溴苯;
第三类:常温即可引发,常温滴加,保持常温12h以上以使反应完全,这适合活性比较高的溴代烃,如多氟代溴苯(氟非邻位);
2 做格式时溴苯的活性:
1,有供电子基则活性低比较难以引发,有吸电子基则活性高比较好引发;
2,有供电子基则形成的格式试剂稳定,偶联等副反应较少,有吸电子基则形成的格式试剂比较不稳定,偶联等副反应较多;
3,溴的邻位有其他卤素时形成的格式试剂最不稳定,易发生消除生成经由苯炔中间体的其他副产物;
4,苄位和烯丙位的格式也比较不稳定,自身偶联较多;
3 关于做苄基和烯丙基格式试剂:
溶剂最好用甲基四氢呋喃,副产物少,用THF做溶剂通常得到的是副产物联苄,也有提出用甲叔醚代替THF以减少偶联副反应。
THF一般好引发,换用其他溶剂不见得好引发,可以考虑先用THF引发后再补加主要溶剂如MeTHF。
4 格氏试剂大生产的13条总结
1.反应的原料,溶剂水份必须控制的,做了个预处理装置,将一批投料量的溶剂投入一锅中,锅底阀接一泵(防暴)打入4A分子筛填满的柱中,循环打2小时后打入格式锅中或滴加坛里。
简单一点就是在溶剂桶中加干燥剂,滚滚。
但这不推荐,比较危险。
2.反应体系的防水措施:反应锅跑气口加一由干燥剂做成的呼吸罐,投料时,回流完后冲氮气保护。
3.投料时,原料的管道跟溶剂的管道时分开的,不然会把在管道中的死体积的原料量带入反应锅中,投料完了,一开搅拌就冲料了。
4.投料时一定注意镁是否已加,数量是否准确,不然反应到镁消耗完了就停止反应了,这时一定不能补加镁,不然就冲料了或。
应该从上锅口将锅内的液体吸出到干燥的锅中,再加镁,溶剂,将吸出的液体滴加进去,不能从下口放料是因为锅底阀中会有一些镁没有被搅拌出来放料时会被带出立即跟原料反应,造成冲料。
5. 不管镁粉,镁屑,须是新鲜的,我觉得镁屑好一点,镁粉氧化层多,也容易氧化。
我以前呆的厂里专门有3台刨床加工跟刨花一样的,而且规定是多少丝厚度,新鲜的,表面积也好,据说是对格式的收率能提高很多。
6.检验反应体系是否已经引发:从反应锅里吊一小瓶反应液,加碘立即退色就是已经引发了,或滴加你本滴加的东西有气泡,放热就说明已引发。
这非常关键的。
如没有引发的处理,锅内加碘,少许溴乙烷进去,适当加温,或实验室做一瓶由溴乙烷引发的500克左右原料的格式液,回流半小时后加进去。
(不引发的几个原因:水分高,温度低,生成的格式浓度低)
7.格式液的颜色跟你的原料有关,做过的基本是灰色的。
8.尽量不用玻璃冷凝器,如用使用惰性无水溶剂做冷却液。
9.转移格式液可用虹吸法,一锅内干燥密闭抽真空后关闭真空阀将格式锅中的上清夜吸过来。
这样的好处是溶剂损失少,下锅格式也不用再引发了,直接加溶剂,镁,滴加就可。
下一步是滴加格式的话,可做上下层平台,上层的格式锅底阀上升入锅底一节管,管上口封了钻眼,反正滴加格式的速度不用太快的。
10.现在的THF价格吓人,加苯,甲苯替代一部分的THF,但会影响有些格式试剂的溶解度。
可加六甲基磷酰三胺助溶。
还可以在格式参与反应完后蒸出一部分溶剂后水解,一定不能蒸干。
蒸出的溶剂最好是放在稀释原料中使用,不要放入格式锅中,如蒸出的溶剂中有与格式试剂反应的杂质,那就不能直接用了,需要处理。
另这几天看到甲基THF,介绍不错,沸点高,格式的溶解度大,水中的溶解度小,水解后分层清楚,回收容易,价格跟THF差不多,如果真是的话,那是做格式的福音了。
11.溶剂的回收处理,一锅中加二甘醇,NaOH,加热减压蒸水,至顶温在90度,算一下溶剂中的水分量与加的NaOH量确定加多少溶剂。
回流几小时,蒸出,水分基本在0。
2%以下的,锅内的二甘醇再蒸水循环使用。
回收的溶剂中有与格式反应的杂质的话,要把它处理掉。
12.格式反应过程中的监控:加显示温度计,观察回流速度来调节滴加的速度,上面的问题都注意的话一般在这里不太会出现什么问题了。
有的工厂滴加非常快,他是边冷却边滴加的,很牛,常人不敢这么做,国外的工厂是温度与滴加联动装置,温度是波浪性型的,滴加是断续的,滴加后等温度升高后降了再滴加的,哪个步骤没升温或温度高到某个设定值就报警了。
13.停产格式锅的处理,一定要当心,加无水溶剂,冷却,滴加萃灭剂
格式试剂是一种碳负离子,碳负离子能发生的比如和酸性H反应、对正电荷(如羰基)进攻等反应。
具体点就是和醇醛酮酸酯,氰基反应,催化剂存在时也能和卤代物偶联,也能和硼酸酯反应,还能和邻二联吡啶等含氮多齿配体生成络合物。
与酰胺一般不反应
主要是亲核反应
由一卤代烷和金属镁制备的有机镁化合物称为格氏试剂,在格氏试剂中,碳原子与镁原子直接相连,从而使碳原子带负电,格氏试剂在与其他分子反应时,总是一对电子转移到别的分子中去。
格氏试剂的反应如下:
1.与含活泼氢的化合物反应
R-MgX + H-OH -------> R-H + MgX(OH) ----> R-H + MgX2 +Mg(OH)2
R-MgX + H-X -------> R-H + MgX2
R-MgX + H-OR -------> R-H + MgX(OR)
R-MgX + H-C≡C-R -------> R-H + MgX(C≡C-R)
R-MgX + H-NH2 -------> R-H + MgX(NH2)
R-MgX + H-CO2R -------> R-H + MgX(CO2R)
2.与O2作用
2RMgX + O2 -------> 2ROMgX --+H2O--> R-OH + MgX(OH)
3.与CO2作用
R-MgX + CO2 -------> R-CO2MgX --+酸--> R-CO2H + MgX(OH)
4.与羰基作用
HCOH + R-MgX -------> R-CH2-OMgX --+H2O--> R-CH2-OH + MgX(OH)
R-CHO + R'-MgX -------> RR'-CH-OMgX --+H2O--> RR'-CH-OH
RCOR + R'-MgX -------> R2R'-OMgX --+H2O--> R2R'-OH
5.与一些氯化物作用
CdCl2 + 2R-MgX -------> R2Cd + 2MgXCl
HgCl2 + 2R-MgX -------> R2Hg + 2MgXCl
SnCl4 + 4R-MgX -------> R4Sn + 4MgXCl
SiCl4 + 4R-MgX -------> R4Si + 4MgXCl
选择不同的反应物可以得到不同的醇,如:
注意氧原子连的镁卤基团只有经水解才能脱去。
实际上,研发这种试剂的初衷是找一种通过取代反应接长碳链的物质,然而反应速度很慢。
后来它在加成反应上的作用被发现,它才被广泛使用。
格氏试剂也可与RC≡N等发生加成:
R'C≡N + RMgX → R'(C=N)R
RMgX + H
2
O → RH + Mg(OH)X RMgX + ROH → RH + ROMgX RMgX + RCOOH → RH + RCOOMgX
RMgX + NH
3→ RH + NH
2
MgX
RMgX + RNH
2
→ RH + RNHMgX RMgX + RC≡CH → RH + RC≡CMgX
CdCl
2 + 2RMgX → R
2
Cd + 2MgClX
AlCl
3 + 3RMgX → R
3
Al + 3MgClX。